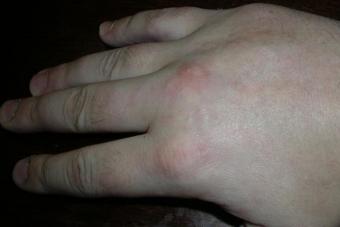
Kui nahapind muutub karedaks, sellele tekivad tumedad mugulad, võib see viidata ainevahetushäiretele, mis viib nendesse kohtadesse patoloogilise valgu, amüloidi, kogunemiseni. Arsti külastamist ei tohiks edasi lükata: võite oodata, kuni valk aja jooksul nahakoe asendab ja see lakkab oma funktsioone täitmast. Ilma korraliku ravita mõjutavad struktuurimuutused siseorganeid.
Kui kahjustatud on ainult naha kuded, diagnoositakse naha lihhenoidne amüloidoos. See on ravitav, jälgib nahaarst ja võib osutuda vajalikuks pidevalt kasutada kohalikke ravimeid. Kui haigus on süsteemne, ladestub amüloid siseorganitesse, raviga tegeleb terapeut ja teised spetsialistid. Järgmisena räägime sellest, kuidas neid haigusseisundeid eristada ja mida saab teha sümptomite ilmnemisel.
Mis on amüloidoos ja miks peaksime seda kartma
Amüloidoos on krooniline haigus, mis on valkude metabolismi rikkumine, mille tulemusena moodustub kehas amüloid. Selle eripära seisneb selles, et see häirib koeensüümide koostoimet ja veresoonte ümber moodustades pigistab neid, mis põhjustab elundi osa surma. Amüloidoosi võib piltlikult võrrelda tulekahjuga: siin-seal tekivad “tulipunktid”, mis hävitavad kõik, mis nende teel on, sulandudes järk-järgult üksteisega. Elund, milles amüloidvalk ladestub, on järk-järgult mõjutatud - kui protsessi ei peatata - selle struktuur asendatakse täielikult patoloogilise valguga.
Klassifikatsioon
Amüloidoosi ametlik klassifikatsioon on:
- Esmane süsteemne protsess, kui amüloid ladestub nii nahas kui ka siseorganites. See on tingitud asjaolust, et pärilikkuse teel (perekondlik amüloidoos) või juhuslikult ilmneb teatud geenide kombinatsioon, mis vastutab siseorganites või nahas modifitseeritud rakkude moodustumise eest, mis sünteesivad amüloidi prekursorvalku.
- Sekundaarne süsteemne amüloidoos. Patoloogilises protsessis osalevad nahk ja siseorganid. Sekundaarse amüloidoosi põhjused on haigused, mis "varustavad" keha pikka aega toksiinidega. Need on tuberkuloos, pidalitõbi, krooniline bronhiit, süüfilis, bronhektaasia, nefriit, reumatoidartriit, haavandiline koliit, pikaajaline kaaries, tonsilliit.
- Amüloidi lokaalset ladestumist nahas nimetatakse lihhenoidseks (samblikulaadseks) amüloidoosiks. Samuti on see jagatud 2 tüüpi. Esimene on esmane protsess, mis tekib teadmata põhjustel (idiopaatiline amüloidoos) või geenide muutumise tõttu. Teine tüüp on sekundaarne naha amüloidoos. See areneb erinevate (tavaliselt krooniliste) dermatoloogiliste haiguste taustal:, seborroilised tüükad, erinevat tüüpi, naha kasvajahaigused,.
Kõige sagedamini ladestub amüloid nahka esmase lihhenoidse protsessi käigus, millele järgneb esmane süsteemne amüloidoos. Kui amüloidi moodustumine toimub süsteemselt, krooniliste haiguste taustal, mõjutab nahk harva (süda ja neerud kannatavad tõenäolisemalt).
Sümptomid
Naha amüloidoosi erinevate vormide kliiniline pilt on mõnevõrra erinev.
Süsteemi esmane protsess
Nahk ei ole kohe mõjutatud. Esialgu on mõne siseorgani kahjustuse sümptomid. Tavaliselt kannatab kõigepealt süda; see väljendub südame rütmihäirete tekkes, valu selles. Amüloidi ladestumisega mao ja soolte seintesse areneb kõhukinnisus, iiveldus, mõnikord kuni oksendamiseni. Lihaste kahjustus väljendub nende valulikkuses ja kajastub liigutustes liigestes: nende amplituud väheneb.
Patsiendi nägu muutub kahvatuks, keele suurus suureneb mõnikord nii palju, et see ei pruugi suhu mahtuda. Siis on naha sümptomid: tihedad sõlmed, naastud või väikesed kasvajad; nende värvus on kahvatum kui ülejäänud nahk. Harva avaldub primaarne nahaamüloidoos villilise lööbega: siis paiknevad verise sisuga täidetud elemendid riietega pideva hõõrdumise kohtades.
Lööve on lokaalne, peamiselt looduslike nahavoltide kohtades: kaenlaalustes, kubemes ja reitel; võib tekkida silmade ümber ja isegi suhu. Üksteisega ühinedes moodustavad elemendid konarlikud alad, mille värvus on tumedam kui teistel aladel. Lööbe elemendid ei erine sügeluse ega valu poolest.

sekundaarse süsteemi protsess
Enne haiguse nahailminguid köhib inimene pikka aega (kui põhjuseks on tuberkuloos, krooniline bronhiit või bronhektaasia), külmub tugevamini, eriti nimmepiirkonnas (kui põhjuseks on neerukahjustus), luudes või liigestes. haiget teha. Selle üldise halva tervise taustal ilmnevad erinevad lööbe elemendid. Mõned neist on tihedad ja kettakujulised, tumeroosa värvusega. Teised on kollakad, on tihedad sõlmekesed. Teised aga sarnanevad naastudega, kuid ei kooru maha. Neid on võimatu mitte märgata: kolded sügelevad intensiivselt.
Lööbe elemendid paiknevad rinnal, kaelal, näol, suus, mis ei sulgu hästi, kuna keel muutub suureks ja paistes.

Sekundaarne naha amüloidoos
See areneb pikaajalise dermatoloogilise haiguse taustal (enamasti on see neurodermatiit või). Samal ajal muutuvad primaarsed elemendid, neisse tekib kare, hanenahalaadne lööve.
Kui Vidali samblik esineb naha sekundaarse amüloidoosiga, areneb haigus järgmiselt:
- Esialgu ilmneb naha muutumatul alal tugev sügelus. Tavaliselt esineb see liigeste voltides, kuklal, häbemel või tuharate vahel. Sügelemine suureneb õhtul ja öösel ning hommikul pole seda peaaegu tunda.
- Kahjustuse värvus muutub punasest pruuniks, ilmnevad erineva kujuga kõrguva lööbe elemendid. Kui tunnete seda kohta, tunnete end kuiva ja kõva nahana, väikestes "hanenahades".
- Lisaks muutub kahjustatud piirkond tihedamaks ja kuivaks. Selle värvus muutub roosaks-kohviseks; seda läbivad pikad erineva nurga all kulgevad vaod.
- Tumedate kõrgenenud sõlmede ilmumise ajaks võib kahjustatud piirkond olla peaaegu kadunud, jättes nahale tumedama (harva heledama) laigu.

Primaarne lihhenoidne amüloidoos
Sümptomid ilmnevad eelnevalt puhtal nahal. Need on sõlmed, laigud või naastud, millel on järgmised omadused:
- on koonilise või lame (sarnaselt tüükadele) kujuga;
- tihe tekstuur;
- lööbe mitu elementi, mis ei ühine üksteisega;
- pruun värv;
- lokaliseerimine: sääred, reied, mõnikord - nägu;
- lööve on sümmeetriline;
- kahjustatud piirkondades on tunda tugevat sügelust;
- lööbe elementide vahele võivad tekkida liiga valged depigmenteeritud nahapiirkonnad.

Diagnoosi püstitamine
Naha amüloidoosi diagnoosimine on üsna keeruline, kuna haigus sarnaneb paljude teiste dermatoloogiliste haigustega. Seda viib läbi dermatoloog. Ta saab diagnoosi panna ainult histoloogilise uuringu põhjal, võttes kahjustatud piirkonna biopsia.
Et teada saada, kas toimub süsteem või kohalik protsess, peate läbi viima mitmeid instrumentaalseid teste. Seega on vaja läbi viia ultraheliuuringud (ultraheli): süda, seedetrakt, põrn, neerud, lihased. Kui arst on ultraheliuuringu tulemuste põhjal mures mõne organi suuruse pärast, on selle kahjustuse selgitamiseks vaja läbi viia magnetresonantstomograafia. Seda, et tegemist oli siseorganisse ladestunud amüloidiga, saab teada alles pärast biopsiat.
Teraapia
Patoloogia ravi on eranditult konservatiivne ja väga pikk. Selleks kohaldatakse:
- lööbe elementide ravi glükokortikoididega salvidega: Prednisoloon, Cloveit, Cutiveit;
- rakendused dimeksiidiga, mis on lahjendatud veega 1:10, mõned arstid lisavad kolhitsiini;
- tugeva sügelusega võib lööbe elementidele rakendada Dikaini, Lidokaiini või mõnda muud anesteetikumi;
- laserteraapia;
- suukaudne tsüklofosfamiid, malaariavastased ravimid;
- vitamiinide B ja PP, A ja E võtmine;
- glükokortikoidide intradermaalne manustamine: "Prednisoloon", "Hüdrokortisoon";
- 5% unitiooli lahuse intramuskulaarsed süstid.
Prognoos
Patoloogiat saab täielikult ravida ainult lokaalse, lihhenoidse vormiga. Võimaliku retsidiivi jälgimiseks on vajalik pidev nahaarsti jälgimine. Süsteemsete vormide korral on võimalik ainult amüloidvalgu moodustumist peatada, kuid seda on võimatu eemaldada siseorganitest.
Ja sageli nimetatakse seda lihtsalt beeta-amüloidiks, ilma aminohappeahela pikkust täpsustamata. Alzheimeri tõbe põdeva patsiendi ajus võib see peptiid moodustada nn amüloidnaastud, mis koosnevad beetavoldi kujul kokkuvolditud peptiidi kuhjumist. Aβ42 peptiid võib moodustada ka oligomeere, mis käivitavad prioonmehhanismi kaudu amüloidnaastude ja tau moodustumise ahelreaktsiooni.
Struktuur
Organismis moodustuvad beeta-amüloidid beeta-amüloidi (inglise amyloid precursor protein, APP) prekursorist, mis on tundmatu funktsiooniga transmembraanne glükoproteiin, mille pikkus on 695–770 aminohappejääki. APP proteolüüs koos beeta-amüloidi vabanemisega viiakse läbi järjestikku beeta-sekretaasi ja gamma sekretaas. beeta-sekretaas β-saidi amüloidi prekursorvalku lõhustav ensüüm 1, BACE1) lõikab APP aminohappejääkide ahela plasmamembraani lähedal seestpoolt. Gammasekretaas lõikab APP ahelat transmembraanses piirkonnas murdumiskohas märkimisväärse varieeruvusega, mille tulemuseks on terve peptiidide perekond, mille ahela pikkus on 30 kuni 51 ühikut. Vabanenud peptiidid sisenevad vereplasmasse, tserebrospinaalvedelikku või muudesse interstitsiaalsetesse vedelikesse. Alzheimeri tõveta inimeste tserebrospinaalvedelikus on peamiste beeta-amüloidide suhe hinnanguliselt ligikaudu 50% Aβ40, 16% Aβ38 ja 10% Aβ42. Enamiku nende peptiidide funktsioonid on teadmata. Kõige paremini uuritud peptiid on Aβ42, mida peetakse üheks peamiseks patogeenseks teguriks Alzheimeri tõve tekkes. Selle aminohappejärjestus on järgmine:
Mõned endopeptidaasid lagundavad beeta-amüloide. Ajus on beeta-amüloidi tasakaalu säilitamisel kõige olulisem roll neprilüsiin- tsingist sõltuv metalloendopeptidaas, mis terves organismis hävitab beeta-amüloidide monomeere ja oligomeere, kompenseerides nende teket APP-st. Siiski ei suuda see amüloidnaastu hävitada.
Roll Alzheimeri tõve korral
Alzheimeri tõbi on üks levinumaid eakate neurodegeneratiivseid haigusi. Praegu puuduvad ravimid, mis võiksid haiguse arengut pidurdada, nii nagu puudub täielik arusaam haiguse põhjustest. Kõige tavalisema amüloidi hüpoteesi raames arvatakse, et Aβ42 peptiid mängib olulist rolli pöördumatute muutuste käivitamisel patsiendi ajus. See vorm on võimeline moodustama beeta-voldistruktuuris märkimisväärse hulga monopeptiidide oligomeere ja lahustumatuid akumulatsioone, mida nimetatakse amüloidnaastudeks. Amüloidi hüpoteesi esialgne versioon, mille 1990. aastate alguses pakkusid välja Hardy ja Higgins, eeldas, et amüloidnaastud põhjustavad patsiendi ajus patoloogilisi muutusi, mis väljenduvad neurofibrillaarsete puntrate tekkes, sünaptilise ülekande halvenemises, neuronite surmas ja sellest tulenevas. dementsus. Kaasaegsete kontseptsioonide kohaselt käivitab Aβ42 biokeemilisel ja rakutasandil keeruka protsesside kogumi, mis lõppkokkuvõttes viivad neurodegeneratiivsete muutusteni ajus.
2015. aastal leidsid Briti arstide uuringud, et beeta-amüloidiga on oht nakatuda iatrogeenselt, st meditsiiniliste protseduuride, näiteks operatsiooni või süstimise ajal. Lahkamisel leiti Creutzfeldt-Jakobi tõve tõttu surnud patsientide ajukoest beeta-amüloidnaastud. Mõnede nende patsientide vanus ja geneetiline profiil välistasid beeta-amüloidpatoloogiate spontaanse arengu, mistõttu teadlased nimetasid suure tõenäosusega amüloidhaiguse põhjuseks surnud inimeste hüpofüüsist pärineva kasvuhormooni süstimist. Neid süste tehti peamiselt laste kasvupeetuse korrigeerimiseks aastatel 1958–1985, kuni tuvastati prioonhaigustesse nakatumise oht.
2018. aastal avaldati uuringute tulemused, mis kinnitasid võimalust haigestuda Creutzfeldt-Jakobi tõvesse, kui hiirtele süstitakse beeta-amüloidiga “saastunud” inimese kasvuhormooni. Geneetiliselt muundatud hiirte katserühmas, mis sünteesis beeta-amüloidi inimvariandi eelkäijat, tekkisid ajustruktuuridesse naastud, samas kui kontrollrühmas seda ei täheldatud.
Kui riski haigestuda Alzheimeri tõve meditsiiniliste protseduuride kaudu peetakse oluliseks, toob see kaasa suuri ja potentsiaalselt äärmiselt kulukaid muudatusi meditsiiniinstrumentide saastest puhastamise eeskirjades. Beeta-amüloidid kipuvad "kleepuma" metallinstrumentide külge ja nende usaldusväärne desinfitseerimine prioonidest nõuab palju rangemaid tingimusi kui bakterite ja viiruste puhul.
Loomkatsete kohaselt võib beetaamüloid toimida ajus viirusevastase ja antibakteriaalse kaitsemehhanismina. Kui hiired on nakatunud herpesviirusega, hakkavad närvirakud aktiivselt tootma beeta-amüloide, mis seovad viirust, mis põhjustab amüloidnaastude teket, kuid takistab entsefaliidi teket.
Roll une- ja mäluhäiretes
Lahustuva beeta-amüloidi tase tõuseb organismis ärkveloleku ajal ja väheneb une ajal. Hiirte uuringutes on leitud, et unepuudus kiirendab beeta-amüloidi akumuleerumist hiirtel, kes on mutantsed beeta-amüloidi prekursori (APP) geeni suhtes, ja beeta-amüloidi akumuleerumine sellistel hiirtel häirib und. Une-ärkveloleku rütmi häirimine vanusega, mis põhjustab beeta-amüloidi kontsentratsiooni tõusu, on korrelatsioonis unekvaliteedi halvenemisega ning võib olla üks mehhanisme, mis mõjutab mäluhäireid vananemise ja Alzheimeri tõve korral.
Ravimid
Aβ42 taseme vähendamiseks otsitakse ravimeid, mis takistavad selle teket ajus või eemaldavad kudedest juba tekkinud naastud. Need uuringud viiakse läbi kolmes põhivaldkonnas: kuidas vältida Aβ42 moodustumist, kuidas puhastada juba kogunenud Aβ42 naastud ja kuidas vältida Aβ42 oligomeriseerumist. 1995. aastal suutsid teadlased aretada transgeenseid hiiri mutantse inimese APP geeniga, mis kogus nende ajju amüloidnaastud. Need hiired said teabe meeldejätmist nõudvate ülesannetega halvemini hakkama ja neist sai eeskujuks paljutõotavate amüloidivastaste ravimite toime uurimisel. Siiani ei ole aga hiirtel testitud ravimeid inimestel tõestatud. Üks võimalik põhjus, miks hiirte uuringute tulemusi inimestele ei edastata, võib olla erinevus hiire ja inimese neuronite vahel neurokeemias ja patofüsioloogias. 2014. aastal õnnestus Rudolf Tanzi ja Kim Doo-yongi juhitud teadlaste rühmal luua kolmemõõtmeline inimrakkude kultuur. in vitro, kus beeta-amüloididega seotud neurodegeneratiivsed muutused, aga ka taupaatiad, taastoodetakse kiirendatud tempos. Seda saavutust peetakse Alzheimeri tõve väljakujunemist inimestel ennetada suutvate ravimite kiire arendamise ja testimise osas üheks lootustandvamaks ning selle autor pääses 2015. aastal Time 100 100 mõjukaima inimese nimekirja.
Märkmed
- Gerald Karp. Raku- ja molekulaarbioloogia: kontseptsioonid ja katsed. - 7. väljaanne - John Wiley & Sons, Inc., 2013. - Lk 67. - 864 lk. - ISBN 978-1118-30179-1.
- Nussbaum Justin M., Seward Matthew E., Bloom George S. Alzheimeri tõbi: lugu kahest prioonist // Prioon. - 2013. - Vol. 7. - Lk 14-19. - ISSN 1933-6896. - DOI: 10.4161/pri.22118.
- Wilquet Valérie, Strooper Bart De. Amüloid-beeta prekursorvalgu töötlemine neurodegeneratsioonis // Praegune arvamus neurobioloogias. - 2004. - Vol. 14. - Lk 582-588. - ISSN. - DOI:10.1016/j.conb.2004.08.001.
- Olsson F., Schmidt S., Althoff V., Munter L. M., Jin S., Rosqvist S., Lendahl U., Multhaup G., Lundkvist J. Amüloid-beeta (Aβ) tootmise vahepealsete etappide iseloomustus peaaegu looduslikes tingimustes // Journal of Biological Chemistry. - 2013. - Vol. 289. - Lk 1540-1550. - ISSN 0021-9258. - DOI:10.1074/jbc.M113.498246 .
- Bibl Mirko, Gallus Marion, Welge Volker, Lehmann Sabine, Sparbier Katrin, Esselmann Hermann, Wiltfang Jens. Tserebrospinaalvedeliku aminoterminaalselt kärbitud ja oksüdeeritud amüloid-β peptiidide iseloomustus // PROTEOMIKA – kliinilised rakendused. - 2012. - Vol. 6. - Lk 163-169. - ISSN. - DOI:10.1002/prca.201100082 .
- Kummer Markus P, Heneka Michael T. Kärbitud ja modifitseeritud amüloid-beeta liigid // Alzheimer's Research & Therapy. - 2014. - Vol. 6. - Lk 28. - ISSN 1758-9193. - DOI: 10.1186/alzrt258.
- Huang S.-M., Mouri A., Kokubo H., Nakajima R., Suemoto T., Higuchi M., Staufenbiel M., Noda Y., Yamaguchi H., Nabeshima T., Saido T. C., Iwata N. Neprilüsiini suhtes tundlikud sünapsiga seotud amüloid-beeta peptiidi oligomeerid kahjustavad neuronaalset plastilisust ja kognitiivset funktsiooni // Bioloogilise keemia ajakiri. - 2006. - Vol. 281. - Lk 17941-17951. - ISSN 0021-9258. - DOI:10.1074/jbc.M601372200 .
- Hardy J., Higgins G. Alzheimeri tõbi: amüloidkaskaadi hüpotees // Science. - 1992. - Vol. 256. - Lk 184-185. - ISSN 0036-8075. - DOI: 10.1126/teadus.1566067.
- Muusik Erik S, Holtzman David M. Amüloidi hüpoteesi kolm mõõdet: aeg, ruum ja "tiivamehed" // Nature Neuroscience. - 2015. - Vol. 18. - Lk 800-806. - ISSN 1097-6256. - DOI:10.1038/nn.4018 . - PMID 26007213 .
- John Collinge, Dominic M. Walsh, Sebastian Brandner, Peter Rudge, Takaomi Saido. Amüloid-β valgu patoloogia ülekandumine surnukeha hüpofüüsi kasvuhormoonist // Loodus. - 2018-12-13. - Lk 1 . -
 Amüloidoos (amüloidi degeneratsioon, ladina amüloidoos, kreeka amüloontärklis + eidosi liigid + ōsis) on rühm haigusi, mida iseloomustavad väga erinevad kliinilised ilmingud ja mida iseloomustab rakuväline (rakuvälises maatriksis) ladestumine (süsteemne või lokaalne) lahustumatud patoloogilised fibrillaarsed valgud (valgu-polüsahhariidi kompleks - amüloid) elundites ja kudedes, mis tekivad keeruliste metaboolsete muutuste (valgudüstroofiate) tulemusena. Peamised sihtorganid on süda, neerud, närvisüsteem [kesk- ja perifeerne], maks, kuid süsteemsete vormide korral võivad peaaegu kõik koed olla kahjustatud (neerupealiste amüloidoos on haruldane lokalisatsioon). Neid nimetati amüloidideks, kuna joodiga reageerides meenutasid nad tärklist. Amüloid püsib kehas pikka aega ja isegi pärast surma ei lagune pikka aega (IV Davydovsky, 1967). Amüloidoos võib tekkida iseseisvalt või "sekundaarselt" mõne muu haiguse tagajärjel.
Amüloidoos (amüloidi degeneratsioon, ladina amüloidoos, kreeka amüloontärklis + eidosi liigid + ōsis) on rühm haigusi, mida iseloomustavad väga erinevad kliinilised ilmingud ja mida iseloomustab rakuväline (rakuvälises maatriksis) ladestumine (süsteemne või lokaalne) lahustumatud patoloogilised fibrillaarsed valgud (valgu-polüsahhariidi kompleks - amüloid) elundites ja kudedes, mis tekivad keeruliste metaboolsete muutuste (valgudüstroofiate) tulemusena. Peamised sihtorganid on süda, neerud, närvisüsteem [kesk- ja perifeerne], maks, kuid süsteemsete vormide korral võivad peaaegu kõik koed olla kahjustatud (neerupealiste amüloidoos on haruldane lokalisatsioon). Neid nimetati amüloidideks, kuna joodiga reageerides meenutasid nad tärklist. Amüloid püsib kehas pikka aega ja isegi pärast surma ei lagune pikka aega (IV Davydovsky, 1967). Amüloidoos võib tekkida iseseisvalt või "sekundaarselt" mõne muu haiguse tagajärjel.
Praegu peetakse amüloidoosi haiguste rühmaks, mida iseloomustab fibrillaarse amüloidvalgu (FBA) ladestumine kudedesse ja elunditesse - spetsiaalne valgu struktuur läbimõõduga 5–10 nm ja pikkusega kuni 800 nm. koosneb kahest või enamast paralleelsest mitmesuunalisest (antiparalleelsest) filamendist, moodustades rist-β-volditud konformatsioon(vt joonist vasakul). Just tema määrab amüloidi spetsiifilise optilise omaduse – kaksikmurdevõime (tuvastatakse Kongo punasega värvimise teel [= meetod amüloidi määramiseks kudedes]). Kaasaegsete andmete kohaselt on amüloidoosi levimus elanikkonnas vahemikus 0,1–6,6%.

Valgu nimetuse "amüloid" pakkus välja Rudolf Virchow, kes laenas selle botaanikast, kus see sõna tähendas tselluloosi või tärklist. Oma struktuurilt on amüloid kompleksne glükoproteiin, milles fibrillaarsed ja globulaarsed valgud paiknevad struktuuris koos polüsahhariididega (galaktoos, glükoos, glükoosamiin, galaktoosamiinid, mannoos ja fruktoos). Amüloid sisaldab oma omadustelt α1-, β- ja γ-globuliinidele sarnaseid valke, albumiini, fibrinogeeni, sisaldab neuramiinhapet. Sidemed valkude ja polüsahhariidide vahel on väga tugevad, mis hoiab selle stabiilsena. Amüloidstruktuur sisaldab ka P-komponenti, mis moodustab kuni 15% kogu amüloidist ja on identne seerumi valguga SAP (serum amyloid P). SAP on ägeda faasi valk, mida toodavad maksarakud (SAP on amüloidiladestuste pidev komponent kõigi amüloidoosi vormide korral).
Amüloidoos on polüetioloogiline. Peamine tähtsus omistatakse peamise amüloidi prekursorvalgu (BPA) amüloidogeensusele, mis on spetsiifiline iga amüloidoosi vormi jaoks. Amüloidogeensuse määravad muutused BPA primaarses struktuuris, mis on fikseeritud geneetilises koodis või omandatud elu jooksul mutatsioonide tõttu. BPA amüloidogeense potentsiaali realiseerimiseks on vaja mõjutada mitmeid tegureid, nagu põletik, vanus ja in situ füüsikalis-keemilised tingimused.
TABEL: amüloidoosi klassifikatsioon (kõigi amüloidoositüüpide nimetustes on esimene täht suurtäht "A", mis tähendab sõna "amüloid", millele järgneb spetsiifilise BPA nimetus - A [amüloid A valk; moodustub seerumist prekursorvalk SAA – ägeda faasi valk, väikestes kogustes sünteesitud hepatotsüütide, neutrofiilide ja fibroblastide poolt], L [immunoglobuliini kerged ahelad], TTR [transtüretiin], 2M [β2-mikroglobuliin], B [B-valk], IAPP [saar amüloidpolüpeptiid] jne).

Märge! Amüloidi struktuursed ja keemilis-füüsikalised omadused määratakse peamise BPA-ga, mille sisaldus fibrillides ulatub 80% -ni ja on iga amüloidoosi tüübi eripära. Igal valgul (BPA) on oluliselt erinevad sünteesimehhanismid, kasutus, bioloogilised funktsioonid, mis määrab amüloidoosi kliiniliste ilmingute ja lähenemisviiside erinevused. Sel põhjusel peetakse amüloidoosi erinevaid vorme erinevateks haigusteks (vt tabelit).
Vaatamata edusammudele erinevate amüloiditüüpide uurimisel, jääb amüloidogeneesi viimane etapp – amüloidfibrillide moodustumine rakuvälises maatriksis BPA-st – suures osas seletamatuks. Ilmselt on tegemist multifaktoriaalse protsessiga, millel on amüloidoosi erinevate vormide puhul oma eripärad. Mõelge amüloidogeneesi protsessile AA amüloidoosi näitel. Arvatakse, et AA moodustumisel SAA-st toimub SAA mittetäielik lõhustamine monotsüütide-makrofaagide pinnamembraaniga seotud proteaaside poolt ja lahustuva AA valgu polümerisatsioon fibrilliks, mis, nagu eeldatakse, toimub ka membraaniensüümide osalemine, on olulised. AA-amüloidi moodustumise intensiivsus kudedes sõltub SAA kontsentratsioonist veres. Erinevat tüüpi rakkude (hepatotsüüdid, neutrofiilid, fibroblastid) sünteesitud SAA kogus suureneb mitu korda põletikuliste protsesside, kasvajate korral (AA amüloidoosi patogeneesis mängib suurt rolli SAA sisalduse suurenemine veres). Amüloidoosi tekkeks ei piisa aga ainult kõrgest SAA kontsentratsioonist, vajalik on ka amüloidogeensuse olemasolu BPA-s (st SAA-s). Amüloidoosi teke inimestel on seotud SAA1 ladestumisega. Praegu on teada 5 SAA1 isotüüpi, millest suurim amüloidogeensus on omistatud isotüüpidele 1.1 ja 1.5. Amüloidogeneesi viimane etapp - amüloidfibrillide moodustumine BPA-st - viiakse läbi makrofaagide monotsüütide mittetäieliku lõhustamisega proteaaside poolt. Amüloidfibrillide stabiliseerumine ja selle makromolekulaarse kompleksi lahustuvuse järsk vähenemine on suuresti tingitud interstitiumi polüsahhariididega interaktsioonist.
Hoolimata amüloidvalgu tüüpide erinevusest, on amüloidoosi erinevate kliiniliste vormide patogeneesis ühtne. Haiguse arengu peamiseks põhjuseks on teatud, sageli suurenenud amüloidogeense BPA kogus. Amüloidogeensuse ilmnemine või tugevnemine võib olla tingitud valguvariantide ringlusest, mille molekuli üldine hüdrofoobsus on suurenenud, pinna molekulaarlaengute suhe on häiritud, mis põhjustab valgu molekuli ebastabiilsust ja soodustab selle agregatsiooni amüloidfibrilliks. Amüloidogeneesi viimases etapis interakteerub amüloidvalk vereplasma valkude ja kudede glükoosaminoglükaanidega. Lisaks struktuursetele iseärasustele on olulised ka rakuvälise maatriksi füüsikalis-keemilised omadused, kus amüloidfibrill on kokku pandud. Paljusid amüloidoosi vorme saab rühmitada ka eakatel ja seniilsetel inimestel esinemise alusel (AL, ATTR, AIAPP, AApoA1, AFib, ALys, AANF, A-beeta), mis näitab vanusega seotud evolutsiooni mehhanismide olemasolu. teatud valkude struktuuri amüloidogeensuse suurendamise suunas ja võimaldab pidada amüloidoosi üheks keha vananemise mudeliks.
Amüloidoosi neuroloogilised aspektid :
ATTR amüloidoos. ATTR-amüloidoos hõlmab perekondlikku amüloidset polüneuropaatiat, mis on päritud autosomaalselt domineerival viisil, ja süsteemset seniilset amüloidoosi. Selle amüloidoosi vormi prekursorvalguks on transtüretiin, prealbumiini molekuli komponent, mida sünteesitakse maksas ja mis toimib türoksiini transportvalguna. On kindlaks tehtud, et pärilik ATTR-amüloidoos on transtüretiini kodeeriva geeni mutatsiooni tagajärg, mis viib aminohapete asendamiseni TTR-molekulis. Pärilikku amüloidneuropaatiat on mitut tüüpi: portugali, rootsi, jaapani ja mitmed teised. Kõige tavalisemas perekonnavariandis (portugali keeles) on transtüretiini molekuli N-otsast 30. positsioonil metioniin asendatud valiiniga, mis suurendab prekursorvalgu amüloidogeensust ja hõlbustab selle polümerisatsiooni amüloidfibrillideks. On teada mitmeid transtüretiini variante, mis on päriliku neuropaatia kliiniliste vormide mitmekesisuse põhjuseks. Kliiniliselt iseloomustab seda haigust progresseeruv perifeerne ja autonoomne neuropaatia, mis on kombineeritud erineva raskusastmega südame, neerude ja teiste organite kahjustustega. Süsteemne seniilne amüloidoos areneb pärast 70. eluaastat normaalse transtüretiini vanusega seotud konformatsioonimuutuste tulemusena, mis ilmselt suurendab selle amüloidogeensust. Seniilse amüloidoosi sihtorganid on süda, ajuveresooned ja aort.
loe ka postitust: Transtüretiini amüloidne polüneuropaatia(veebisaidile)
lugege ka artiklit "Perifeerse närvisüsteemi lüüasaamine süsteemse amüloidoosi korral" Safiulina E.I., Zinoviev O.E., Rameev V.V., Kozlovskaya-Lysenko L.V.; Föderaalne Riiklik Autonoomne Kõrgharidusasutus “Esimene Moskva Riiklik Meditsiiniülikool, mis sai nime I.I. NEED. Sechenov" Vene Föderatsiooni tervishoiuministeerium, Moskva (ajakiri "Neuroloogia, neuropsühhiaatria, psühhosomaatika" nr 3, 2018) [loe]
Alzheimeri tõbi(BA) on geneetiliselt määratud progresseeruv neurodegeneratiivne haigus, mis põhineb ajupoolkerade neuronite surmal; haiguse kliinilisteks ilminguteks on mälu ja teiste kognitiivsete funktsioonide (intelligentsus, praktika, gnoos, kõne) vähenemine. Hetkel on tuvastatud 4 peamist selle haiguse tekke eest vastutavat geeni: amüloidi prekursorvalku kodeeriv geen (APP, kromosoom 21), ensüüme kodeerivad geenid [alfa-, beeta-, gamma-sekretaase], metaboliseeriv APP: preseniliin-1 (kromosoom 14), preseniliin-2 (kromosoom 1). Eriline roll on apolipoproteiini E neljanda isovormi (APOE 4) hetero- või homosügootsel kandmisel.
Tavaliselt lõhustatakse amüloidi prekursorvalk (APP) alfa-sekretaasi toimel lahustuvateks (võrdse suurusega) polüpeptiidideks, mis ei ole patogeensed, ja (APP) eritub organismist; APP metabolismi eest vastutavate geenide patoloogias lõhustatakse viimane beeta- ja gamma-sekretaaside toimel erineva pikkusega fragmentideks. Sel juhul moodustuvad amüloidvalgu (alfa-beeta-42) lahustumatud pikad fragmendid, mis ladestuvad seejärel aju ainesse (parenhüümi) ja ajuveresoonte seintesse (difuusse aju amüloidoosi staadium), mis viib närvirakkude surmani. Lisaks toimub aju parenhüümis lahustumatute fragmentide agregatsioon patoloogiliseks valguks beeta-amüloidiks (selle valgu "pesastatud" ladestusi aju parenhüümis nimetatakse seniilseteks naastudeks). Amüloidvalgu ladestumine ajuveresoontesse viib aju amüloidangiopaatia tekkeni, mis on kroonilise ajuisheemia üheks põhjuseks.

loe artiklit: Tserebraalne amüloidne angiopaatia(veebisaidile)
Beeta-amüloidil ja difuusse amüloidvalgu lahustumatutel fraktsioonidel on neurotoksilised omadused. Katse näitas, et aju amüloidoosi taustal aktiveeruvad kudede põletikumediaatorid, suureneb ergastavate mediaatorite (glutamaat, aspartaat jne) vabanemine, suureneb vabade radikaalide teke. Selle keeruka sündmustekaskaadi tulemuseks on neuronaalsete membraanide kahjustus, mille indikaatoriks on rakkude sees neurofibrillaarsete puntrade (NFS) moodustumine. NPS on neuroni biokeemiliselt muudetud sisemembraani fragmendid ja sisaldavad hüperfosforüülitud tau valku. Tavaliselt on tau-valk neuronite sisemembraani üks peamisi valke. Intratsellulaarse NPS olemasolu viitab raku pöördumatule kahjustusele ja selle peatsele surmale, mille järel NPS siseneb rakkudevahelisse ruumi ("NPS-i kummitused"). Esiteks ja kõige suuremal määral kannatavad seniilseid naastud ümbritsevad neuronid.

Amüloidvalgu ladestumise algusest ajus kuni haiguse esimeste sümptomite tekkeni - kerge unustamine - möödub 10-15 aastat. BA progresseerumise kiiruse määravad suurel määral kaasuva somaatilise patoloogia raskusaste, vaskulaarsed riskifaktorid, aga ka patsiendi intellektuaalne areng. Kõrge haridustaseme ja piisava intellektuaalse koormusega patsientidel kulgeb haigus aeglasemalt kui kesk- või alghariduse ning ebapiisava intellektuaalse aktiivsusega patsientidel. Sellega seoses töötati välja kognitiivse reservi teooria, mille kohaselt moodustab inimese aju intellektuaalse tegevuse käigus uusi interneuronaalseid sünapse ja kognitiivsesse protsessi on kaasatud järjest suuremad neuronite populatsioonid. See muudab kognitiivse defekti kompenseerimise lihtsamaks isegi progresseeruva neurodegeneratsiooni korral.
Amüloidoosi diagnoosimine. Kliiniliste ja laboratoorsete andmete põhjal oletatud amüloidoosi tuleb morfoloogiliselt kinnitada amüloidi tuvastamisega koebiopsiates. AL-tüüpi amüloidoosi kahtluse korral on soovitatav teha luuüdi punktsioon. Kõige sagedamini tehakse erinevat tüüpi amüloidoosi diagnoosimiseks pärasoole, neeru ja maksa limaskesta biopsia. Pärasoole limaskestade ja submukoossete kihtide biopsia näitab amüloidi 70% patsientidest ja neeru biopsia - peaaegu 100% juhtudest. Karpaalkanali sündroomiga patsientidel tuleb karpaalkanali dekompressioonioperatsiooni käigus eemaldatud kude amüloidi suhtes kontrollida. Amüloidi tuvastamiseks kasutatav biopsiamaterjal tuleb värvida Kongo punasega, millele järgneb kaksikmurde tuvastamiseks mikroskoopia polariseeritud valguses.
Amüloidoosi kaasaegne morfoloogiline diagnostika hõlmab mitte ainult amüloidi tuvastamist, vaid ka tüpiseerimist, kuna amüloidi tüüp määrab ravitaktika. Tippimiseks kasutatakse sageli kaaliumpermanganaadi proovi. Kongo punasega värvimisel preparaate töödeldakse 5% kaaliumpermanganaadi lahusega, kaotab AA-tüüpi amüloid oma värvi ja kahekordse murdumisomaduse, samas kui AL-tüüpi amüloid säilitab need. Aluselise guanidiini kasutamine võimaldab täpsemalt eristada AA ja AL amüloidoosi. Kõige tõhusam meetod amüloidi tüpiseerimiseks on immunohistokeemiline uuring, milles kasutatakse peamiste amüloidvalgu tüüpide (spetsiifilised antikehad AA valgu, immunoglobuliini kergete ahelate, transtüretiini ja beeta-2-mikroglobuliini vastu) vastaseid antiseerumeid.
Märge! Amüloidoos on multisüsteemne haigus, mis mõjutab harva ainult ühte organit. Kui anamneesis on mainitud sümptomite kombinatsiooni, nagu üldine nõrkus, kõhnumine, kerge verevalumid, varajane õhupuudus, perifeerne turse, sensoorsed muutused (randmekanali sündroom) või ortostaatiline hüpotensioon, tuleb kahtlustada amüloidoosi. Pärilikku amüloidoosi iseloomustab koormatud perekonna anamneesis teadmata etioloogiaga "neuromuskulaarsed" kahjustused või dementsus, Aβ2M amüloidoosi puhul - hemodialüüsi kasutamine, AA amüloidoosi korral - kroonilise põletikulise protsessi olemasolu. Samuti tuleb välistada amüloidoos teadmata päritoluga neeruhaigustega, eriti nefrootilise sündroomiga, sh. piirava kardiomüopaatiaga patsientidel. Amüloidoos on tõenäolisem mõlema sündroomi juuresolekul. AA amüloidoosi korral on lisaks neerudele domineerivaks sihtorganiks maks, seetõttu tuleks raske hepatomegaalia koos neerukahjustusega põhjuste diferentsiaaldiagnostikas amüloidoos välistada.
lisakirjandust:
artikkel "AL-amüloidoosi diagnoosimise ja ravi raskused: kirjanduse ülevaade ja enda tähelepanekud" V.V. Ryzhko, A.A. Klodzinsky, E. Yu. Varlamova, O.M. Sorkina, M.S. Sataeva, I.I. Kalinina, M.Zh. Aleksanjan; Venemaa Meditsiiniteaduste Akadeemia hematoloogiliste uuringute keskus, Moskva (ajakiri "Kliiniline onkohematoloogia" nr 1, 2009) [
Pärast 65. eluaastat kahekordistub risk haigestuda Alzheimeri tõve iga 5 aasta järel. Nüüd on uus uuring leidnud, et vanematel täiskasvanutel on aju võime puhastada haigusega seotud toksilisi valgufragmente märkimisväärselt.
Pärast 65. eluaastat kahekordistub risk haigestuda Alzheimeri tõve iga 5 aasta järel.
Ajakirjas Annals of Neurology kirjeldasid Missouri osariigis St. Louisis asuva Washingtoni ülikooli teadlased, kuidas nad avastasid, et vanemate inimeste ajul kulub palju kauem aega, et puhastada beeta-amüloid 42, mis on Alzheimeri tõve korral ajju kogunevate valgunaastude peamine koostisosa. haigus.
Vanemautor ja neuroteaduste professor Randall J. Bateman ütles: "Leidsime, et tavaliselt kulub 30ndates eluaastates inimestel umbes 4 tundi, et puhastada pool amüloid-beeta-42 ajust. Selles uues uuringus oleme näidanud, et 80-aastaselt võtab see protsess rohkem kui 10 tundi.
Kui seda ei ravita, on suurem tõenäosus, et beeta-amüloid 42, valgufragment, mis on ajutegevuse loomulik kaasprodukt, hüübib naastudeks, mis häirivad aju funktsioone, näiteks rakkudevahelist suhtlust.
Teadlased on pikka aega kahtlustanud, et need naastud on Alzheimeri tõve, dementsuse (dementsuse) vormi üks peamisi soodustajaid.
Dementsus on progresseeruv haigus, mille puhul mälu, mõtlemine ja käitumine halvenevad seni, kuni patsient ei suuda enam rääkida ega enda eest hoolitseda. Kuigi see haigus mõjutab peamiselt eakaid inimesi, ei ole see vananemise normaalne osa.
Maailma Terviseorganisatsiooni andmetel kannatab maailmas dementsuse all ligikaudu 48 miljonit inimest ja see arv kasvab igal aastal peaaegu 8 miljoni võrra. Alzheimeri tõbi moodustab ligikaudu kaks kolmandikku nendest juhtudest.
Amüloid beeta 42 madalamad kliirensi väärtused Alzheimeri tõve sümptomitega inimestel
Professor Bateman ja tema kolleegid testisid oma uuringus 100 vabatahtlikku vanuses 60–87 aastat. Pooltel neist osalejatest olid Alzheimeri tõve kliinilised tunnused, nagu mäluhäired, ja 62 osalejal oli ajus naastud.
Uurijad tuvastasid nende märkide ja sümptomite olemasolu üksikasjaliku vaimse ja füüsilise läbivaatuse käigus, mille osalejad läbisid. Lisaks aju skaneerimisele naastude kontrollimiseks testisid teadlased osalejate tserebrospinaalvedelikku, kasutades tehnoloogiat, mille nad olid ise välja töötanud.
Selle tehnoloogiaga, mida nimetatakse SILK-ks (stabiilne isotoopidega seotud kineetika - stabiilne isotoopidega seotud kineetika) - said teadlased jälgida, mis juhtub beeta-amüloid 42 ja teiste valkudega.
Uurijad leidsid, et beeta-amüloid 42 lahkus suurema tõenäosusega aju ümbritsevast vedelikust ja kogunes naastule.
Lisaks on beeta-amüloidi 42 kliirensi madalamat määra – nagu need, mida teadlased nägid vanematel osalejatel – seostatud Alzheimeri tõve sümptomitega, sealhulgas mäluhäirete, isiksusemuutuste ja dementsusega.
Professor Bateman ütleb, et teadlased usuvad, et ajul on neli võimalust beeta-amüloidi kasutamiseks: viia see seljaajusse, viia see läbi hematoentsefaalbarjääri, lahustada või võtta koos teiste valkudega ja ladestuda naastuna. Ta järeldab:
"Selliste lisauuringutega loodame kindlaks teha, milline kolmest esimesest viisist amüloid-beeta kasutamine aju vananemisega aeglustub. See võib meid aidata uute raviviiside väljatöötamisel.
22. juulil 2016Läbipaistev aju ja amüloidnaastude 3D atlas
Rockefelleri ülikooli (USA) teadlased kasutasid äsja väljatöötatud pilditehnikat, mis muudab ajukoe läbipaistvaks. See võimaldas neil näha kolmemõõtmelist pilti patoloogilise valgu, beeta-amüloidnaastude, kuhjumise asukohast Alzheimeri tõbe põdevate surnud inimeste ajus.
Patoloogilise valgu beeta-amüloidi kogunemise olemasolu ja jaotus ajus, mida peetakse neuronite surmani viivate sündmuste ahela "päästikuks", on kuni viimase ajani kindlaks tehtud ajulõikude analüüsimise teel. Viilutamine on aeganõudev, järgnev 3D rekonstrueerimine on töömahukas ja ei pruugi olla täpne. Igal juhul on tekkiv esitus piiratud, sest aju on keeruline kolmemõõtmeline struktuur, millel on palju omavahel seotud komponente, mida on keeruline viiluandmete põhjal täielikult rekonstrueerida. Meil oli vaja võimalust näha suurt pilti.
Sellised aju ruumilise pildistamise meetodid nagu positronemissioon ja funktsionaalne magnetresonantstomograafia näitavad aju erinevate piirkondade aktiivsust, kuid ei sobi beeta-amüloidi jaotuse uurimiseks. Kuid just õige tuli hiljuti välja töötatud meetod nimega iDISCO (immunomärgistusega võimaldatud lahustiga puhastatud elundite 3D-kuvamine).
Ajukoes on umbes 60% rasva. Kui need eemaldada, muutub aju teadlaste sõnul kõvaks ja läbipaistvaks, peaaegu "nagu klaasiks". iDISCO-s leotatakse aju ühendis, mis annab rasvale elektrilaengu, ja seejärel eksponeeritakse vastupidise laenguga elektrivälja. Selgub "magnet", mis "tõmbab" ajust rasva.
Naastud ise värviti immunoloogiliste meetoditega, misjärel muutusid need mahult nähtavaks - kogu hiire ajupoolkeral ja inimese aju väikestes fragmentides. Selgus, et Alzheimeri tõve hiiremudelites on naastud üsna väikesed, ühtlase suuruse ja kujuga ning mitte rühmitatud, erinevalt haige inimese ajust, kus on näha heterogeensust, naastud on suuremad ja keerukad kolmemõõtmelised. täheldatakse amüloidstruktuure.
Beeta-amüloidi klastrid on lillad.
Teadlased loodavad, et kui võrrelda patsiendi sümptomeid ja surmajärgset beeta-amüloidi jaotumist tema ajus, on võimalik õppida eristama Alzheimeri tõve tüüpe, mis võivad osutuda mitte üheks, vaid mitmeks haigusseisundiks. , sest amüloidnaastude arv ei vasta alati haiguse tõsidusele. Mõnikord on naastud palju, kuid dementsust ei esine ja mõnikord tundub, et naastud pole, kuid haiguse sümptomid on olemas. Võib-olla sel põhjusel ebaõnnestuvad väljatöötatud ravimite kliinilised uuringud: kuna neil on erinevat tüüpi haiguste korral erinev efektiivsus. Seni pole võimalik neid variante eristada ning selle õppimisele aitab kaasa naastude 3D-visualiseerimine, nende asukoht, nendest moodustuvate struktuuride analüüs.
16. september 2014Aju suudab kompenseerida amüloidnaastude kahjulikku mõju
Alzheimeri tõve varases staadiumis võib inimese aju erilisel viisil ümber korraldada, mis lükkab edasi haiguse sümptomite ilmnemist.
loetud 22. august 2014Alzheimeri tõbi: kui lähedal oleme probleemi lahendamisele?
On väga vähe päevi, mil meditsiiniuudiste voogudes pole Alzheimeri uuringu kohta ühtegi aruannet. Millises arengujärgus see uurimissuund siiski on?
loetud 25. märts 2014Veel üks diabeedivastane ravim aitab Alzheimeri tõve vastu?
Diabeedivastane ravim pramlintiid vähendab beeta-amüloidnaastud ajukoes ning parandab õppimist ja mälu kahes Alzheimeri tõve eksperimentaalses mudelis.
loetud 26. detsember 2012Kas immuunvastuse allasurumine aitab Alzheimeri tõbe?
Ajukoes põletikulisi reaktsioone vallanduva immuunkompleksi inaktiveerimine pärsib Alzheimeri tõve kulgu.