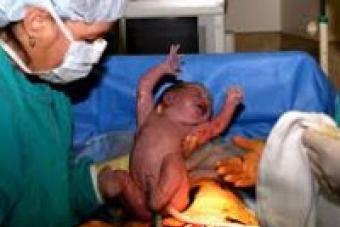
Сегодня гинекологи советуют всем женщинам планировать свою беременность. Ведь таким образом можно избежать многих наследственных заболеваний. Это возможно при тщательном медицинском обследовании обоих супругов. В вопросе наследственных болезней есть два момента. Первый - это генетическая предрасположенность к определенным заболеваниям, что проявляется уже с взрослением ребенка. Так, например, сахарный диабет , которым болеет один из родителей, может проявиться у детей в подростковом возрасте, а гипертония - уже после 30 лет. Второй момент - это непосредственно генетические болезни, с которыми дитя рождается. О них и пойдет речь сегодня.
Наиболее часто встречающиеся генетические заболевания у детей: описание
Самой частой наследственной болезнью малыша является синдром Дауна . О н встречается в 1 случае из 700. Диагноз у ребенка ставит врач-неонатолог еще во время пребывания новорожденного в роддоме. При болезни Дауна детский кариотип содержит 47 хромосом, то есть лишняя хромосома и является причиной недуга. Следует знать, что этой хромосомной патологии одинаково подвержены и девочки, и мальчики. Визуально это дети со специфическим выражением лица, отстающие в умственном развитии.
Болезни Шерешевского-Тернера чаще подвергаются девочки. И проявляются симптомы недуга в 10-12-летнем возрасте: больные отличаются невысоким ростом, волосы на затылке низко посажены, а в 13-14 лет у них не наступает половое созревание и отсутствуют месячные. У таких детей наблюдается небольшое отставание умственного развития. Ведущим признаком этого наследственного заболевания у взрослой женщины является бесплодие. Кариотип при этой болезни составляет 45 хромосом, то есть отсутствует одна хромосома. Частота распространенности заболевания Шерешевского-Тернера - это 1 случай на 3000. А среди девушек ростом до 145 сантиметров - это 73 случая на 1000.
Только мужскому полу присуща болезнь Клейнфелтера. Этот диагноз устанавливается в возрасте 16-18 лет. Признаки болезни - высокий рост (190 сантиметров и даже выше), легкое умственное отставание, непропорционально длинные руки. Кариотип в этом случае - 47 хромосом. Характерный признак для взрослого мужчины - бесплодие. Болезнь Клейнфелтера встречается в 1 случае из 18000.
Проявления достаточно известного заболевания - гемофилии - наблюдаются обычно у мальчиков после одного года жизни. Страдают патологией в основном представители сильной половины человечества. Их мамы являются лишь переносчиками мутации. Нарушение свертываемости крови - основной признак гемофилии. Часто это приводит к развитию тяжелых поражений суставов, например, к геморрагическим артритам. При гемофилии вследствие любой травмы с рассечением кожи начинается кровотечение, которое для мужчины может оказаться фатальным.
Еще одно тяжелое наследственное заболевание - муковисцидоз. Обычно детям до полутора лет необходимо проводить диагностику на выявление этого заболевания. Его симптомы - хронические воспаления легких с диспептическими явлениями в виде поносов, сменяющихся запорами с тошнотой. Частота заболевания - 1 случай на 2500.
Редкие наследственные заболевания у детей
Существуют и такие генетические заболевания, о которых многие из нас и не слышали. Одно из них проявляется в возрасте 5 лет и называется миодистрофия Дюшенна.
Носителем мутации является мать. Основной признак заболевания - замена скелетно-полосатой мускулатуры соединительной тканью, неспособной к сокращению. Такого ребенка в перспективе ждет полная неподвижность и смерть на втором десятилетии жизни. На сегодня нет эффективной терапии миодистрофии Дюшенна, несмотря на многолетние исследования и применение генной инженерии.

Еще одно редкое генетическое заболевание - несовершенный остеогенез. Это генетическая патология опорно-двигательного аппарата, которая характеризуется деформацией костей. Остеогенезу характерны уменьшение массы костей и повышенная их ломкость. Есть предположение, что причина этой патологии кроется во врожденном нарушении обмена коллагена.
Прогерия - достаточно редкий генетический дефект, который выражается в преждевременном старении организма. В мире зафиксировано 52 случая прогерии. До полугода дети ничем не отличаются от своих сверстников. Далее их кожа начинает покрываться морщинами. В организме проявляются старческие симптомы. Дети с прогерией обычно не доживают до 15 лет. Болезнь вызвана мутациями генов.
Ихтиоз является наследственным заболеванием кожи, протекающим по типу дерматоза. Характеризуется ихтиоз нарушением ороговения и проявляется чешуйками на коже. Причина ихтиоза тоже состоит в генной мутации. Болезнь возникает в одном случае на несколько десятков тысяч.
Цистиноз - заболевание, способное превращать человека в камень. Организм человека накапливает слишком много цистина (аминокислоты). Это вещество превращается в кристаллы, вызывающие затвердение всех клеток организма. Человек постепенно превращается в статую. Обычно такие больные не доживают до 16-летия. Особенность болезни заключается в том, что мозг при этом остаётся нетронутым.
Катаплексия - это болезнь, которая имеет странные симптомы. При малейшем стрессе, нервозности, нервном напряжении внезапно расслабляются все мышцы тела - и человек теряет сознание. Все его переживания заканчиваются обмороками.
Еще одно странное и редкое заболевание - синдром экстрапирамидальной системы. Второе название болезни - пляска святого Витта. Ее приступы настигают человека внезапно: у него передёргиваются конечности, мышцы лица. Развиваясь, синдром экстрапирамидальной системы вызывает изменения в психике, ослабляет разум. Эта болезнь неизлечима.
Акромегалия имеет и другое название - гигантизм. Заболеванию характерен высокий рост человека. А вызывается недуг избыточной выработкой гормона роста соматотропина. Больной при этом всегда страдает головными болями, сонливостью. Акромегалия на сегодня тоже не имеет действенного лечения.
Все эти генетические заболевания плохо поддаются лечению, а чаще бывают и вовсе неизлечимыми.

Как выявить генетическое заболевание у ребенка
Уровень сегодняшней медицины позволяет предотвращать генетические патологии. Для этого беременным женщинам предлагается проходить комплекс исследований для определения наследственности и возможных рисков. Простыми словами, генетические анализы делают для выявления склонности будущего малыша к наследственным заболеваниям. К сожалению, статистика фиксирует все большее число генетических отклонений у новорожденных детей. А практика показывает, что большинства генетических заболеваний можно избежать, вылечивая их еще до беременности либо прерывая патологическую беременность.
Врачи акцентируют, что для будущих родителей идеальным вариантом является анализ на генетические заболевания на этапе планирования беременности.
Таким образом оценивается риск передачи будущему малышу наследственных нарушений. Для этого планирующей беременность паре советуют обратиться к врачу-генетику. Только ДНК будущих родителей позволяет оценить риски появления на свет детей с генетическими заболеваниями. Таким способом прогнозируют и здоровье будущего ребенка в целом.
Несомненный плюс генетического анализа состоит в том, что с его помощью можно предотвратить даже невынашивание плода. Но, к сожалению, по статистике, к генетическим анализам женщины прибегают чаще всего после выкидыша.
Что влияет на рождение нездоровых детей
Итак, генетические анализы позволяют оценить риски рождения нездоровых детей. То есть генетик может констатировать, что риск рождения малыша с синдромом Дауна, например, составляет 50 на 50. Какие же факторы влияют на здоровье будущего ребенка? Вот они:
- Возраст родителей. С возрастом генетические клетки накапливают все больше „поломок”. Это означает, что чем старше папа с мамой, тем выше риск рождения малыша с синдромом Дауна.
- Близкое родство родителей. И двоюродные, и троюродные родственники с большей вероятностью являются носителями одинаковых больных генов.
- Рождение у родителей или прямых родственников больных детей увеличивает шансы появления на свет еще одного малыша с генетическими болезнями.
- Хронические заболевания семейного характера. Если и папа, и мама страдают, например, рассеянным склерозом, то вероятность заболевания и будущего малыша очень высока.
- Принадлежность родителей к определенным этническим группам. К примеру, болезнь Гоше, проявляющаяся поражением костного мозга и слабоумием, чаще бывает у ашкеназских евреев, болезнь Вильсона - у народов Средиземноморья.
- Неблагоприятность внешней среды. Если будущие родители живут вблизи химического комбината, атомной электростанции, космодрома, то загрязненная вода и воздух способствуют генным мутациям у детей.
- Воздействие облучением на одного из родителей - это тоже повышение риска генных мутаций.
Итак, сегодня будущие родители имеют все шансы и возможности избежать появления на свет больных детей. Ответственное отношение к беременности, ее планирование позволит в полной мере ощущать радость материнства и отцовства.
Специально для - Диана Руденко
Генетические заболевания - это болезни, которые возникают у человека из-за хромосомных мутаций и дефектов в генах, то есть в наследственном клеточном аппарате. Повреждения генетического аппарата приводят к серьезным и разнообразным проблемам - тугоухости, нарушению зрения, задержке психо-физического развития, бесплодию и многим другим болезням.
Понятие о хромосомах
В каждой клетке организма есть клеточное ядро, основную часть которого составляют хромосомы. Набор 46 хромосом - это кариотип. 22 пары хромосом являются аутосомами, а последняя 23 пара - половыми хромосомами. Вот этими половыми хромосомами мужчина и женщина разнятся друг с другом.
Всем известно, что у женщин состав хромосом - XX , а у мужчин - XY . При возникновении новой жизни мать передает Х хромосому, а отец - или Х или Y .Именно с этими хромосомами, вернее с их патологией, и связывают генетические заболевания.
Ген может мутировать. Если он рецессивный, то мутация может передаваться из поколения в поколение, никак не проявляясь. Если мутация доминантная, то она обязательно проявится, поэтому желательно обезопасить свой род, вовремя узнав о потенциальной проблеме.
Генетические заболевания - проблема современного мира.
Наследственной патологии с каждым годом выявляется все больше и больше. Генетических заболеваний уже сейчас известно более 6000 наименований, они связаны как с количественными, так и с качественными изменениями в генетическом материале. По данным Всемирной организации здравоохранения приблизительно 6% детей страдают наследственными заболеваниями.
Самое неприятное, что генетические заболевания могут проявиться только через несколько лет. Родители радуются здоровому малышу, не подозревая, что дети больны. Так, например, некоторые наследственные болезни могут заявить о себе в том возрасте, когда у самого больного появляются дети. И половина из этих детей может быть обречена, если родитель носит доминантный патологический ген.
А ведь иногда достаточно знать, что организм ребенка не способен усваивать определенный элемент. Если родители будут вовремя об этом предупреждены, то в дальнейшем, просто избегая продуктов, содержащих этот компонент, можно защитить организм от проявлений генетической болезни.
Поэтому очень важно, чтобы при планировании беременности был сделан тест на генетические болезни. Если тест покажет вероятность передачи мутированного гена будущему ребенку, то в клиниках Германии могут провести генную коррекцию при искусственном оплодотворении. Сделать анализы можно и во время беременности.
В Германии Вам могут быть предложены инновационные технологии самых последних диагностических разработок, которые смогут развеять все Ваши сомнения и подозрения. Около 1000 генетических заболеваний могут быть выявлены еще до рождения ребенка.
Генетические заболевания - какие бывают виды?
Мы рассмотрим две группы генетических заболеваний (на самом деле их больше)
1. Болезни с генетической предрасположенностью.
Такие болезни могут проявиться под воздействием внешних факторов среды и очень зависят от индивидуальной генетической предрасположенности. Некоторые болезни могут проявиться у лиц преклонного возраста, а другие могут выявиться неожиданно и рано. Так, например, сильный удар по голове может спровоцировать эпилепсию, прием неусвояемого продукта может вызвать бурную аллергию и т.д.
2. Болезни, которые развиваются при наличии доминантного патологического гена.
Такие генетические заболевания передаются из поколения в поколение. Например, мышечная дистрофия, гемофилия, шестипалость, фенилкетонурия.
Семьи с высоким риском рождения ребенка с генетическим заболеванием.
Каким семьям в первую очередь необходимо посетить генетические консультации и выявить риск возможности наследственных заболеваний у потомства?
1. Кровнородственные браки.
2. Бесплодие невыясненной этиологии.
3. Возраст родителей. Считается фактором риска, если будущей маме больше 35 лет, а отцу - больше 40 (по некоторым данным -больше 45). С возрастом в половых клетках появляется всё больше повреждений, которые увеличивают риск рождения малыша с наследственной патологией.
4. Наследственные семейные болезни, то есть похожие заболевания у двух и более членов семьи. Есть заболевания с ярко выраженными симптомами и сомнений, что это наследственная болезнь у родителей не остается. Но есть признаки (микроаномалии), на которые родители не обращают должного внимания. Например, необычная форма век и ушей, птоз, пятна на коже кофейного цвета, странный запах мочи, пота и т.д.
5. Отягощенный акушерский анамнез - рождение мертвого ребенка, более одного самопроизвольного выкидыша, замершие беременности.
6. Родители являются представителями малочисленной народности или выходцами из одного маленького населенного пункта (в этом случае высокая вероятность кровнородственных браков)
7. Воздействие неблагоприятных бытовых или профессиональных факторов на одного из родителей (дефицит кальция, недостаточное белковое питание, работа в типографии и т.д.)
8. Плохая экологическая обстановка.
9. Употребление лекарств с тератогенными свойствами во время беременности.
10. Болезни, особенно вирусной этиологии (краснуха, ветряная оспа), которые перенесла беременная.
11. Нездоровый образ жизни. Постоянные стрессы, алкоголь, курение, наркотики, плохое питание могут вызвать поражение генов, так как структура хромосом под воздействием неблагоприятных условий может меняться в течение всей жизни.
Генетические заболевания - какие есть методики для определения диагностики?
В Германии диагностика генетических заболеваний высокоэффективна, так как применяются все известные высокотехнологичные методы и абсолютно все возможности современной медицины (анализ ДНК, секвенированиеДНК,генетический паспорт и т.д.) для определения потенциальных наследственных проблем. Остановимся на самых распространенных.
1. Клинико-генеалогический метод.
Этот метод - важное условие качественной диагностики генетического заболевания. Что в него входит? Прежде всего, подробный опрос пациента. Если есть подозрение на наследственное заболевание, то опрос касается не только самих родителей, но и всех родственников, то есть собирается полная и тщательная информация о каждом члене семьи. В последующем составляется родословная с указанием всех признаков и заболеваний. Этот метод заканчивается генетическим анализом, на основании которого ставится верный диагноз и выбирается оптимальная терапия.
2. Цитогенетический метод.
Благодаря этому методу определяются болезни, возникающие из-за проблем хромосом клетки.Цитогенетический метод исследует внутреннюю структуру и расположение хромосом. Это очень простая методика - берется соскоб со слизистой внутренней поверхности щеки, затем соскоб рассматривается под микроскопом. Этот метод проводится у родителей, у членов семьи. Разновидность цитогенетического метода - молекулярно-цитогенетический, который позволяет увидеть мельчайшие изменения в строении хромосом.
3. Биохимический метод.
Данный метод, исследуя биологические жидкости матери (кровь, слюну, пот, мочу и т.д.), может определить наследственные болезни, в основе которых лежат нарушения обмена веществ. Одна из самых известных генетических болезней, связанных с нарушением метаболизма - альбинизм.
4. Молекулярно-генетический метод.
Это самый прогрессивный метод в настоящее время, определяющий моногенные заболевания. Он очень точен и выявляет патологию даже в последовательности нуклеотидов. Благодаря этому методу можно определить генетическую предрасположенность к развитию онкологии (рак желудка, матки, щитовидной железы, простаты, лейкоза и др.) Поэтому он особенно показан лицам, у которых близкие родственники страдали эндокринными, психическими, онкологическими и сосудистыми заболеваниями.
В Германии для диагностики генетических болезней вам будет предложен весь спектр цитогенетических, биохимических, молекулярно-генетических исследований, пренатальная и постнатальная диагностика плюс неонатальный скрининг новорожденного. Здесь можно пройти около 1000 генетических тестов, которые допущены к клиническому применению на территории страны.
Беременность и генетические заболевания
Пренатальная диагностика дает большие возможности для определения генетических болезней.
В пренатальную диагностику входят такие исследования, как
- биопсия хориона - анализ тканихориальной оболочки плода на 7-9 недели беременности; биопсия может выполняться двумя способами - через шейку матки или путем прокола передней брюшной стенки;
- амниоцентез - на 16-20 неделе беременности получают околоплодную жидкость благодаря пункции передней брюшной стенки;
- кордоцентез - это один из самых важных методов диагностики, так как исследуют кровь плода, полученную из пуповины.
Также в диагностике используют такие скрининговые методы, как трипл-тест, фетальная эхокардиография, определение альфа-фетопротеина.
Ультразвуковое изображение плода в 3D - и 4D измерениях позволяет существенно сократить рождение младенцев с пороками развития. Все эти методики обладают низким риском побочных эффектов и не сказываются отрицательно на течение беременности. Если выявлено генетическое заболевание во время беременности, то врач предложит определенную индивидуальную тактику ведения беременной женщины. В раннем периоде беременности в немецких клиниках могут предложить генную коррекцию. Если коррекция генов проведена в эмбриональном периоде вовремя, то можно откорректировать некоторые генетические дефекты.
Неонатальный скрининг ребенка в Германии
Неонатальный скрининг новорожденного выявляет самые распространенные генетические заболевания у младенца. Ранняя диагностика позволяет понять, что ребенок болен еще до появления первых признаков болезни. Таким образом, можно выявить следующие наследственные заболевания - гипотиреоз, фенилкетонурия, болезнь кленового сиропа, адреногенитальный синдром и другие.
Если вовремя выявить эти болезни, то шанс их вылечить достаточно высок. Качественный неонатальный скрининг тоже является одной из причин, из-за которой женщины прилетают в Германии, чтобы именно здесь родить ребенка.
Лечение генетических заболеваний человека в Германии
Еще совсем недавно генетические болезни не лечились, это считалось невозможным, а значит, бесперспективным. Поэтому диагноз генетического заболевания расценивался как приговор, и в лучшем случае можно было рассчитывать только на симптоматическое лечение. Сейчас ситуация изменилась. Прогресс заметен, появились положительные результаты лечения, мало того, наука постоянно открывает новые и эффективные способы лечения наследственных болезней. И хоть многие наследственные болезни вылечить сегодня еще невозможно, но на будущее врачи-генетики смотрят с оптимизмом.
Лечение генетических заболеваний очень сложный процесс. Он основывается на тех же принципах воздействиях, как и любая другая болезнь - этиологических, патогенетических и симптоматических. Коротко остановимся на каждом.
1. Этиологический принцип воздействия.
Этиологический принцип воздействия - самый оптимальный, так как лечение направлено непосредственно на причины болезни. Это достигается с помощью методов генной коррекции, выделении поврежденной части ДНК, его клонировании и внедрении в организм. На сегодняшний момент эта задача очень сложная, но при некоторых заболеваниях уже выполнимая
2. Патогенетический принцип воздействия.
Лечение направлено на механизм развития болезни, то есть оно изменяет физиологические и биохимические процессы в организме, устраняя дефекты, вызванные патологическим геном. По мере развития генетики патогенетический принцип воздействия расширяется, и для разных болезнейс каждым годом будут находиться новые пути и возможности коррекции нарушенных звеньев.
3. Симптоматический принцип воздействия.
Согласно этому принципу лечение генетического заболевания направлено на снятие боли и других неприятных явлений и препятствует дальнейшему прогрессированию болезни. Симптоматическое лечение назначается всегда, оно может сочетаться с другими методами воздействия, а может быть самостоятельным и единственным лечением. Это назначение обезболивающих препаратов, успокаивающих, противосудорожных и других лекарств. Фармакологическая промышленность сейчас очень развита, поэтому спектр лекарственных средств, применяемый для лечения (вернее, для облечения проявлений) генетических болезней очень широк.
Помимо медикаментозного лечения к симптоматическому лечению относят применение физиотерапевтических процедур - массаж, ингаляции, электротерапия, бальнеолечение и т.д.
Иногда применяется хирургический метод лечения для корректирования деформаций, как внешних, так и внутренних.
Врачи-генетики Германии имеют уже большой опыт лечения генетических заболеваний. В зависимости от проявления болезни, от индивидуальных параметров применяются следующие подходы:
- генетическая диетология;
- генная терапия,
- трансплантация стволовых клеток,
- трансплантация органов и тканей,
- энзимотерапия,
- заместительные терапии гормонами и ферментами;
- гемосорбция, плазмофорез, лимфосорбция - очистка организма специальными препаратами;
- хирургическое лечение.
Конечно, лечение генетических болезней длительное и не всегда успешное. Но с каждым годом растет количество новых подходов к терапии, поэтому врачи настроены оптимистично.
Генная терапия
Особые надежды врачи и ученые всего мира возлагают на генную терапию, благодаря которой можно ввести качественный генетический материал в клетки больного организма.
Генная коррекция состоит из последующих этапов:
- получение генетического материала (соматических клеток) от пациента;
- введение в этот материал лечебного гена, который корректирует генный дефект;
- клонирование скорректированных клеток;
- внедрение новых здоровых клеток в организм пациента.
Генная коррекция требует большой осторожности, так как наука еще не располагает полными сведениями о работе генетического аппарата.
Список генетических заболеваний, которые можно выявить
Классификаций генетических заболеваний много, они условны и различаются по принципу построения. Ниже мы приводим список наиболее распространенных генетических и наследственных болезней:
- болезнь Гюнтера;
- болезнь Кэнэвэн;
- болезнь Ниманна-Пика;
- болезнь Тея-Сакса;
- болезнь Шарко-Мари;
- гемофилия;
- гипертрихоз;
- дальтонизм - невосприимчивость к цвету, дальтонизм передается только с женской хромосомой, но болезнью страдают исключительно мужчины;
- заблуждение Капграса;
- лейкодистрофия Пелицеуса-Мерцбахера;
- линии Блашко;
- микропсия;
- муковисцидоз;
- нейрофиброматоз;
- обостренная рефлексия;
- порфирия;
- прогерия;
- расщепление позвоночника;
- синдром Ангельмана;
- синдром взрывающейся головы;
- синдром голубой кожи;
- синдром Дауна;
- синдром живого трупа;
- синдром Жубера;
- синдром каменного человека
- синдром Клайнфелтера;
- синдром Клейна-Левина;
- синдром Мартина-Белла;
- синдром Марфана;
- синдром Прадера-Вилли;
- синдром Робена;
- синдром Стендаля;
- синдром Тернера;
- слоновья болезнь;
- фенилкетонурия.
- цицеро и другие.
В этом разделе мы остановимся подробно на каждом заболевании и расскажем, как можно вылечить некоторые из них. Но лучше предупредить генетические заболевания, чем их лечить, тем более многие болезни современная медицина не знает, как вылечить.
Генные болезни - это группа заболеваний очень неоднородная по своим клиническим проявлениям. Основные внешние проявления генетических заболеваний:
- маленькая голова (микроцефалия);
- микроаномалии («третье веко», короткая шея, необычной формы уши и т.д.)
- задержка физического и умственного развития;
- изменение половых органов;
- чрезмерная расслабленность мышц;
- изменение формы пальцев стопы и кисти;
- нарушение психологического статуса и др.
Генетические заболевания - как получить консультацию в Германии?
Беседа в генетической консультации и пренатальная диагностика способны предотвратить тяжелые наследственные болезни, передающиеся на генном уровне. Главная цель консультирования у генетика - это выявление степени риска у новорожденного генетической болезни.
Для того чтобы получить качественное консультирование и совет по поводу дальнейших действий, надо серьезно настроиться на общение с врачом. Перед консультацией необходимо ответственно подготовиться к разговору, вспомнить болезни, которыми перенесли родственники, описать все проблемы здоровья и записать основные вопросы, на которые вы бы хотели получить ответы.
Если в семье уже есть ребенок с аномалией, с врожденными пороками развития, захватите его фотографии. Обязательно надо рассказать о самопроизвольных выкидышах, о случаях мертворождения, о том, как проходила (проходит) беременность.
Врач генетической консультации сможет рассчитать риск появления младенца с тяжелой наследственной патологией (даже в будущем). Когда можно говорить о высоком риске развития генетического заболевания?
- генетический риск до 5% считается низким;
- не более 10% - риск слегка повышенный;
- от 10% до 20% - риск средний;
- выше 20% - риск высокий.
Врачи советуют расценивать риск около и выше 20% как повод к прерыванию беременности или (если таковой еще нет) как противопоказание к зачатию. Но окончательное решение принимает, конечно, супружеская пара.
Консультация может проходить в несколько этапов. При диагностике генетического заболевания у женщины, врач вырабатывает тактику ведения ее до беременности и при необходимости во время беременности. Врач подробно рассказывает о течении заболевания, о продолжительности жизни при данной патологии, обо всех возможностях современной терапии, о ценовой составляющей, о прогнозе заболевания. Иногда генная коррекция во время искусственного оплодотворения или в период эмбрионального развития позволяет избежать проявлений болезни. С каждым годом разрабатываются новые методы генной терапии и профилактики наследственных заболеваний, поэтому шансы вылечить генетическую патологию постоянно увеличиваются.
В Германии активно внедряются и уже успешно применяются методы борьбы с генными мутациями при помощи стволовых клеток, рассматриваются новые технологии для лечения и диагностики генетических заболеваний.
В статье отражены современные данные о распространенности, клинике, диагностике, в том числе пренатальной и неонатальной, чаще встречающихся наследственных заболеваний, сроках проведения исследований для пренатальной диагностики и трактовка полученных данных. Представлены также данные о принципах терапии наследственных болезней.
Наследственные болезни — заболевания, возникновение и развитие которых связано с изменениями (мутациями) генетического материала. В зависимости от характера мутаций выделяют моногенные наследственные, хромосомные, митохондриальные и мультифакториальные болезни. (Е.К. Гинтер, 2003). От наследственных заболеваний следует отличать врожденные заболевания, которые обусловлены внутриутробными повреждениями, вызванными, например, инфекцией (сифилис или токсоплазмоз) или воздействием иных повреждающих факторов на плод во время беременности.
По данным ВОЗ, 5-7% новорожденных имеют различную наследственную патологию, в которой моногенные формы составляют 3-5%. Число зарегистрированных наследственных болезней (НБ) постоянно растет . Многие генетически обусловленные заболевания проявляются не сразу после рождения, а спустя некоторое, порой весьма долгое, время. Ни одна врачебная специальность не может обойтись без знаний основ медицинской генетики, так как наследственные болезни поражают все органы и системы органов человека . Ключевым моментом медицинской генетики является разработка методов диагностики, лечения и профилактики наследственных болезней человека.
Наследственные болезни имеют свои особенности:
1. НБ часто носят семейный характер. В то же время наличие заболевания только у одного из членов родословной не исключает наследственного характера этой болезни (новая мутация, появление рецессивной гомозиготы).
2. При НБ в процесс вовлекаются сразу несколько органов и систем.
3. Для НБ характерно прогрессирующее хроническое течение.
4. При НБ бывают редко встречающиеся специфические симптомы или их сочетания: голубые склеры говорят о несовершенном остеогенезе, потемнение мочи на пеленках — об алкаптонурии, мышиный запах — о фенилкетонурии и др.
Этиология наследственных болезней. Этиологическими факторами наследственных болезней являются мутации (изменения) наследственного материала. Мутации, затрагивающие весь хромосомный набор или отдельные хромосомы в нем (полиплоидии и анэуплоидии), а также участки хромосом (структурные перестройки — делеции, инверсии, транслокации, дупликации и т.д.) приводят к развитию хромосомных болезней. При хромосомных болезнях нарушается сбалансированность набора генов, что может приводить к внутриутробной гибели эмбрионов и плодов, врожденным порокам развития и другим клиническим проявлениям. Чем больше хромосомного материала вовлечено в мутацию, тем раньше проявляется заболевание и тем значительнее нарушения в физическом и психическом развитии индивидуума. Известно около 1000 типов хромосомных нарушений, выявляемых у человека. Хромосомные заболевания редко передаются от родителей к детям, в основном это случайно возникшая новая мутация. Но около 5% людей являются носителями сбалансированных изменений в хромосомах, поэтому при бесплодии, мертворождениях, привычном невынашивании или наличии в семье ребенка с хромосомной патологией необходимо исследовать хромосомы каждого из супругов . Генными болезнями называются заболевания, обусловленные изменениями структуры молекулы ДНК (генные мутации).
Моногенные заболевания (собственно наследственные заболевания) — фенотипически генные мутации — могут проявляться на молекулярном, клеточном, тканевом, органном и организменном уровнях.
Полигенные заболевания (мультифакториальные) — болезни с наследственной предрасположенностью, обусловлены взаимодействием нескольких (или многих) генов и факторов окружающей среды.
Вклад наследственных и врожденных болезней в младенческую и детскую смертность в развитых странах (по материалам ВОЗ) велик . Среди главных причин смерти в возрасте до 1 года доля перинатальных факторов составляет 28%, врожденные и наследственные болезни -25%, синдром внезапной смерти ребенка — 22%, инфекции -9%, другие — 6%. Главными причинами смерти в возрасте от 1 года до 4 лет являются несчастные случаи (31%), врожденные и наследственные болезни (23%), опухоли (16%), инфекции (11%), другие (6%).
Доказана значительная роль наследственной предрасположенности в возникновении широко распространенных болезней (болезнь желудка и двенадцатиперстной кишки, эссенциальная гипертензия, ишемическая болезнь сердца, язвенная псориаз, бронхиальная астма и др.). Поэтому для профилактики и лечения этих болезней необходимо знать механизмы взаимодействия средовых и наследственных факторов в их возникновении и развитии.
Наследственные болезни длительное время не поддавались лечению, а единственным методом профилактики была рекомендация воздержаться от деторождения. Эти времена прошли. Современная медицинская генетика вооружила клиницистов методами ранней, досимптомной (доклинической) и даже пренатальной диагностики наследственных болезней. Интенсивно развиваются и в некоторых центрах уже применяются методы преимплантационной (до имплантации зародыша) диагностики.
Сейчас сложилась стройная система профилактики наследственных болезней: медико-генетическое консультирование, преконцепционная профилактика, пренатальная диагностика, массовая диагностика у новорожденных наследственных болезней обмена, поддающихся диетической и лекарственной коррекции, диспансеризация больных и членов их семей. Внедрение этой системы обеспечивает снижение частоты рождения детей с врожденными пороками развития и наследственными болезнями на 60-70%.
Моногенные болезни (МБ) или генные (так их называют за рубежом) заболевания. В основе МБ лежат единичные генные или точковые мутации. МБ составляют значительную долю наследственной патологии и насчитывают сегодня более 4500 заболеваний. По данным литературы, в разных странах они выявляются у 30-65 детей в расчете на 1000 новорожденных, что составляет 3,0-6,5%, а в структуре общей смертности детей до 5 лет на их долю приходится 10-14%. Заболевания многочислены и отличаются выраженным клиническим полиморфизмом. Генные болезни чаще всего проявляются наследственными дефектами обмена веществ — ферментопатиями. Одна и та же генная болезнь может быть обусловлена разными мутациями. Например, в гене муковисцидоза описано свыше 200 таких мутаций, в гене фенилкетонурии — 30. В некоторых случаях мутации в разных частях одного гена могут приводить к различным болезням (например, мутации RET-онкогена).
Патологические мутации могут реализовываться в разные периоды онтогенеза. Большая часть их проявляется внутриутробно (до 25% всей наследственной патологии) и в допубертатном возрасте (45%). Около 25% патологических мутаций проявляются в пубертатном и юношеском возрасте, и лишь 10% моногенных болезней развиваются в возрасте старше 20 лет.
Вещества, накапливающиеся в результате отсутствия или снижения активности ферментов, либо сами оказывают токсическое действие, либо включаются в цепи вторичных обменных процессов, в результате которых образуются токсические продукты. Общая частота генных болезней в популяциях людей составляет 2-4%.
Генные болезни классифицируются: согласно типам наследования (аутосомно-доминантные, аутосомно-рецессивные, Х-сцепленные доминантные и т.д.); по характеру метаболического дефекта — наследственные болезни обмена -НБО (болезни, связанные с нарушением аминокислотного, углеводного, липидного, минерального обменов, обмена нуклеиновых кислот и др.); в зависимости от системы или органа, наиболее вовлеченного в патологический процесс (нервные, глазные, кожные, эндокринные и др.).
Среди НБО выделяют:
— болезни аминокислотного обмена (ФКУ, тирозиноз, алкаптонурия, лейциноз и др.);
— болезни углеводного обмена (галактоземия, гликогенозы, мукополисахаридозы);
— болезни порфиринового и билирубинового обмена (синдромы Жильбера, Криглер-Найяра, порфирии и др.);
— болезни биосинтеза кортикостероидов (адрено-генитальный синдром, гипоальдостеронизм и др.);
— болезни пуринового и пирамидинового обмена (оротовая ацидурия, подагра и др.);
— болезни липидного обмена (эссенциальные семейные липидозы, ганглиозидозы, сфинголипидозы, цереброзидозы и др.);
— болезни эритрона (анемия Фанкони, гемолитические анемии, дефицит глюкозо-6-фосфатдегидрогеназы и др.);
— болезни обмена металлов (болезни Вильсона-Коновалова, Менкеса, семейный периодический паралич и др.);
болезни транспорта систем почек (болезнь де Тони-Дебре-Фанкони, тубулопатии, вита- мин D-резистентный рахит и др.).
Хромосомными болезнями (хромосомными синдромами) называются комплексы множественных врожденных пороков развития, вызываемых числовыми (геномные мутации) или структурными (хромосомные аберрации) изменениями хромосом, видимыми в световой микроскоп.
Хромосомные аберрации и изменения количества хромосом, как и генные мутации, могут возникать на разных этапах развития организма. Если они возникают в гаметах родителей, то аномалия будет наблюдаться во всех клетках развивающегося организма (полный мутант). Если аномалия возникает в процессе эмбрионального развития при дроблении зиготы, кариотип плода будет мозаичным. Мозаичные организмы могут содержать несколько (2, 3, 4 и более) клеточных клонов с различными кариотипами. Это явление может сопровождаться мозаицизмом во всех, либо в отдельных органах и системах. При незначительном количестве аномальных клеток фенотипические проявления могут не обнаруживаться.
Этиологическими факторами хромосомной патологии являются все виды хромосомных мутаций (хромосомные аберрации) и некоторые геномные мутации (изменения числа хромосом). У человека встречаются только 3 типа геномных мутаций: тетраплоидия, триплоидия и анеуплоидия. Из всех вариантов анеуплоидий встречаются только трисомии по аутосомам, полисомии по половым хромосомам (три-, тетра- и пентасомии), а из моносомий — только моносомия X.
У человека обнаружены все типы хромосомных мутаций: делеции, дупликации, инверсии и транслокации. Делеция (нехватка участка) в одной из гомологичных хромосом означает частичную моносомию по этому участку, а дупликация (удвоение участка) — частичную трисомию.
Хромосомные болезни у новорожденных детей встречаются с частотой примерно 2,4 случая на 1000 родившихся. Большинство хромосомных аномалий (полиплоидии, гаплоидии, трисомии по крупным хромосомам, моносомий) несовместимы с жизнью — эмбрионы и плоды элиминируются из организма матери, в основном, в ранние сроки беременности.
Хромосомные аномалии возникают и в соматических клетках с частотой около 2%. В норме такие клетки элиминируются иммунной системой, если они проявляют себя чужеродно. Однако, в некоторых случаях (активация онкогенов) хромосомные аномалии могут быть причиной злокачественного роста. Например, транслокация между 9-й и 22-й хромосомами вызывает хронический миелолейкоз.
Общим для всех форм хромосомных болезней является множественность поражения. Это черепно-лицевые поражения, врожденные пороки развития систем органов, замедленные внутриутробные и постнатальные рост и развитие, отставание в психическом развитии, нарушения функций нервной, иммунной и эндокринной систем.
Фенотипические проявления хромосомных мутаций зависят от следующих главных факторов: особенностей вовлеченной в аномалию хромосомы (специфический набор генов), типа аномалии (трисомия, моносомия, полная, частичная), размера недостающего (при частичной моносомии) или избыточного (при частичной трисомии) генетического материала, степени мозаичности организма по аберрантным клеткам, генотипа организма, условий среды. В настоящее время выяснилось, что при хромосомных мутациях наиболее специфичные для того или иного синдрома проявления обусловлены изменениями небольших участков хромосом. Так, специфические симптомы болезни Дауна обнаруживаются при трисомии небольшого сегмента длинного плеча 21-й хромосомы (21q22.1), синдрома кошачьего крика — при делеции средней части короткого плеча 5-й хромосомы (5р15), синдрома Эдвардса — при трисомии сегмента длинного плеча хромосомы
Окончательный диагноз хромосомных болезней устанавливается цитогенетическими методами.
Трисомии. Наиболее часто у человека встречаются трисомии по 21-й, 13-й и 18-й паре хромосом.
Синдром (болезнь) Дауна (СД) — синдром трисомии 21 — самая частая форма хромосомной патологии у человека (1:750). Цитогенетически синдром Дауна представлен простой трисомией (94% случаев), транслокационной формой (4%) или мозаицизмом (2% случаев). У мальчиков и девочек патология встречается одинаково часто.
Достоверно установлено, что дети с синдромом Дауна чаще рождаются у пожилых родителей. Возможность возникновения повторного случая заболевания в семье с трисомией хромосомы 21 составляет 1-2% (с возрастом матери риск увеличивается). Три четверти всех случаев транслокаций при болезни Дауна обусловлены мутацией de novo. 25% случаев транслокации носят семейный характер, при этом возвратный риск гораздо выше (до 15%) и во многом зависит от того, кто из родителей несет симметричную транслокацию и какая из хромосом вовлечена.
Для больных характерны: округлой формы голова с уплощенным затылком, узкий лоб, широкое, плоское лицо, типичны эпикант, гипертелоризм, запавшая спинка носа, косой (монголоидный) разрез глазных щелей, пятна Брушфильда (светлые пятна на радужке), толстые губы, утолщенный язык с глубокими бороздами, выступающий изо рта, маленькие, округлой формы, низко расположенные ушные раковины со свисающим завитком, недоразвитая верхняя челюсть, высокое небо, неправильный рост зубов, короткая шея.
Из пороков внутренних органов наиболее типичны пороки сердца (дефекты межжелудочковой или межпредсердной перегородок, фиброэластоз и др.) и органов пищеварения (атрезия двенадцатиперстной кишки, болезнь Гиршпрунга и др.). Среди больных с синдромом Дауна с более высокой частотой, чем в популяции, встречаются случаи лейкемии и гипотиреоза. У маленьких детей резко выражена мышечная гипотония, а у детей старшего возраста часто обнаруживается катаракта. С самого раннего возраста отмечается отставание в умственном развитии. Среднее значение IQ составляет 50, но чаще встречается умеренная задержка умственного развития. Средняя продолжительность жизни при синдроме Дауна значительно ниже (36 лет), чем в популяции.
Синдром Патау (СП) — синдром трисомии 13 — встречается с частотой 1:7000 (с учетом мертворождений). Имеются два цитогенетических варианта синдрома Патау: простая трисомия и робертсоновская транслокация. 75% случаев трисомии хромосомы 13 обусловлено появлением дополнительной хромосомы 13. Между частотой возникновения синдрома Патау и возрастом матери прослеживается зависимость, хотя и менее строгая, чем в случае болезни Дауна. 25% случаев СП — следствие транслокации с вовлечением хромосом 13-й пары, в том числе в трех из четырех таких случаев мутация de novo. В четверти случаев транслокация с вовлечением хромосом 13-й пары имеет наследственный характер с возвратным риском 14%.
При СП наблюдаются тяжелые врожденные пороки. Дети с синдромом Патау рождаются с массой тела ниже нормы (2500 г). У них выявляются: умеренная микроцефалия, нарушение развития различных отделов ЦНС, низкий скошенный лоб, суженные глазные щели, расстояние между которыми уменьшено, микрофтальмия и колобома, помутнение роговицы, — запавшая переносица, широкое основание носа, деформированные ушные раковины, расщелина верхней губы и неба, полидактилия, флексорное положение кистей, короткая шея.
У 80% новорожденных встречаются пороки развития сердца: дефекты межжелудочковой и межпредсердной перегородок, транспозиции сосудов и др. Наблюдаются фиброкистозные изменения поджелудочной железы, добавочные селезенки, эмбриональная пупочная грыжа. Почки увеличены, имеют повышенную дольчатость и кисты в корковом слое, выявляются пороки развития половых органов. Для СП характерна задержка умственного развития.
Большинство больных с синдромом Патау (98%) умирают в возрасте до года, оставшиеся в живых страдают глубокой идиотией.
Синдром Эдвардса (СЭ) — синдром трисомии 18 — встречается с частотой примерно 1:7000 (с учетом мертворождений). Дети с трисомией 18 чаще рождаются у пожилых матерей, взаимосвязь с возрастом матери менее выражена, чем в случаях трисомии хромосомы 21 и 13. Для женщин старше 45 лет риск родить больного ребенка составляет 0,7%. Цитогенетически синдром Эдвардса представлен простой трисомией 18 (90%), в 10% случаев наблюдается мозаицизм. У девочек встречается значительно чаще, чем у мальчиков, что связано, возможно, с большей жизнестойкостью женского организма.
Дети с трисомией 18 рождаются с низким весом (в среднем 2177 г), хотя сроки беременности нормальные или даже превышают норму.
Фенотипические проявления синдрома Эдвардса многообразны: часто отмечаются аномалии мозгового и лицевого черепа, мозговой череп долихоцефалической формы, нижняя челюсть и ротовое отверстие маленькие, глазные щели узкие и короткие, ушные раковины деформированы и в подавляющем большинстве случаев расположены низко, несколько вытянуты в горизонтальной плоскости, мочка, а часто и козелок отсутствуют; наружный слуховой проход сужен, иногда отсутствует, грудина короткая, из-за чего межреберные промежутки уменьшены и грудная клетка шире и короче нормальной, аномальное развитие стопы: пятка резко выступает, свод провисает (стопа-качалка), большой палец утолщен и укорочен; отмечаются пороки сердца и крупных сосудов: дефект межжелудочковой перегородки, аплазии одной створки клапанов аорты и легочной артерии, гипоплазия мозжечка и мозолистого тела, изменения структур олив, выраженная умственная отсталость, снижение мышечного тонуса, переходящее в повышение со спастикой.
Продолжительность жизни детей с синдромом Эдвардса невелика: 60% детей умирают в возрасте до 3 мес., до года доживает лишь один ребенок из десяти; оставшиеся в живых — глубокие олигофрены.
Синдром трисомии X. Частота встречаемости 1:1000. Кариотип 47, ХХХ. В настоящее время имеются описания тетра-и пентосомий X. Трисомия по Х-хромосоме возникает в результате нерасхождения половых хромосом в мейозе или при первом делении зиготы.
Синдрому полисомии X присущ значительный полиморфизм. Женский организм с мужеподобным телосложением. Могут быть недоразвиты первичные и вторичные половые признаки. В 75% случаев у больных наблюдается умеренная степень умственной отсталости. У некоторых из них нарушена функция яичников (вторичная аменорея, дисменорея, ранняя менопауза). Иногда такие женщины могут иметь детей. Повышен риск заболевания шизофренией. С увеличением числа дополнительных Х-хромосом нарастает степень отклонения от нормы.
Синдром Шерешевского-Тернера (моносомия X). Частота встречаемости 1:1000.
Кариотип 45,Х. У 55% девочек с этим синдромом обнаруживается кариотип 45,X, у 25% — изменение структуры одной из Х-хромосом. В 15% случаев выявляется мозаичность в виде двух или более клеточных линий, одна из которых имеет кариотип 45,X, а другая представлена кариотипами 46,XX или 46,XY. Третья клеточная линия наиболее часто представлена кариотипом 45,Х, 46^ХХ, 47,ХХХ. Риск наследования синдрома составляет 1 случай на 5000 новорожденных. Фенотип женский.
У новорожденных и детей грудного возраста отмечаются признаки дисплазии (короткая шея с избытком кожи и крыловидными складками, лимфатический отек стоп, голеней, кистей рук и предплечий, вальгусная деформация стоп, множественные пигментные пятна, низкорослость. В подростковом возрасте выявляются отставание в росте (рост взрослых 135-145 см) и в развитии вторичных половых признаков. Для взрослых характерно: низкое расположение ушных раковин, недоразвитие первичных и вторичных половых признаков, дисгенезия гонад, сопровождающаяся первичной аменореей, у 20% больных имеются пороки сердца (коарктация аорты, стеноз аорты, пороки развития митрального клапана),у 40% — пороки почек (удвоение мочевыводящих путей, подковообразная почка).
У больных, имеющих клеточную линию с Y-хромосомой, может развиться гонадобластома, часто наблюдается аутоиммунный тиреоидит. Интеллект страдает редко. Недоразвитие яичников приводит к бесплодию. Для подтверждения диагноза наряду с исследованием клеток периферической крови проводятся биопсия кожи и исследование фибробластов. В некоторых случаях генетическое исследование позволяет выявить синдром Нунан, который имеет схожие фенотипические проявления, однако этиологически не связан с синдромом Шерешевского-Тернера. В отличие от последнего при синдроме Нунан заболеванию подвержены как мальчики, так и девочки, а в клинической картине доминирует задержка умственного развития, характерен Тернер-фенотип при нормальном мужском или женском кариотипе. У большинства больных синдромом Нунан имеется нормальное половое развитие и сохранена фертильность. В большинстве случаев заболевание не сказывается на продолжительности жизни пациентов.
Синдром Клайнфелтера. Частота встречаемости 1: 1000 мальчиков. Кариотип 47,XXY. У 80% мальчиков с синдромом Клайнфелтера, в 20% случаев обнаруживается мозаицизм, при котором одна из клеточных линий имеет кариотип 47,XXY. Возвратный риск для синдрома Клайнфелтера не превышает общепопуляционные показатели и составляет 1 случай на 2000 живорожденных детей. Фенотип мужской.
Клиника отличается широким разнообразием и неспецифичностью проявлений. У мальчиков с этим синдромом рост превышает средние показатели, характерные для данной семьи, у них длинные конечности, женский тип телосложения, гинекомастия. Слабо развит волосяной покров, снижен интеллект. Вследствие недоразвития семенников слабо выражены первичные и вторичные половые признаки, нарушено течение сперматогенеза. Половые рефлексы сохранены. Иногда эффективно раннее лечение мужскими половыми гормонами. Чем больше в наборе Х-хромосом, тем значительнее снижен интеллект. Инфантильность и поведенческие проблемы при синдроме Клайнфелтера создают трудности социальной адаптации.
Иногда возможны случаи увеличения количества Y-хромосом: XYY, XXYY и др. При этом больные имеют признаки синдрома Клайнфелтера, высокий рост (в среднем 186 см) и агрессивное поведение. Могут быть аномалии зубов и костной системы. Половые железы развиты нормально. Чем больше в наборе Y-хромосом, тем значительнее снижение интеллекта агрессивность поведения.
Помимо полных трисомий и моносомий известны синдромы, связанные с частичными трисомиями и моносомиями практически по любой хромосоме. Однако, эти синдромы встречаются реже одного случая на 100 000 рождений.
Диагностика НБ. В клинической генетике для диагностики различных форм наследственной патологии применяются: клинико-генеалогический метод, специальные и дополнительные (лабораторные, инструментальные) методы исследования.
Медико-генетическое консультирование. Основная цель медико-генетические консультирования — информировать заинтересованных лиц о вероятности риска появления в потомстве больных. К медико-генетическим мероприятиям относится также пропаганда генетических знаний среди населения, т.к. это способствует более ответственному подходу к деторождению. Медико-генетическая консультация воздерживается от мер принудительного или поощрительного характера в вопросах деторождения или вступления в брак, принимая на себя лишь функцию информации.
Медико-генетическое консультирование (МГК) — это специализированная помощь населению по предупреждению появления в семье больных с наследственной патологией, по выявлению, консультированию больных с НБ, информированию населения о НБ, а также способах его предупреждения и лечения.
Основные задачи МГК:
— установление точного диагноза наследственного заболевания и определение типа наследования заболевания в данной семье;
— составление прогноза рождения ребенка с наследственной болезнью, расчет риска повторения болезни в семье;
— определение наиболее эффективного способа профилактики, помощь семье в принятии правильного решения;
— пропаганда медико-генетических знаний среди врачей, населения.
Показания для МГК:
— задержка физического развития; карликовый рост (не более 140 см для взрослых), врожденные деформация верхних и/или нижних конечностей, пальцев, позвоночника, грудной клетки, черепа, деформация лица, изменение числа пальцев на руках и ногах, синдактилия, комбинации врожденных уродств, врожденная ломкость костей;
— задержка полового развития, неопределенный пол; недоразвитие НПО и вторичных половых признаков;
— задержка умственного развития, умственная отсталость, врожденная глухота или глухонемота;
— повышенное количество стигм дизэмбриогенеза;
— множественные пороки развития или сочетание изолированных пороков и малых аномалий развития;
— атрофия мышц, гипертрофия мышц, спастическое подергивание мышц, насиль-ственные движения, параличи, нетравматическая хромота, нарушение походки, неподвижность или тугоподвижность в суставах;
— слепота, микрофтальм, врожденная катаракта, врожденная глаукома, колобомы, аниридия, нистагм, птоз, прогрессирующее ухудшение сумеречного зрения;
— сухость или усиленное ороговение кожи ладоней и подошв, других участков тела, пятна коричневого цвета и множественные опухоли на коже, спонтанное или индуцированное образование пузырей, отсутствие ногтей, алопеция, непрорезывание зубов;
— хронические прогрессирующие заболевания неясного генеза;
— резкое ухудшение состояния после кратковременного периода нормального развития ребенка. Бессимптомный промежуток может составлять от нескольких часов до недель и зависит от природы дефекта, режима питания и других факторов;
— вялость или, наоборот повышенный тонус и судороги у новорожденного, непрекращающаяся рвота у новорожденного, прогрессирующие неврологические расстройства;
— необычный запах тела и/или мочи («сладкий», «мышиный», «вареной капусты», «потных ног») и др.;
— наличие в семье наследственной патологии, пороков развития, сходные случаи заболевания в семье, случаи внезапной смерти ребенка в раннем возрасте;
— бесплодие, привычное невынашивание, мертворождения;
— кровнородственный брак
Еще до планирования деторождения, а также при рождении больного ребенка (ретроспективно), каждая супружеская пара должна пройти медико-генетическое консультирование.
Этапы МГК:
1. Верификация клинического диагноза наследственного (или предположительно
наследственного).
2. Установление характера наследования заболевания в консультируемой семье.
3. Оценка генетического риска повторения заболевания (генетический прогноз).
4. Определение способов профилактики.
5. Объяснение обратившимся смысла собранной и проанализированной медико-генетическойинформации.
Методы пренаталъной диагностики наследственных болезней. Пренатальная диагностика связана с решением ряда биологических и этических проблем до рождения ребенка, так как при этом речь идет не об излечении болезни, а о предупреждении рождения ребенка с патологией, не поддающейся лечению (обычно путем прерывания беременности с согласия женщины и проведения перинатального консилиума). При современном уровне развития пренатальной диагностики можно установить диагноз всех хромосомных болезней, большинства врожденных пороков развития, энзимопатий, при которых известен биохимический дефект. Часть из них можно установить практически на любом сроке беременности (хромосомные болезни), часть — после 11-12-й недели (редукционные пороки конечностей, атрезии, анэнцефалию), часть — только во второй половине беременности (пороки сердца, почек, ЦНС).
Таблица 1
Схема обследования беременной женщины по оценке состояния внутриутробного развития плода (согласно приказа МЗ РФ №457 от 28.12.2000 г.)
| Вид исследования | Цель исследования |
| Первый этап исследования (10-14 нед. беременности) | |
| УЗИ- обследование всех беременных женщин в женских консультациях Аспирация ворсин хориона (по показаниям): — возраст беременной старше 35 лет — семейное носительство хромосомной аномалии — семейная отягощенность идентифицированным моногенным заболеванием — УЗИ- маркеры (расширенное ТВП) | Установление срока и характера течения беременности. Обязательная оценка толщины воротникового пространства, состояние хориона. Формирование группы риска по хромосомной патологии и по некоторым ВПР у плода. Цитогенетическая диагностика хромосомной патологии, определение пола плода. |
| Второй этап исследования (20-24 нед. беременности) | |
| УЗИ- обследование Доплеровское исследование маточно-плацентарного кровотока. | Детальная оценка анатомии плода с целью обнаружения у него пороков развития, маркеров хромосомных болезней, ранних форм задержки развития плода, патологи плаценты, аномального количества вод. Формирование группы риска по развитию гестоза, задержки развития плода, плацентарной недостаточности в третьем триместре. Формирование группы риска по рождению детей с хромосомными болезнями и некоторыми ВПР. Цитогенетическая диагностика хромосомных болезней у плода. Диагностика конкретной формы моногенного заболевания методами биохимического или ДНК- диагностики по клеткам плода. |
| Третий этап исследования (32-34 нед. беременности) | |
| УЗИ- обследование всех беременных женщин в женских консультациях | Оценка темпов роста плода, выявление ВПР с поздним проявлением. Оценка состояния развития плода. |
Показания для пренатальной диагностики:
— наличие в семье точно установленного наследственного заболевания;
— возраст матери старше 37 лет;
— носительство матерью гена Х-сцепленного рецессивного заболевания;
— наличие в анамнезе у беременных спонтанных абортов в ранние сроки беременности, мертворождений неясного генеза, детей с множественными пороками развития и с хромосомной патологией;
— наличие структурных перестроек хромосом (особенно транслокаций и инверсий) у одного из родителей;
— гетерозиготность обоих родителей по одной паре аллелей при патологии с аутосомно-рецессивным типом наследования;
— беременные из зоны повышенного радиационного фона.
В настоящее время применяются непрямые и прямые методы пренатальной диагностики.
При непрямых методах обследуют беременную (акушерско-гинекологические методы, сыворотка крови на альфа-фетопротеин, ХГЧ. н-эстриол, РАРР-а белок); при прямых — плод.
К прямым неинвазивным (без хирургического вмешательства) методам относится ультрасонография; к прямым инвазивным (с нарушением целостности тканей) — хорионбиопсия, амниоцентез, кордоцентез и фетоскопия.
Ультрасонография (эхография) — это использование ультразвука для получения изображения плода и его оболочек, состояния плаценты. Начиная с 5-й недели беременности можно получить изображение оболочек эмбриона, а с 7-й недели — и его самого. К концу 6-й недели беременности можно зарегистрировать сердечную деятельность эмбриона. В первые два месяца беременности ультразвуковое исследование еще не позволяет выявить аномалии развития плода, но можно определить его жизнеспособность. На 12-20-й неделе беременности уже возможна диагностика близнецовой беременности, локализации плаценты, пороки развития ЦНС, ЖКТ, МПС, костно-суставной системы, ВПС и др. .
По общему мнению, метод безопасен, поэтому продолжительность исследования не ограничена и в случае необходимости его можно применять повторно. При физиологическом течении беременности необходимо проводить трехкратное УЗИ, а при беременности с высоким риском осложнений оно проводится повторно с интервалами в 2 нед.
УЗИ позволяет обнаружить у плода аномалии развития в 85-90 % случаях — анэнцефалию, гидроцефалию, поликистоз или агенезию почек, дисплазию конечностей, гипоплазию легких, множественные врожденные пороки, пороки сердца, водянку (отек) плода и плаценты и др. Ультразвуковое исследование позволяет получить данные о размерах плода (длина туловища, бедра, плеча, бипариетальный диаметр головы), о наличии у него дисморфии, о функции миокарда, об объеме амниотической жидкости и размерах плаценты.
Допплеровское ультразвуковое сканирование (а также цветная допплерометрия) отражает кровообращение в различных тканях плода.
Эхография плаценты позволяет установить ее расположение, наличие отслойки ее отдельных участков, кисты, кальцификаты (признак «старения» плаценты). Истончение или утолщение плаценты свидетельствует о вероятности фетоплацентарной недостаточности.
Широкое распространение получила триада методов исследования: исследование уровня альфа-фетопротеина, содержания хорионического гонадотропина (ХГ) и свободного эстриола в крови женщин во 2-м триместре беременности. Содержание альфа-фетопротеина определяется также в амниотической жидкости, а свободный эстриол — в моче беременных. Отклонения плазматического уровня альфа-фетопротеина, хорионического гонадотропина, свободного эстриола у беременной служат индикаторами высокого риска для плода. Пороговыми (указывающими на высокий риск) считаются уровни альфа-фетопротеина и ХГ в крови беременной, превышающие 2МоМ, а для сниженного уровня альфа-фетопротеина при болезни Дауна пороговая величина менее 0,74 МоМ. Снижение уровня свободного эстриола, соответствующее значению 0,7 МоМ и ниже, также принимается как пороговое, свидетельствующее о фетоплацентарной недостаточности.
Альфа-фетопротеин обнаруживается в амниотической жидкости уже на 6-й неделе беременности (1,5 мкг/мл); наиболее высокая его концентрация наблюдается на 12-14-й неделе (около 30 мкг/мл); затем она резко снижается и на 20-й неделе составляет лишь 10 мкг/л. Хорошие результаты дает определение уровня альфа-фетопротеина в сыворотке крови матери на сроках 16-20 нед. беременности. Его повышение обусловлено поступлением этого белка из сыворотки крови плода через плаценту при некоторых пороках развития.
Все беременные с измененным содержанием альфа-фетопротеина в крови нуждаются в дополнительном обследовании. Содержание альфа-фетопротеина в биологических жидкостях повышено при множественных пороках развития, спинномозговой грыже, гидроцефалии, анэнцефалии, пороках развития желудочно-кишечного тракта и дефектах передней брюшной стенки, гидронефрозе и агенезии почек, а также при фетоплацентарной недостаточности, задержке внутриутробного развития плода, многоплодной беременности, преэклампсии, резус-конфликте и вирусном гепатите В.
В случаях хромосомных болезней у плода (например, болезнь Дауна) или наличия у беременной сахарного диабета I типа, напротив, концентрация альфа-фетопротеина в крови беременных снижена.
Повышение уровня ХГ и его свободных бета-субъединиц более 2 МоМ свидетельствует о задержке внутриутробного развития плода, высоком риске антенатальной гибели плода, отслойке плаценты или о других видах фетоплацентарной недостаточности
В настоящее время исследование сывороточных маркеров проводится в 1-м триместре беременности одновременно определением специфического для беременных белка А. (РАРР-а) и ХГЧ Это позволяет диагностировать болезнь Дауна и некоторые другие хромосомные аномалии у плода уже на 10 — 13-й неделях гестации.
Инвазивные методы диагностики:
Хорионбиопсия — взятие эпителия ворсинок хориона для исследования проводятся трансабдоминально под контролем ультрасонографии между 9-й и 14-й неделями гестации.
Плацентопункция проводится с 15 по 20 нед. беременности.
Полученная ткань используется для цитогенетических и биохимических исследований и анализа ДНК. С помощью этого метода можно выявлять все виды мутаций (генные, хромосомные и геномные). При выявлении каких-либо отклонений в развитии плода и родители решают прервать беременность, то прерывание беременности до 12-й недели.
Амниоцентез — получение амниотической жидкости и клеток плода для последующего анализа. Это исследование стало возможным после того, как была разработана технология трансабдоминального амниоцентеза, проводимого под контролем УЗИ. Получение исследуемого материала (клетки и жидкость) возможно на 16-й неделе беременности. Амниотическая жидкость используется для биохимических исследований (выявляются генные мутации), а клетки — для анализа ДНК (выявляются генные мутации), цитогенетического анализа и выявления Х- и Y-хроматина (диагностируются геномные и хромосомные мутации). Простые биохимические исследования амниотической жидкости могут дать ценную диагностическую информацию — исследования содержания билирубина, эстриола, креатинина, кортизола, 17-оксипрогестерона, соотношения содержания лецитина и сфингомиелина. Диагностика адреногенитального синдрома у эмбриона (недостаточность 21-гидроксилазы) возможна уже на 8-й неделе гестации, когда в амниотической жидкости обнаруживается повышенное содержание 17-гидроксипрогестерона.
Исследование спектра аминокислот амниотической жидкости позволяет выявить некоторые наследственные болезни обмена веществ у плода (аргинин-янтарную ацидурию, цитруллинурию и др.), а определение спектра органических кислот используется для диагностики органических ацидурий (пропионовая, метилмалоновая, изовалериановая ацидурия и др.).
Для распознавания тяжести гемолитической болезни у плода при резус-сенсибилизации беременной производится прямое спектрофотометрическое исследование амниотической жидкости.
Кордоцентез — взятие крови из пуповины плода, клетки и сыворотка которой используются для цитогенетических, молекулярно-генетических и биохимических исследований. Эта процедура проводится в срок с 21-й по 24-ю неделю беременности под контролем УЗИ. Кордоцентез может быть осуществлен также при проведении эмбриофетоскопии. Например, определение вирусоспецифической ДНК или РНК (методом обратной транскрипции) в крови плода имеет решающее значение для диагностики внутриутробных инфекций — ВИЧ, краснухи, цитомегалии, парвовируса В19.
Фетоскопия — осмотр плода фиброоптическим эндоскопом, введенным в амниотическую полость через переднюю стенку матки. Метод позволяет осмотреть плод, пуповину, плаценту и произвести биопсию. Фетоскопия сопровождается высоким риском прерывания беременности и технически сложна, поэтому имеет ограниченное применение.
Современные технологии позволяют осуществлять биопсию кожи, мышц, печени плода для диагностики генодерматозов, мышечных дистрофий, гликогенозов и других тяжелых наследственных заболеваний.
Риск прерывания беременности при применении инвазивных методов пренатальной диагностики составляет 1-2%.
Везикоцентез, или пункция мочевого пузыря плода, используется для получения его мочи для исследования в случаях серьезных заболеваний и пороков развития органов мочевой системы.
Доимплантационная диагностика серьезных наследственных болезней стала возможной в последнее десятилетие благодаря разработке технологии экстракорпорального оплодотворения и использования полимеразной цепной реакции для получения множественных копий эмбриональной ДНК. На стадии дробления оплодотворенной яйцеклетки (бластоцисты), когда зародыш состоит из 6-8 отдельных клеток, методами микроманипуляции отделяется одна из них для выделения ДНК, ее мультипликации и последующего анализа с помощью ДНК-зондов (праймерная полимеразная цепная реакция, Sauthern-blot, исследование полиморфизма рестрикционных фрагментов ДНК и др.). Эта технология применена для выявления наследственных болезней — Тея-Сакса, гемофилии, миодистрофии Дюшенна, фрагильной Х-хромосомы и ряда других. Однако, она доступна немногим крупным центрам и отличается очень высокой стоимостью исследования.
Разрабатываются методы выделения клеток плода (эритробластов, трофобластов и др.), циркулирующих в крови беременной, для проведения цитогенетических, молекулярно-генетических и иммунологических анализов в диагностических целях. Пока такая диагностика возможна лишь в тех случаях, когда в клетках крови (эритробластах) беременной имеются хромосомы или гены плода, например Y-хромосома, ген резус-фактора у резус-отрицательной женщины, антигены системы HLA, унаследованные от отца.
Дальнейшее развитие и распространение методов пренатальной диагностики наследственных заболеваний позволят значительно снизить частоту наследственной патологии новорожденных.
Неонатальный скрининг. В рамках реализуемого Приоритетного национального проекта «Здоровье» предусмотрено расширение неонатального скрининга и сейчас проводится скриниг на фенилкетонурию, врожденный гипотиреоз, адреногенитальный синдром, галактоземию, муковисцидоз. Массовое обследование новорожденных (неонатальный скрининг) на НБО является основой профилактики наследственных болезней в популяциях. Неонатальная диагностика наследственных заболеваний позволяет определить распространенность заболевания на конкретной территории, в конкретном субъекте Российской Федерации и в целом по стране, обеспечить раннее выявление детей, страдающих наследственными заболеваниями и своевременно начать лечение, предупредить инвалидность и развитие тяжелых клинических последствий, снизить детскую смертность от наследственных заболеваний, выявить семьи, нуждающиеся в генетической консультации, с целью предупреждения рождения детей с данными наследственными заболеваниями.
В медико-генетической консультации Перинатального Президентского Центра МЗ СР ЧР проводится неонатальный скрининг, учет всех родившихся и выявленных больных с наследственной патологией. Создан Республиканский регистр наследственных заболеваний, позволяющий прогнозировать динамику генетического груза в популяции и разрабатывать необходимые медико-социальные мероприятия
Структура хромосомных аномалий за 1991-2008 гг.
| № п\п | Нозология | Кол-во | Процент от всей патологии |
| 1 | С. Дауна | 217 | 35,57 |
| 2 | С. Шерешевского — Тернера | 114 | 18,68 |
| 3 | С. Клайнфельтера | 76 | 12,45 |
| 4 | С. Эдвардса | 6 | 0,9 |
| 5 | С. Патау | 4 | 0,65 |
| 6 | Полисомия по У- хромосоме | 4 | 0,65 |
| 7 | Полисомия по Х- хромосоме | 6 | 0,9 |
| 8 | Аномалии по половым хромосомам | 18 | 2,95 |
| 9 | Малые аномалии хромосом | 66 | 10,82 |
| 10 | Хромосомные абберрации | 88 | 14,42 |
| 11 | ХМЛ | 12 | 1,96 |
| ИТОГО | 610 | 100 |
Анализ по годам за последние годы не выявил достоверного роста частоты рождения детей с наследственной патологией в республике, но частота рождения детей с врожденными пороками растет из года в год, особенно ВПС.
Результаты скрининга новорожденных на наследственные болезни обмена в Чувашской Республике за период с 1999-2008 гг.
| Наследственное заболевание обмена веществ | Обследовано новорожденных | Выявлено | Частота заболевания в Чувашской Республике | Частота заболевания в РФ (Новиков П.В., 2008) |
| фенилкетонурия | 117 559 | 18 | 1: 6531 | 1: 7 697 |
| врожденный гипотиреоз | 115 878 | 56 | 1: 2069 | 1: 4 132 |
| муковисцидоз | 43187 | 3 | 1: 14395 | 1: 11 585 |
| адреногенитальный синдром | 43187 | 2 | 1: 21593 | 1: 8 662 |
| галактоземия | 39849 | 1 | 1: 39849 | 1: 32 692 |
Лечение наследственных заболеваний. Несмотря на большие успехи в совершенствовании цитогенетических, биохимических и молекулярных методов изучении этиологии и патогенеза НЗ, по-прежнему, основным остается симптоматическое лечение, которое мало отличается от лечения любых других хронических заболеваний. И все же, в настоящее время в арсенале врачей-генетиков находится немало средств патогенетического лечения; в первую очередь это касается наследственных болезней обмена (НБО). Клинические проявления при НБО являются итогом нарушений в цепи превращений (метаболизма) продуктов (субстратов) в организме человека; мутация гена приводит к дефектной работе ферментов и коферментов. Патогенетическая терапия разработана примерно для 30 НБО. Существует несколько направлений терапии НБО:
1. Диетотерапия. Ограничение или полное прекращение поступления в организм продуктов, метаболизм которых нарушен в результате ферментативного блока. Этот прием используется в случаях, когда избыточное накопление субстрата оказывает токсичное действие на организм. Иногда (особенно когда субстрат не является жизненно необходимым и может синтезироваться в достаточном количестве обходными путями) такая диетотерапия оказывает очень хороший эффект. Типичный пример — галактоземия. Несколько сложнее дело обстоит при фенилкетонурии. Фенилаланин — незаменимая аминокислота, поэтому ее нельзя полностью исключать из пищи, а надо индивидуально подбирать для больного физиологически необходимую дозу фенилаланина. Также диетотерапия разработана для тирозинемии, лейциноза наследственной непереносимости фруктозы, гомоцистинурии и т.д.
2. Восполнение коферментов. При ряде НБО изменяется не количество необходимого фермента, а его структура, в результате чего нарушается связывание с коферментом, наступает метаболический блок. Чаще всего речь идет о витаминах. Дополнительное введение больному коферементов (чаще определенных доз витаминов) дает положительный эффект. В качестве таких «помощников» используют пиридоксин, кобаламин, тиамин, препараты карнитина, фолаты, биотин, рибофлавин и т.д.
3. Усиленное выведение токсических продуктов, накапливающихся в случае блокирования их дальнейшего метаболизма. К числу таких продуктов относится, например, медь при болезни Вильсона-Коновалова (для нейтрализации меди больному вводят D-пеницилламин), железо при гемоглобинопатиях (для предотвращения гемосидероза паренхиматозных органов назначают десферал.
4. Искусственное введение в организм больного продукта блокированной у него реакции. Например, прием цитидиловой кислоты при оротоацидурии (заболевание, при котором страдает синтез пиримидинов) устраняет явления мегалобластической анемии.
5. Воздействие на «испорченные» молекулы. Этот метод применяется для лечения серповидно-клеточной анемии и направлен на уменьшение вероятности образования кристаллов гемоглобина 3. Ацетилсалициловая кислота усиливает ацетилирование HbS и таким путем снижает его гидрофобность, обусловливающую агрегацию этого белка.
6. Возмещение отсутствующего фермента. Такой метод успешно применяется при лечении адрено-генитального синдрома (введение стероидных гормонов с глюко- и минералокортикоидной активностью), гипофизарного нанизма (введение гормона роста), гемофилии (антигемофильный глобулин). Однако, для эффективного лечения необходимо знать все тонкости патогенеза заболевания, его биохимических механизмов. Новые успехи на этом пути свзаны с достижениями физико-химической биологии, генной инженерии и биотехнологии.
7. Блокирование патологической активности ферментов с помощью специфических ингибиторов или конкурентное торможение аналогами субстратов данного фермента. Этот метод лечения применяется при избыточной активации систем свертывания крови, фибринолиза, а также при освобождении из разрушенных клеток лизосомальных ферментов.
Все большее применение в лечении НЗ находит трансплантация клеток, органов и тканей. Тем самым в организм больного вместе с органом или тканью вводится нормальная генетическая информация, обеспечивающая правильные синтез и работу ферментов и предохраняющая организм от последствий произошедшей мутации. Аллотрансплантация используется для лечения: синдромов Ди Джорджи (гипоплазия тимуса и паращитовидных желез) и Незелофа — пересадка тимуса; остеопетроза рецессивного, мукополисахаридозов, болезни Гоше, анемии Фанкони — пересадка костного мозга; первичных кардиомиопатий — пересадка сердца; болезни Фабри, амилоидозе, синдроме Альпорта, наследственного поликистоза почек — пересадка почек и т.д.
Последнее новое направление в лечении наследственных болезней — генотерапия. Данное направление основано на переносе генетического материала в организм человека, и необходимо соблюдение следующих условий: расшифровка гена, вызывающего заболевание, знание биохимических процессов в организме, контролируемых этим геном, успешная доставка гена в клетки-мишени (через системы векторов с использованием вирусов, химических и физических методов) и длительная эффективная работа перенсенного гена в организме.
М.В. Краснов, А.Г. Кириллов, В.М. Краснов, Е.Н. С Аваскина, А.В. Абрукова
Чувашский государственный университет им. И.Н.Ульянова
Президентский перинатальный центр МЗ СР ЧР
Краснов Михаил Васильевич — доктор мед наук, профессор, заведующий кафедрой детских болезней
Литература:
1. Гинтер Е.К. Гинтер Е К., Зинченко Р.А. Наследственные болезни в российских популяциях. Вестник ВОГиС 2006; т. 10: 1: 106-125.
2. Гинтер Е.К. Медицинская генетика: учебник. М. 2003. 448с.
3. Вахарловский В.Г., Романенко О.П., Горбунова В.Н. Генетика в практике педиатра: руководство для врачей. СПб. 2009. 288с.
4. Валивач М.Н., Бугембаева М.Д. Краткий справочник диагностических критериев для врачей, МКБ-10, 2003
5. Зинченко Р.А., Ельчинова Г.И., Козлова СИ. и др. Эпидемиология наследственных болезней в Республике Чувашия. Медицинская генетика 2002; т. 1:1: 24-33
6. Зинченко Р.А, Козлова С.И., Галкина В.А., Гинтер Е.К. Встречаемость изолированной брахидактилии В в Чувашии. Медицинская генетика 2004; т. 3: 11: 533-
7. Зинченко Р.А., Мордовцева В В, Петров А.Н, Гинтер Е.К. Наследственный рецессивный гипотрихоз в республиках Марий Эл и Чувашия. Медицинская генетика 2003: т. 2: 6: 267-272.
8. Козлова С.И., Демикова Н.С. Наследственные синдромы и медико-генетическое консультирование. М., 2007. 448с.
9. Козлова С. И., Демикова Н. С. Наследственные синдромы и медико-генетическое консультирование: атлас-справочник 3-е изд., перераб. и доп. Издательство: Товарищество научных изданий «КМК» Год издания: 2007. 448 с.
10. Пренатальная дианостика наследственных и врожденных болезней. Под редакцией акад. РАМН, проф. Э.К.Фйламазяна, чл.-корр.РАМН, проф. В.С.Баранова. М. 2007. 416с.
11. Петровский В.И. Первая медицинская помощь. Популярная энциклопедия, М., 1994.
12. McKusick V.A. Online Mendelian inheritance in man. Available at http:www.ncbi.nlm.nih.gov/OMIM.
По наследству могут передаваться не только внешние признаки, но и заболевания. Сбои в генах предков приводят, в итоге, к последствиям в потомстве. Мы расскажем о семи самых распространенных генетических заболеваниях.
Наследственные свойства передаются потомкам от предков в виде генов, объединенных в блоки, которые называются хромосомами. Все клетки организма, за исключением половых, имеют двойной набор хромосом, половина которого достается от матери, а вторая часть – от отца. Болезни, чей причиной служат те или иные сбои в генах, являются наследственными.
Близорукость
Или миопия. Генетически обусловленное заболевание, суть которого состоит в том, что изображение формируется не на сетчатке глаза, а перед ней. Самой распространенной причиной такого явления считается увеличенное в длину глазное яблоко. Как правило, близорукость развивается в подростковом возрасте. Человек при этом прекрасно видит вблизи, но плохо видит вдаль.
Если оба родителя близоруки, то риск развития миопии у их детей составляет свыше 50% . Если оба родителя обладают нормальным зрением, то вероятность развития близорукости составляет, не более 10%.
Исследуя близорукость, сотрудники Австралийского национального университета в Канберре пришли к выводу, что миопия присуща 30% представителей европеоидной расы и поражает до 80% уроженцев Азии, включая жителей Китая, Японии, Южной Кореи и т. д. Собрав данные более 45 тыс. человек, ученые идентифицировали 24 гена, связанных с близорукостью, а также подтвердили их связь с двумя ранее установленными генами. Все эти гены отвечают за развитие глаза, его структуру, передачу сигналов в ткани глаза.
Синдром Дауна
Синдром, получивший свое название в честь английского врача Джона Дауна, который впервые описал его в 1866 году, представляет собой одну из форм хромосомной мутации. Синдрому Дауна подвержены все расы.
Болезнь является следствием того, что в клетках присутствуют не два, а три экземпляра 21-й хромосомы. Генетики называют это трисомией. В большинстве случаев лишняя хромосома передается ребенку от матери. Принято считать, что риск рождения ребенка с синдромом Дауна зависит от возраста матери. Однако из-за того, что в целом чаще всего рожают в молодости, 80% всех детей с синдромом Дауна рождены женщинами в возрасте до 30 лет.
В отличие от генных, хромосомные нарушения являются случайным сбоем. И в семье может быть лишь один человек, страдающий подобным заболеванием. Но и здесь случаются исключения: в 3-5% случаев наблюдаются более редкие – транслокационные формы синдрома Дауна, когда у ребенка имеется более сложная структура набора хромосом. Подобный вариант болезни может повторяться в нескольких поколениях одной семьи.
Согласно информации благотворительного фонда «Даунсайд Ап», в России ежегодно рождается порядка 2500 детей с синдромом Дауна.
Синдром Клайнфельтера
Еще одно хромосомное нарушение. Примерно на каждые 500 новорожденных мальчиков приходится один с этой патологией. Синдром Клайнфельтера проявляется, как правило, после полового созревания. Страдающие этим синдромом мужчины бесплодны. Кроме того, им присуща гинекомастия – увеличение грудной железы с гипертрофией желез и жировой ткани.
Синдром получил свое название в честь американского врача Гарри Клайнфельтера, впервые описавшего клиническую картину патологии в 1942 году. Совместно с эндокринологом Фуллером Олбрайтом он выяснил, что если в норме женщины имеют пару половых хромосом ХХ, а мужчины – ХУ, то при данном синдроме у мужчин присутствует от одной до трех дополнительных Х-хромосом.
Дальтонизм
Или цветовая слепота. Носит наследственный, гораздо реже приобретенный характер. Выражается в неспособности различать один либо несколько цветов.
Дальтонизм связан с X-хромосомой и передается от матери, обладательницы «поломанного» гена к сыну. Соответственно, дальтонизмом страдают до 8% мужчин и не более 0,4% женщин. Дело в том, что у мужчин «брак» в единственной X-хромосоме не компенсируется, поскольку второй X-хромосомы, в отличие от женщин, у них нет.
Гемофилия
Еще одна болезнь, наследуемая сыновьями от матерей. Широко известна история потомков английской королевы Виктории из династии Виндзоров. Ни она сама, ни ее родители не страдали этим тяжелым заболеванием, связанным с нарушением свертывания крови. Предположительно, мутация гена произошла спонтанно, из-за того, что отцу Виктории на момент ее зачатия было уже 52 года.
От Виктории «роковой» ген унаследовали дети. Ее сын Леопольд умер из-за гемофилии в 30 лет, а две из ее пяти дочерей, Алиса и Беатриса, были носителями злосчастного гена. Одним из самых известных потомков Виктории, страдавших гемофилией, является сын ее внучки, царевич Алексей, единственный сын последнего российского императора Николая II.
Муковисцидоз
Наследственное заболевание, которое проявляется в нарушении работы желез внешней секреции. Оно характеризуется повышенным потоотделением, выделением слизи, которая накапливается в организме и мешает ребенку развиваться, а, главное, препятствует полноценной работе легких. Вероятен летальный исход из-за дыхательной недостаточности.
Согласно данным российского филиала американской химико- фармацевтической корпорации Abbott, средняя продолжительность жизни больных муковисцидозом составляет в европейских странах 40 лет, в Канаде и США – 48 лет, в России – 30 лет. Из известных примеров стоит привести французского певца Грегори Лемаршаля, умершего в 23 года. Предположительно, муковисцидозом страдал и Фредерик Шопен, скончавшийся в результате отказа легких в возрасте 39 лет.
Заболевание, упоминаемое в древнеегипетских папирусах. Характерный симптом мигрени – эпизодические или регулярные сильные приступы головной боли в одной половине головы. Римский врач греческого происхождения Гален, живший во II веке, назвал болезнь гемикранией, что переводится как «половина головы». От этого термина и произошло слово «мигрень». В 90-х гг. ХХ века было установлено, что мигрень преимущественно обусловлена генетическими факторами. Был открыт ряд генов, ответственных за передачу мигрени по наследству.
Согласно данным, представленным Всемирной организацией здравоохранения, около 6% детей рождаются с различными отклонениями развития, обусловленными генетически. Этот показатель учитывает и те патологии, которые проявляются не сразу, а по мере взросления малышей. В современном мире процент наследственных заболеваний с каждым годом увеличивается, что привлекает внимание и сильно беспокоит специалистов всего мира.
Учитывая роль генетических факторов, наследственные заболевания человека можно разделить на следующие три группы:
1. Заболевания, развитие которых обусловлено только наличием мутированного гена
Такие патологии передаются от поколения к поколению. К их числу можно отнести шестипалость, близорукость, мышечную дистрофию.
2. Заболевания с генетической предрасположенностью
Для их развития необходимо воздействие дополнительных внешних факторов. Например, определенный природный компонент в составе продукта может вызвать серьезную аллергическую реакцию, а черепно-мозговая травма привести к появлению эпилепсии.
3. Заболевания, вызываемые влиянием инфекционных агентов или травмами, но не имеющие установленной специалистами связи с генетическими мутациями
В данном случае наследственность все же играет определенную роль. Например, в некоторых семьях дети очень часто страдают простудой, а в других, даже при близком контакте с инфекционными больными, остаются здоровыми. Исследователи полагают, что наследственные особенности организма также обуславливают многообразие видов и форм протекания различных заболеваний.
Причины наследственных болезней
Основная причина любого наследственного заболевания — мутация, то есть стойкое изменение генотипа. Мутации наследственного материала человека различны, их делят на несколько типов:
— Генные мутации представляют собой структурные изменения участков ДНК — макромолекулы, обеспечивающей хранение, передачу и реализацию генетической программы развития человеческого организма. Такие изменения становятся опасными в случае, когда приводят к образованию белков с несвойственными им характеристиками. Как известно, белки являются основой всех тканей и органов тела человека. Многие генетические заболевания развиваются вследствие мутаций. Например, муковисцидоз, гипотериоз, гемофилия и другие.
— Геномные и хромосомные мутации — это качественные и количественные изменения хромосом — структурных элементов клеточных ядер, обеспечивающих передачу наследственной информации от поколения к поколению. Если преобразования происходят лишь в их строении, то нарушения основных функций организма и поведения человека могут оказаться не столь выраженными. Когда изменения касаются и количества хромосом, развиваются очень тяжелые заболевания.
— Мутации половых либо соматических (не участвующих в половом размножении) клеток . В первом случае плод уже на стадии оплодотворения приобретает генетически обусловленные отклонения развития, а во втором лишь некоторые участки тканей организма остаются здоровыми.
Специалисты выделяют целый ряд факторов, которые могут провоцировать мутации наследственного материала, а в дальнейшем — рождение ребенка с генетическими отклонениями. К их числу относятся следующие:
— Родственная связь между отцом и матерью будущего малыша
В этом случае риск того, что родители окажутся носителями генов с идентичными повреждениями, возрастает. Подобные обстоятельства исключат шансы малыша на приобретение здорового фенотипа.
— Возраст будущих родителей
С течением времени в половых клетках проявляется все большее количество генетических повреждений, хоть и весьма незначительных. В результате риск рождения ребенка с наследственной аномалией увеличивается.
— Принадлежность отца или матери к определенной этнической группе
Например, часто у представителей ашкеназских евреев встречается болезнь Гоше, а у средиземноморских народов и армян — болезнь Вильсона.
— Воздействие на организм одного из родителей облучением , сильнодействующим ядовитым веществом или лекарственным средством.
— Нездоровый образ жизни
Структура хромосом подвержена влиянию внешних факторов на протяжении всей жизни человека. Вредные привычки, плохое питание, серьезные стрессы и многие другие причины способны приводить к «поломкам» генов.
Если, планируя беременность, вы желаете исключить генетические заболевания будущего малыша, обязательно пройдите обследование. Сделав это как можно раньше, родители получают дополнительный шанс подарить своему ребенку хорошее здоровье.
Диагностика генетических нарушений
Современная медицина способна выявить наличие наследственного заболевания на стадии развития плода и с большой вероятностью предсказать возможные генетические нарушения в период планирования беременности. Выделяют несколько методов диагностики:
1. Биохимический анализ периферической крови
и иных биологических жидкостей в организме матери
Он позволяет выявить группу генетически обусловленных заболеваний, связанных с нарушениями обменных процессов.
2. Цитогенетический анализ
Данный метод основан на анализе внутренней структуры и взаимного расположения хромосом внутри клетки. Его более совершенным аналогом является молекулярно-цитогенетический анализ, позволяющий обнаруживать малейшие изменения в строении важнейших элементов клеточного ядра.
3. Синдромологический анализ
Предполагает выделение ряда признаков из всего многообразия, свойственных конкретному генетическому заболеванию. Это осуществляется методом тщательного осмотра пациента и посредством использования специальным компьютеризированных программ.
4. Ультразвуковое исследование плода
Обнаруживает некоторые хромосомные болезни.
5. Молекулярно-генетический анализ
Определяет даже самые незначительные изменения в структуре ДНК. Позволяет диагностировать моногенные заболевания и мутации.
Важно своевременно определить наличие или вероятность наследственных заболеваний у будущего малыша. Это позволит принять меры на ранних стадиях развития плода и заранее предусмотреть возможности для минимизации неблагоприятных последствий.
Методы лечения наследственных заболеваний
До недавнего времени генетические заболевания практически не лечились в силу того, что это считалось бесперспективным. Предполагалось их необратимое развитие и отсутствие положительного результата в ходе медикаментозного и хирургического вмешательства. Однако специалисты существенно продвинулись в поисках новых эффективных способов лечения наследственных патологий.
На сегодняшний день можно назвать три основных метода:
1. Симптоматический метод
Направлен на устранение болезненных симптомов и замедление прогресса заболевания. К данной методике можно отнести использование анальгетиков при болевых ощущениях, применение ноотропных препаратов при деменции и подобное.
2. Патогенетическая терапия
Предполагает устранение дефектов, вызванных мутированным геном. К примеру, если он не производит определенный белок, то данный компонент искусственно вводят в организм.
3. Этиологический метод
Основан на генной коррекции: выделении поврежденного участка ДНК, его клонировании и дальнейшем применении в лечебных целях.
Современная медицина успешно лечит десятки наследственных заболеваний, однако говорить о достижении абсолютных результатов пока нельзя. Специалисты рекомендуют своевременно проводить диагностику и в случае необходимости принимать меры для снижения возможных генетических нарушений вашего будущего ребенка.