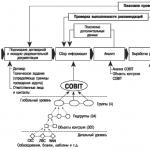
Analüüs (keemiline, füüsikalis-keemiline, füüsikaline ja bioloogiline).
Nõuded reaktsioonidele kvantitatiivses analüüsis. Roll
Ja kvantitatiivse analüüsi tähtsus farmaatsias
Kvantitatiivne analüüs- analüütilise keemia meetodite kogum elementide (ioonide), radikaalide, funktsionaalrühmade, ühendite või faaside hulga (sisalduse) määramiseks analüüsitavas objektis.
Kvantitatiivse analüüsi eesmärgid
Kvantitatiivne analüüs võimaldab teil määrata uuritava objekti elementaar- ja molekulaarkoostise või selle üksikute komponentide sisalduse.
Sõltuvalt uurimisobjektist eristatakse anorgaanilist ja orgaanilist analüüsi. Need jagunevad omakorda elementaaranalüüsiks, mille ülesandeks on teha kindlaks, kui palju elemente (ioone) analüüsitavas objektis sisaldub, molekulaar- ja funktsionaalanalüüsideks, mis annavad vastuse radikaalide, ühendite kvantitatiivse sisalduse kohta. samuti aatomite funktsionaalsed rühmad analüüsitavas objektis.
Koos kvalitatiivse analüüsiga Kvantitatiivne analüüs on analüütilise keemia üks peamisi harusid. Analüüsiks võetud aine koguse järgi eristatakse makro-, poolmikro-, mikro- ja ultramikromeetodeid Kvantitatiivne analüüs Makromeetodites on proovi mass tavaliselt >100 mg, lahuse maht > 10 ml; ultramikromeetodites - vastavalt 1-10 -1 mg ja 10 -3 -10 -6 ml. Sõltuvalt uurimisobjektist eristatakse anorgaanilist ja orgaanilist. Kvantitatiivne analüüs, mis jaguneb omakorda elementaar-, funktsionaalseks ja molekulaaranalüüsiks. elementaaranalüüs võimaldab määrata elementide (ioonide) sisu, funktsionaalne analüüs - funktsionaalsete (reaktiivsete) aatomite ja rühmade sisaldus analüüsitavas objektis. Molekulaarne Kvantitatiivne analüüs hõlmab üksikute keemiliste ühendite analüüsi, mida iseloomustab teatud molekulmass. Suur tähtsus on nn faasianalüüsil - meetodite kogum heterogeensete süsteemide üksikute struktuursete (faaside) komponentide eraldamiseks ja analüüsimiseks. Lisaks spetsiifilisusele ja tundlikkusele on meetodite oluline omadus Kvantitatiivne analüüs- täpsus, st suhtelise määramisvea väärtus; täpsus ja tundlikkus sisse Kvantitatiivne analüüs väljendatud protsentides.
Klassikaliste keemiliste meetodite juurde Kvantitatiivne analüüs seotud: gravimeetriline analüüs, põhineb analüüdi massi täpsel mõõtmisel ja mahuline analüüs. Viimase alla kuuluvad mahutitrimeetriline analüüs - meetodid reaktsioonis analüüdiga kulunud reaktiivi lahuse mahu mõõtmiseks ja gaasimahu analüüs - analüüsitud gaasiliste saaduste mahu mõõtmise meetodid.
Klassikaliste keemiliste meetodite kõrval on laialt levinud füüsikalised ja füüsikalis-keemilised (instrumentaalsed) meetodid. Kvantitatiivne analüüs põhineb analüüsitavate ainete optiliste, elektriliste, adsorptsiooni, katalüütiliste ja muude omaduste mõõtmisel, sõltuvalt nende kogusest (kontsentratsioonist). Tavaliselt jagunevad need meetodid järgmistesse rühmadesse: elektrokeemilised (konduktomeetria, polarograafia, potentsiomeetria jne); spektraalne või optiline (emissiooni- ja neeldumisspektraalanalüüs, fotomeetria, kolorimeetria, nefelomeetria, luminestsentsanalüüs jne); Röntgenikiirgus (absorptsioon- ja emissioonröntgenspektraalanalüüs, röntgenifaasi analüüs jne); kromatograafiline (vedelik, gaas, gaas-vedelik kromatograafia jne); radiomeetriline (aktivatsioonianalüüs jne); massispektromeetriline. Loetletud meetodid, mis on täpsuselt madalamad kui keemilised, ületavad neid oluliselt tundlikkuse, selektiivsuse ja täitmise kiiruse poolest. Keemiliste meetodite täpsus Kvantitatiivne analüüs on tavaliselt vahemikus 0,005-0,1%; instrumentaalsete meetoditega määramise vead on 5-10% ja mõnikord palju rohkem.
KVANTITATIIVSE KEEMILISE ANALÜÜSI KEEMILISED MEETODID
Kvantitatiivse keemilise analüüsi keemilised meetodid põhinevad keemilise reaktsiooni läbiviimise põhimõttel analüüsitava proovi määratud komponendiga.
Keemilise analüüsi keemilised meetodid jagunevad titrimeetrilisteks, gravimeetrilisteks ja mahulisteks meetoditeks.
1) titrimeetriameetodid:
Titrimeetriline analüüs (tiitrimine) - analüütilise ja farmatseutilise keemia kvantitatiivse analüüsi meetodid, mis põhinevad täpselt teadaoleva kontsentratsiooniga reaktiivilahuse mahu mõõtmisel, mis kulub reaktsiooniks määratava ainega. Tiitrimine on analüüdi tiitri määramise protsess. Tiitrimine viiakse läbi büreti abil, mis on täidetud tiitriga nullini. Teistest märkidest alustades tiitrimist ei soovitata, kuna büreti skaala võib olla ebaühtlane. Büretid täidetakse töölahusega läbi lehtri või spetsiaalsete seadmete abil, kui bürett on poolautomaatne. Tiitrimise lõpp-punkt (ekvivalentsuspunkt) määratakse indikaatorite või füüsikalis-keemiliste meetoditega (elektrijuhtivuse, valguse läbilaskvuse, indikaatorelektroodi potentsiaali jms järgi). Analüüsi tulemused arvutatakse tiitrimiseks kasutatud töölahuse koguse järgi.
Analüütiline keemia tegeleb ainete koostise määramise eksperimentaalsete meetodite uurimisega. Ainete koostise määramine hõlmab uuritavat ainet moodustavate komponentide olemuse kindlakstegemist ja nende komponentide kvantitatiivsete vahekordade kindlaksmääramist.
Esiteks tehakse kindlaks uuritava objekti kvalitatiivne koostis, s.o. lahendada küsimus, millest see koosneb, ja seejärel asuda määrama kvantitatiivset koostist, st. välja selgitada, millistes kvantitatiivsetes suhetes on leitud komponendid uurimisobjektis.
Kvalitatiivne analüüs aineid saab läbi viia keemiliste, füüsikaliste, füüsikalis-keemiliste meetoditega.
Keemilised analüüsimeetodid põhinevad iseloomulike keemiliste reaktsioonide kasutamisel analüüdi koostise määramiseks.
Aine keemiline analüüs viiakse läbi kahel viisil: "kuival viisil" või "märjal teel". Kuiv analüüs- need on keemilised reaktsioonid, mis toimuvad ainetega hõõgumise, sulandumise ja leekvärvimise ajal.
Märganalüüs on keemilised reaktsioonid, mis toimuvad elektrolüütide lahustes. Analüüt lahustatakse eelnevalt vees või muudes lahustites. Sõltuvalt analüüsiks võetud aine massist või mahust eristatakse kasutatavast tehnikast makro-, poolmikro- ja mikromeetodeid.
makromeetod. Analüüsiks võtta 1-2 ml lahust, mis sisaldab vähemalt 0,1 g ainet, ja lisada vähemalt 1 ml reaktiivilahust. Reaktsioonid viiakse läbi katseklaasis, sade eraldatakse filtrimisega. Filtril olev sade pestakse lisanditest.
Poolmikromeetod. Analüüsiks võetakse 10-20 korda vähem ainet (kuni 0,01 g). Kuna see meetod töötab väikese koguse ainega, kasutatakse mikrokatseklaase, kella või klaasklaase. Sademe lahusest eraldamiseks kasutatakse tsentrifuugimist.
Mikromeetod. Selle meetodiga analüüsimisel võetakse üks või kaks tilka lahust ja kuivaine on 0,001 g piires. Tüüpilised reaktsioonid viiakse läbi kellaklaasil või portselanplaadil.
Analüüsi läbiviimisel kasutatakse järgmisi toiminguid: kuumutamine ja aurustamine, sadestamine, tsentrifuugimine, sadestumise täielikkuse kontrollimine, lahuse (tsentrifuug) eraldamine sademest, pesemine ja sademe lahustamine.
Küte lahuseid saab läbi viia otse gaasipõleti leegiga, asbestvõrgule või veevannile. Väike kogus lahust kuumutatakse veevannis temperatuurini mitte üle 100 ° C, kus vesi peaks keema ühtlaselt.
Sest kontsentratsioon lahuseid kasutatakse veevannis. Aurustumine kuiva jäägi lahustamine viiakse läbi portselanist tassides või tiiglites, kuumutades neid asbestivõres. Kui pärast aurustamist tuleb kuiv jääk lenduvate soolade eemaldamiseks kaltsineerida, siis asetatakse tiigel portselanist kolmnurgale ja kuumutatakse gaasipõleti leegiga.
Sademed. Sadestamisreaktsioon viiakse läbi koonilistes kolbides või silindrilistes katseklaasides. Uuritavale lahusele lisatakse pipetiga sadestav aine. Sadeainet võetakse liias. Segu segatakse klaaspulgaga põhjalikult ja hõõrutakse vastu katseklaasi siseseinu, see kiirendab setete moodustumist. Sadestamine toimub sageli kuumadest lahustest.
Tsentrifuugimine. Sade eraldatakse lahusest tsentrifuugimise teel käsitsi või elektrilise tsentrifuugi abil. Katseklaas lahuse ja setetega asetatakse hülsi. Tsentrifuugi tuleb laadida ühtlaselt. Kiire pöörlemise korral paiskab tsentrifugaaljõud setteosakesed põhja ja tihendab selle ning lahus (tsentrifuug) muutub läbipaistvaks. Pöörlemisaeg on 30 sekundist mitme minutini.
Sedimentatsiooni täielikkuse kontrollimine. Katseklaas eemaldatakse ettevaatlikult tsentrifuugist ja läbipaistvale lahusele lisatakse mööda seina 1-2 tilka sadet. Kui lahus ei muutu häguseks, on sadestumine lõppenud. Kui täheldatakse lahuse hägusust, lisatakse katseklaasi sade, sisu segatakse, kuumutatakse ja tsentrifuugitakse uuesti, seejärel korratakse sadenemise täielikkuse kontrolli.
Lahuse (tsentrifuugi) eraldamine sademest. Olles veendunud, et sadenemine on lõppenud, eraldatakse lahus sademest. Lahus eraldatakse sadest tilkpipetiga. Pipett suletakse nimetissõrmega ja eemaldatakse ettevaatlikult katseklaasist. Kui valitud lahust on analüüsiks vaja, kantakse see puhtasse katseklaasi. Täielikuks eraldamiseks korratakse toimingut mitu korda. Tsentrifuugimise ajal võib sade tihedalt tuubi põhja settida, seejärel eraldatakse lahus dekanteerimisega (hoolsalt kurnatakse).
Settepesu. Sette (kui seda uuritakse) tuleb hästi pesta; selleks lisatakse pesuvedelikku, enamasti destilleeritud vett. Sisu segatakse põhjalikult klaaspulgaga ja tsentrifuugitakse, seejärel eraldatakse pesuvedelik. Mõnikord korratakse seda toimingut töös 2-3 korda.
Setete lahustumine. Sademe lahustamiseks lisage klaaspulgaga segades lahusti katseklaasi. Sageli lahustatakse sade veevannis kuumutamisel.
Määramiseks kvantitatiivne koostis ainet või toodet kasutatakse neutraliseerimise, sadestamise, oksüdatsiooni - redutseerimise, kompleksi moodustumise reaktsioonid. Aine kogust saab määrata selle massi või sellega interaktsioonile kulunud lahuse mahu, aga ka lahuse murdumisnäitaja, elektrijuhtivuse või värvuse intensiivsuse jms järgi.
Uuringuks võetud aine koguse järgi liigitatakse kvantitatiivse analüüsi analüütilised meetodid järgmiselt: makroanalüüs - 1-10 g tahket ainet, 10-100 ml analüüsitavat lahust; poolmikroanalüüs - 0,05-0,5 tahket ainet, 1-10 ml analüüsitavat lahust; mikroanalüüs - 0,001-1-10 - 4 g tahket ainet, 0,1-1 * 10 - 4 ml analüüsitavat lahust. Kaubapraktikas kasutatakse sageli gravimeetrilisi (massi) ja titrimeetrilisi (mahumõõtmisi) meetodeid.
Gravimeetriline (kaalu) analüüs- üks kvantitatiivse analüüsi meetoditest, mis võimaldab massi mõõtmise teel määrata analüüdi koostist. Massi mõõtmine (kaalumine) viiakse läbi analüütilisel kaalul täpsusega 0,0002 g Seda meetodit kasutatakse sageli toidulaborites niiskuse, tuhasisalduse, üksikute elementide või ühendite sisalduse määramiseks. Analüüsi saab teha ühel järgmistest viisidest.
1. Määratav komponent eraldatakse uuritavast ainest kvantitatiivselt (võimalikult täielikult) ja kaalutakse. Nii määratakse toodete tuhasisaldus. Analüütilisel kaalul kaalutud esialgne toode põletatakse, saadud tuhk viiakse konstantse massini (kaltsineeritakse, kuni mass lakkab muutumast) ja kaalutakse.
Toote tuhasisaldus x (%) arvutatakse valemiga
kus B on kaltsineeritud tuha mass, g;
A – toote esialgne näidis, g.
2. Analüüsitav komponent eemaldatakse algaine proovist täielikult ja jääk kaalutakse. Nii määratakse toodete niiskusesisaldus, samal ajal kui lähteaine proov kuivatatakse ahjus konstantse massini.
Toote niiskus x (%) arvutatakse valemiga
![]()
kus A on toote esialgne proov, g;
B on proovi kaal pärast kuivatamist, g.
Mahuline analüüs- kvantitatiivse analüüsi meetod, kus soovitud aine määratakse täpselt teadaoleva kontsentratsiooniga reaktiivi mahu järgi, mis kulub selle ainega reageerimiseks.
Mahumeetrilisel meetodil määramisel lisatakse täpselt teadaoleva kontsentratsiooniga reaktiivi väikeste portsjonitena (tilkhaaval) teadaolevale mahule analüüdi lahusele, kuni selle kogus on võrdne analüüdi kogusega. Täpselt teadaoleva kontsentratsiooniga reaktiivilahust nimetatakse tiitritud, töö- või standardlahuseks.
Tiitritud lahuse aeglast lisamist analüüdi lahusele nimetatakse tiitrimiseks. Momenti, mil tiitritava lahuse kogus on võrdne analüüdi kogusega, nimetatakse ekvivalentpunktiks või tiitrimise teoreetiliseks lõpp-punktiks. Ekvivalentsuspunkti määramiseks kasutatakse indikaatoreid, mis läbivad selle lähedal nähtavaid muutusi, mis väljenduvad lahuse värvuse muutumises, hägususe või sademete ilmnemises.
Olulisemad tingimused mahuanalüütiliste määramiste korrektseks läbiviimiseks: 1) lahuste mahtude täpse mõõtmise oskus; 2) täpselt teadaoleva kontsentratsiooniga standardlahuste olemasolu; 3) reaktsiooni lõppemise hetke täpse määramise oskus (näitaja õige valik).
Sõltuvalt sellest, millisel reaktsioonil määratlus põhineb, eristatakse järgmisi mahumeetodite tüüpe:
neutraliseerimise meetod
· oksüdatsiooni-redutseerimise meetod
sadestamise ja kompleksi moodustamise meetod.
Keskmiselt neutraliseerimise meetod seisneb H + ja OH - ioonide vastastikmõjus. Meetodit kasutatakse hapete, aluste ja soolade (mis reageerivad hapete või alustega) määramiseks lahuses. Hapete määramiseks kasutatakse leeliste KOH või NaOH tiitritud lahuseid, aluste määramiseks hapete HC1, H 2 SO 4 lahuseid.
Näiteks happe sisalduse määramiseks lahuses tiitritakse indikaatori juuresolekul pipetiga täpselt mõõdetud happelahuse maht täpselt teadaoleva kontsentratsiooniga leeliselahusega. Samaväärsuse punkti määrab indikaatori värvi muutus. Vastavalt tiitrimisel kasutatud leelise mahule arvutatakse happesisaldus lahuses.
meetod oksüdatsioon - redutseerimine põhineb standardlahuse ja analüüdi vahel toimuvatel redoksreaktsioonidel. Kui standardlahus sisaldab oksüdeerijat (redutseerijat), siis analüüt peab sisaldama vastavat redutseerijat (oksüdeerijat). Redoksmeetod jaguneb olenevalt kasutatavast standardlahusest permanganatomeetriameetodiks, jodomeetriameetodiks jne.
Meetodi keskmes ladestumine on reaktsioonid, millega kaasneb sade. Erinevalt gravimeetrilisest meetodist siin setet ei töödelda, uuritava aine massi määrab sadestamisreaktsioonis kulunud reaktiivi maht.
Anorgaaniliste ainete kvalitatiivne analüüs. Kvalitatiivse analüüsi aine ja ülesanded. Põhimõisted.
Kvalitatiivne analüüs on uuritava süsteemi komponentide avastamine või avastamine.
Kvalitatiivse analüüsi eesmärk on määratleda; aine elementaarne või isotoopne koostis. Orgaaniliste ühendite analüüsimisel leitakse otseselt üksikud keemilised elemendid, nagu süsinik, väävel, fosfor, lämmastik või funktsionaalsed rühmad. Anorgaaniliste ühendite analüüsimisel tehakse kindlaks, millised ioonid, molekulid, aatomirühmad, keemilised elemendid moodustavad analüüsitava aine.
Kvalitatiivse analüüsi meetodite klassifikatsioon. Analüütiline signaal
Sõltuvalt analüüsis kasutatud proovi kogusest on:
Makroanalüüs (kaal - üle 100 mg, lahuse maht - 10-100 ml)
Poolmikroanalüüs (kaal - 10-100 mg, lahuse maht - 1-10 ml)
Mikroanalüüs (kaal - 1-10 mg, lahuse maht - 0,01-1 ml)
Submikroanalüüs (kaal - 0,1-1 mg, lahuse maht - 0,001-0,01 ml)
Ultramikroanalüüs (kaal - alla 0,1 mg, lahuse maht - alla 0,001 ml)
Kui on vaja mõnda komponenti tuvastada, siis tavaliselt on
fikseerige analüütilise signaali välimus - sademe välimus, värvus jne. Analüütilise signaali välimus peab olema usaldusväärne
fikseeritud. Komponendi koguse määramisel mõõdetakse väärtust
analüütiline signaal - sette mass jne.
Murd- ja süstemaatiline analüüs. rühma reaktiiv.
Fraktsioonianalüüs – ioonide tuvastamine, kasutades spetsiifilisi reaktsioone uuritava lahuse üksikutes osades, viiakse läbi mis tahes järjestuses.
Süstemaatiline analüüs – spetsiifiline reaktsioonide jada, milles iga ioon tuvastatakse pärast kõigi segavate ioonide eemaldamist.
Süstemaatilise analüüsi käigus eraldatakse ioonid komplekssegust tervete rühmadena, kasutades mõne reaktiivi suhtes sama vahekorda.
Reaktiive, mis võimaldavad eraldada ioonide rühma keerulisest segust, nimetatakse rühmareaktiivideks.
Nõuded:
* peab ioonid peaaegu täielikult sadestama
* edasiseks uurimiseks peaks tekkiv sade olema leelistes või hapetes kergesti lahustuv.
* selle liig ei tohiks segada lahusesse jäänud ioonide tuvastamist.
Katioonide klassifitseerimine analüütilistesse rühmadesse.
Vesiniksulfiid (sulfiidammoniaak)
1 – Na+, K+, Pb+, Cs+, Fr+, NH4+, Mg+, (rühma reaktiiv – ei)
2 - Ca + 2, Sr + 2, Ba + 2, Ra + 2, (rühma reaktiiv - (NH 4) 2 CO 3, pH = 8-9)
3.1 - Fe (II ja III), Mn + 2, Zn + 2, Co + 2, Ni + 2, (rühma reaktiiv - (NH 4) 2 S, pH = 8-9) (sadestatud sulfiididena)
3,2 - Al + 3, Cr + 3, Ti + 4, Be + 2 (rühma reaktiiv - (NH 4) 2 S, pH = 8-9) (sadestatud hüdroksiidide kujul)
4.1 - Cu + 2, Hg + 2, Bi + 3, Cd + 2, (rühma reaktiiv - H 2 S) (ei lahustu (NH 4) 2 S-s)
4,2 - Sn + 2, Sn + 4, Sb + 3, Sb + 5, As + 3, As + 5, (rühma reaktiiv - HCl, pH = 0,5)
5 – Ag+, Bb+2, Hg+4 (rühma reaktiiv – HCl)
Anioonide klassifitseerimine analüütilistesse rühmadesse.
1.1 (HCl-s ei lahustu) - SO 4 -2, rühmareagent - BaCl.
1,2 (lahustunud HCl-s) - SO 3 -2, S2O3 -2, CO 3 -2, SiO 3 -2, PO 4 -3 rühma reaktiiv - BaCl.
2 - I-, Cl-, S, Br-, rühmareagent - AgNO 3.
3 - NO 3 -, CH 3 COO- rühma reaktiiv - nr.
Kvantitatiivse analüüsi õppeaine ja ülesanded. Kvantitatiivse keemilise analüüsi meetodite klassifikatsioon.
Kvantitatiivne analüüs – määrab komponentide kvantitatiivse sisu uuritavas süsteemis.
Kvantitatiivse keemilise analüüsi meetodid määravad kindlaks uuritava aine koostisosade kvantitatiivsed suhted. Kvantitatiivsete meetoditega saab määrata keemilise elemendi või muu komponendi ühendi sisalduses, sulamis, segus, lahuses. Lisaks võimaldavad kvantitatiivsed meetodid määrata söötme aatom-, ekvivalent- ja molekulmassi, tasakaalukonstante, lahustuvusprodukte, happesust või aluselisust.
Gravimeetrilised (kaalu) meetodid – sete isoleeritakse ja kaalutakse.
Titrimeetrilised (mahulised) meetodid - reaktsiooniks vajaliku V standardlahuse mõõtmine.
Gas volumetric – reaktsiooni käigus vabaneva gaasi V mõõtmine.
Kvantitatiivse analüüsi ülesanne on määrata kvantitatiivne
Kõik kvantitatiivse analüüsi meetodid jagunevad keemilisteks, füüsikalis-keemilisteks ja füüsikalisteks. Keemiliste meetodite hulka kuuluvad gravimeetrilised, titrimeetrilised ja gaasianalüüsid, füüsikalis-keemilised meetodid fotomeetria, elektrokeemilised ja kromatograafilised analüüsid ning füüsikalised meetodid spektraalanalüüs ja luminestsentsanalüüs.
1. Gravimeetriline analüüs põhineb puhtal kujul või teadaoleva koostisega ühendi kujul eraldatud aine massi määramisel. Näiteks baariumi koguse määramiseks selle ühendites sadestatakse Ba 2+ ioon lahjendatud väävelhappega. BaS04 sade filtritakse, pestakse, kaltsineeritakse ja kaalutakse täpselt. Arvutage sademe BaSO 4 massi ja selle valemi järgi, kui palju see sisaldab
baarium. Gravimeetriline meetod annab suure täpsusega tulemusi, kuid see on väga töömahukas.
2. Titrimeetriline analüüs põhineb reaktiivi mahu täpsel mõõtmisel,
kulutatud reaktsioonile teatud komponendiga. Reaktiiv võetakse teatud kontsentratsiooniga lahuse kujul - tiitritud (standard) lahus. Moment, mil lisatakse reaktiivi koguses, mis on võrdne analüüdi sisaldusega, s.o. reaktsiooni lõpp määratakse mitmel viisil. Tiitrimise ajal valatakse reaktiivi koguses, mis on võrdne uuritava aine kogusega. Teades määratava ainega reageerinud lahuse mahtu ja täpset kontsentratsiooni, arvutatakse selle kogus.
Titrimeetriline analüüs annab vähem täpseid tulemusi kui gravimeetriline analüüs, kuid selle oluliseks eeliseks on analüüsi suur kiirus. Sõltuvalt tiitrimisel toimuvate reaktsioonide tüübist hõlmab titrimeetriline analüüs happe-aluse tiitrimise meetodeid, oksüdomeetrilisi meetodeid ning sadestamise ja kompleksi moodustamise meetodeid.
3. Fotomeetria meetodid põhinevad lahuse valguse neeldumise, ülekande ja hajumise mõõtmisel. Enamiku fotomeetriliste meetodite puhul kasutatakse nn värvireaktsioone, s.o. keemilised reaktsioonid, millega kaasneb lahuse värvuse muutus. Nimetatakse meetodit, mis põhineb aine sisalduse määramisel värvuse intensiivsuse järgi kolorimeetria. Lahuse värviintensiivsust hinnatakse visuaalselt või vastavate instrumentide abil.
Mõnikord muudetakse määratav komponent vähelahustuvaks ühendiks ja selle sisaldust hinnatakse lahuse hägususe intensiivsuse järgi. Sellel põhimõttel põhinevat meetodit nimetatakse nefelomeetria. Väga väikestes kogustes analüüdi koostist moodustavate komponentide määramiseks kasutatakse kolorimeetria ja nefelomeetria meetodeid. Selle meetodi täpsus on madalam kui gravimeetriline või titrimeetriline.
4. Elektrokeemilised meetodid. Need meetodid hõlmavad elektrogravimeetrilist analüüsi, konduktomeetriat, potentsiomeetriat ja polarograafiat. Elektrogravimeetriline meetod kasutatakse metallide kontsentratsiooni määramiseks. Määratav element sadestatakse elektrolüüsi teel elektroodile, mille mass on teada. Konduktomeetria ja potentsiomeetria seotud elektrotitrimeetriaga. Tiitrimise ajal toimuva reaktsiooni lõpp tehakse kindlaks kas lahuse elektrijuhtivuse mõõtmise või uuritavasse lahusesse sukeldatud elektroodi potentsiaali mõõtmise teel. Potentsiomeetrilist meetodit kasutatakse ka lahuse pH määramiseks. Määratlus põhineb lahuse elektromotoorjõu (emf) mõõtmisel, mis sõltub vesinikioonide kontsentratsioonist. Polaarograafilisel meetodil See tähendab, et määratava iooni kogust hinnatakse voolu-pinge kõvera (polarogrammi) olemuse järgi, mis saadakse uuritava lahuse elektrolüüsil elavhõbedatilkkatoodiga spetsiaalses seadmes - polarograafis. See meetod on väga tundlik. Polarograafilise meetodi abil on võimalik kvalitatiivselt ja kvantitatiivselt määrata erinevaid elemente samas lahuses ilma keemilisi reaktsioone kasutamata.
KVANTITATIIVNE ANALÜÜS
Keemilised meetodid
Klassikalised keemilised analüüsimeetodid
Gravimeetria (kaaluanalüüs).
Meetod põhineb keemilise reaktsiooni tulemusena tekkinud halvasti lahustuva ühendi (sademe) massi (massi) mõõtmisel. määratud komponent ja reaktiiv(sadestaja). Mõõtmine toimub analüütilisel gravimeetrilisel kaalul kaalumisega.
Määratud komponent + sade = sette kaalutud vorm
(määratud vorm) (reaktiiv, (sadestatud (gravimeetriline
reaktiiv) vorm) vorm)
Titrimeetria (titrimeetriline või mahuline analüüs).
Meetod põhineb määratava komponendiga reageerinud teadaoleva reaktiivi lahuse mahu täpsel mõõtmisel. kasutatakse titrimeetrias. tiitritud lahused, mille kontsentratsioon on teada. Neid lahendusi nimetatakse titrantid (töölahused). Tiitrilahuse järkjärgulist (tilkhaaval lisamist) analüüdi lahusesse valamise protsessi nimetatakse tiitrimine. Tiitrimise käigus lisatakse tiitrimise kogus kogusega samaväärne määratav aine.
Reaktsiooni lõppu nimetatakse stöhhiomeetriliseks punktiks või ekvivalentpunktiks.
Katseliselt määratakse tiitrimise lõpp lahuse värvuse ilmnemise või kadumise, sademete lakkamise või indikaatorite abil. Seda punkti nimetatakse tiitrimise lõpp-punktiks
Meetodite aluseks olevad reaktsiooninõuded
kvantitatiivne analüüs
Koostoime määratava komponendi ja reaktiivi vahel peab toimuma teatud stöhhiomeetrilistes suhetes vastavalt reaktsioonivõrrandile. Reaktsioon peaks kulgema peaaegu lõpuni. Reaktsiooniprodukt peab olema kindla koostise ja valemiga.
Reaktsioon peab kulgema kiiresti, suure kiirusega, mis on eriti oluline otsesel tiitrimisel. Aeglaste reaktsioonide ekvivalentpunkti on raske täpselt fikseerida. Kõrvaltoimed või konkureerivad reaktsioonid tuleks viia miinimumini.
Ekvivalentsuspunkti ja tiitrimise lõpu leidmiseks (määramiseks) peab olema rahuldav viis.
Titrimeetria
Titrimeetrilise analüüsi meetodite klassifikatsioon
Keemiliste reaktsioonide liikide järgi
1. Happe-aluseline tiitrimine (neutraliseerimismeetod)
Näiteks.
HCl + NaOH = NaCl + H2O
tugev tugev sool
happe alus
indikaator
HCl + NH 4 OH \u003d NH 4 Cl + H 2 O
nõrk sool
alus
titrant otsustas
komponent
2. Redoks-tiitrimine
Näiteks.
2 KMnO 4 + 10 FeSO 4 + 8 H 2 SO 4 = 2 MnSO 4 + 5 Fe 2 (SO 4) 3 + K 2 SO 4 + 8 H 2 O
oksüdeeriv aine redutseerija happeline keskkond
titrant otsustas
aine
Tiitrimismeetodid
1. Otsene tiitrimise meetod
Titrant lisatakse väikeste portsjonitena (tilkhaaval) määratava komponendi lahusele kuni ekvivalentpunktini.
Otsese pöördtiitrimise meetod: koonilises kolvis oleva tiitri täpse mahuni lisatakse väikeste portsjonitena (tilkhaaval) büreti analüüdi lahus.
2.Tagasitiitrimine või jääkide tiitrimine
Sel juhul kasutatakse kahte teadaoleva täpse kontsentratsiooniga tiitrijat. Koonilises kolvis lisatakse analüüdi lahusele liias täpne kogus esimest tiitrijat V 1 täpse kontsentratsiooniga C 1 . Kuna esimest tiitrijat lisatakse liias, siis osa sellest reageerib analüüdiga ning esimese tiitri reageerimata osa jääb lahusesse ning tiitritakse teise tiitriga ning see kulutab teise tiitrindi ruumala V 2 kontsentratsiooniga. C2-st.
Kui tiitrite kontsentratsioonid on üksteisega võrdsed (C 1 \u003d C 2), siis määratakse esimese tiitrimise V lahuse kogus, mis reageeris määratava komponendiga, lisatud V 1 ja tiitritava lahuse vahe järgi. V 2 maht:
Kui tiitrijate kontsentratsioonid ei ole võrdsed, siis arvutage analüüdiga reageerinud esimese tiitri moolekvivalentide arv (n) esimese tiitrimise moolekvivalentide arvu C 1 V 1 ja tiitrimise arvu vahe võrra. teise tiitri C 2 V 2 moolekvivalendid:
n \u003d C 1 V 1 - C 2 V 2
Tagasitiitrimise meetodit kasutatakse juhul, kui sobivat indikaatorit pole saadaval või kui põhireaktsioon ei edene väga kiiresti.
Näiteks. Naatriumkloriidi NaCl koguse määramine.
NaCl lahusele lisatakse liigne kogus esimest AgNO 3 tiitrijat. Osa sellest tiitrist reageerib võrrandi kohaselt analüüdiga
AgNO 3 + NaCl = AgCl + NaNO 3
Titrant 1 valge
Ülejäänud tiitrimisaine 1 (AgNO 3), mis ei reageerinud NaCl-ga, tiitritakse seejärel teise NH 4 SCN tiitriga.
AgNO 3 + NH 4 SCN = AgSCN + NH 4 NO 3
Titrant 1 Titrant 2 punakaspruun
3. asendustiitrimise meetod
Seda meetodit kasutatakse juhul, kui ekvivalentpunkti on mingil põhjusel raske määrata, eriti kui töötate ebastabiilsete ainetega, mis on õhuhapniku mõjul kergesti oksüdeerivad jne, või ainetega, mida on raske otsese tiitrimisega määrata või reaktsioon on aeglane. .
Meetod seisneb selles, et määratavale ainele lisatakse abireaktiiv, millega koostoimel kvantitatiivselt reaktsiooniprodukt vabaneb. Seda vabanenud reaktsioonisaadust nimetatakse asetäitja ja seejärel tiitritakse sobiva tiitriga.
Näiteks.
K 2 Cr 2 O 7 + 6 KI + 7 H 2 SO 4 \u003d 3 I 2 + 4 K 2 SO 4 + Cr 2 (SO 4) 3 + 7 H 2 O
määratud happeline abiprodukt
aine reaktiivi reaktsioonikeskkond
asetäitja
I 2 + 2 Na 2 S 2 O 3 \u003d 2 NaI + Na 2 S 4 O 6
Titrandi asetäitja indikaator
Arvutused titrimeetrias
Ekvivalentide seadus: ained reageerivad üksteisega samaväärsetes kogustes.Üldiselt kõigi reageerivate ainete puhul vastavalt ekvivalentide seadusele
kus n on reaktiivide moolekvivalentide arv.
kus C e on ekvivalendi molaarkontsentratsioon, mol/l.
C 1 V 1 = C 2 V 2
Reageerivate ainete lahuste sama kontsentratsiooni korral kulgevad reaktsioonid nende võrdsete mahtude vahel.
Näiteks. 10,00 ml happelahuse kohta kulub 10,00 ml leeliselahust, kui nende kontsentratsioon on 0,1 mol / l.
Tiiter(T) lahus on 1 ml lahuses (või 1 cm 3) sisalduva aine mass, mõõtmed on g / ml.
T \u003d m (aine) / V (lahus)
T \u003d C e M e / 1000
Näiteks. T (HCl / HCl) = 0,0023 g / ml näitab: vesinikkloriidhappe (või vesinikkloriidhappe) tiiter HCl-s on 0,0023 g / ml. See tähendab, et iga 1 ml vesinikkloriidhappe lahust sisaldab 0,0023 g HCl või 2,3 mg 1 ml-s.
NEUTRALISERIMISMEETOD
Ühe kaalu meetod
Näiteks. Teatud proov võetakse koonilisse kolbi m(keemiliselt puhas) oksaalhape H 2 C 2 O 4 2H 2 O (kaalutud analüütilisel kaalul 0,0001 g täpsusega). Lahustatakse vees ja tiitritakse täielikult metüüloranži indikaatoriga NaOH lahusega. Tiitrimiseks kasutatud maht V ml NaOH lahust. Arvutage NaOH kontsentratsioon.
NaOH kontsentratsiooni arvutamiseks kasutame valemit:
m (H 2 C 2 O 4 2H 2 O) \u003d C (NaOH) x V (NaOH) x M (1/2 H 2 C 2 O 4 2 H 2 O)
Sellest valemist tuletame C (NaOH), kõik muud andmed on teada.
KVANTITATIIVNE ANALÜÜS
KVANTITATIIVSE ANALÜÜSI MEETODID
Kvantitatiivses analüüsis eristatakse keemilisi, füüsikalisi ja füüsikalis-keemilisi meetodeid.Meetodi määramine ühte või teise rühma sõltub sellest, kuivõrd selle meetodiga aine keemilise koostise määramine põhineb keemilise või füüsikalise meetodi kasutamisel. protsessid või mõlema protsessi kombinatsioon.
Välja on töötatud analüütilised meetodid, mis põhinevad peaaegu kõigi teadaolevate aatomite ja molekulide keemiliste ja füüsikaliste omaduste kasutamisel. Tuleb arvestada, et analüütiline protseduur koosneb tavaliselt mitmest etapist, millest igaüks põhineb konkreetsel omadusel.
Vastavalt aine kolmele agregeeritud olekule – tahke, vedel, gaasiline – saab kvantitatiivseid mõõtmisi läbi viia massi (kaalumise teel) ja vedelate või gaasiliste ainete mahu määramise teel.
Keemilised meetodid
Keemilised meetodid põhinevad järgmistel transformatsioonidel: sademe teke või sademe lahustumine, värvilise ühendi teke või lahuse värvuse muutumine, gaasiliste ainete teke.
Analüüsides, mida nimetatakse "klassikalisteks", kasutatakse keemilisi meetodeid. Need on hästi testitud, koosnevad mitmest etapist, millest igaüks toob sisse oma vea ja nõuab analüütikult tähelepanelikkust, täpsust ja suurt kannatlikkust.