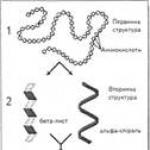
Hizi ni biopolymers ambazo monomers ni amino asidi.
Amino asidi ni misombo ya kikaboni yenye uzito wa chini wa Masi iliyo na kaboksili (-COOH) na vikundi vya amini (-NH 2) ambavyo vimeunganishwa kwa atomi sawa ya kaboni. Mlolongo wa pembeni umeunganishwa kwenye atomi ya kaboni - radical ambayo hupa kila asidi ya amino sifa fulani.
Asidi nyingi za amino zina kundi moja la kaboksili na kundi moja la amino; amino asidi hizi huitwa upande wowote. Kuna, hata hivyo, pia asidi ya amino ya msingi- na zaidi ya kikundi kimoja cha amino, na vile vile asidi ya amino asidi- na zaidi ya kikundi kimoja cha carboxyl.
Kuna takriban asidi 200 za amino zinazojulikana kupatikana katika viumbe hai, lakini 20 tu kati yao hupatikana katika protini. Hawa ndio wanaoitwa msingi au protiniogenic amino asidi.
Kulingana na radical, asidi ya msingi ya amino imegawanywa katika vikundi 3:
- Mashirika yasiyo ya polar (alanine, methionine, valine, proline, leucine, isoleucine, tryptophan, phenylalanine);
- Polar bila malipo (asparagine, glutamine, serine, glycine, tyrosine, threonine, cysteine);
- Kushtakiwa (arginine, histidine, lysine - vyema; asidi aspartic na glutamic - hasi).
Minyororo ya upande wa asidi ya amino (radical) inaweza kuwa haidrofobu au haidrofili na kutoa sifa zinazolingana na protini.
Katika mimea, asidi zote muhimu za amino huunganishwa kutoka kwa bidhaa za msingi za photosynthesis. Binadamu na wanyama hawawezi kuunganisha idadi ya amino asidi ya protinijeniki na lazima wapokee wakiwa wamekamilika na chakula. Asidi za amino kama hizo huitwa muhimu. Hizi ni pamoja na lysine, valine, leucine, isoleucine, threonine, phenylalanine, tryptophan, methionine; arginine na histidine ni muhimu kwa watoto.
Katika suluhisho, asidi ya amino inaweza kufanya kama asidi na besi, i.e. ni misombo ya amphoteric. Kikundi cha kaboksili (-COOH) kinaweza kutoa protoni, inayofanya kazi kama asidi, na kikundi cha amini (-NH2) kinaweza kukubali protoni, hivyo kuonyesha sifa za besi.
Kikundi cha amino cha asidi moja ya amino kinaweza kuguswa na kikundi cha kaboksili cha asidi nyingine ya amino. Molekuli inayosababisha ni dipeptidi, na dhamana ya -CO-NH- inaitwa bondi ya peptidi.
Katika mwisho mmoja wa molekuli ya dipeptide kuna kikundi cha amino cha bure, na kwa upande mwingine kuna kikundi cha bure cha carboxyl. Shukrani kwa hili, dipeptide inaweza kushikamana na asidi nyingine za amino yenyewe, na kutengeneza oligopeptides. Ikiwa asidi nyingi za amino (zaidi ya 10) zimeunganishwa kwa njia hii, basi polipeptidi.
Peptides ina jukumu muhimu katika mwili. Aligopeptides nyingi ni homoni. Hizi ni oxytocin, vasopressin, thyrotropin-releasing hormone, thyrotropin, nk Oligopeptides pia ni pamoja na bradykidine (peptidi ya maumivu) na baadhi ya opiates ("madawa ya asili" ya wanadamu), ambayo hufanya kazi ya kupunguza maumivu. Kuchukua dawa huharibu mfumo wa opiate wa mwili, kwa hivyo mtu anayetumia dawa bila kipimo cha dawa hupata maumivu makali - "kujiondoa", ambayo kwa kawaida huondolewa na opiates.
Oligopeptides ni pamoja na baadhi ya antibiotics (kwa mfano, gramicidin S).
Homoni nyingi (insulini, homoni ya adrenokotikotropiki, nk), antibiotics (kwa mfano, gramicidin A), sumu (kwa mfano, sumu ya diphtheria) ni polypeptides.
Protini ni polipeptidi, molekuli ambayo ina kutoka 50 hadi elfu kadhaa ya amino asidi na uzito wa molekuli zaidi ya 10,000.
Kila protini ina muundo wake maalum wa anga katika mazingira fulani. Wakati wa kuashiria muundo wa anga (tatu-dimensional), viwango vinne vya shirika la molekuli za protini vinajulikana.
Muundo wa msingi- mlolongo wa asidi ya amino katika mnyororo wa polypeptide. Muundo wa msingi ni maalum kwa kila protini na imedhamiriwa na taarifa za maumbile, i.e. inategemea mlolongo wa nyukleotidi katika sehemu ya molekuli ya DNA inayosimba protini. Mali na kazi zote za protini hutegemea muundo wa msingi. Kubadilisha amino asidi moja katika molekuli za protini au kubadilisha mpangilio wao kwa kawaida hujumuisha mabadiliko katika utendaji wa protini. Kwa kuwa protini zina aina 20 za asidi ya amino, idadi ya chaguzi za mchanganyiko wao katika mnyororo wa jinsia na peptidi haina kikomo, ambayo hutoa idadi kubwa ya aina ya protini katika seli hai.
Katika seli hai, molekuli za protini au sehemu zao za kibinafsi sio mnyororo ulioinuliwa, lakini hupindishwa ndani ya ond, kukumbusha chemchemi iliyopanuliwa (kinachojulikana kama α-helix) au kukunjwa kwenye safu iliyokunjwa (safu ya beta). Muundo wa sekondari hutokea kutokana na kuundwa kwa vifungo vya hidrojeni kati ya -CO- na -NH 2 -vikundi vya vifungo viwili vya peptidi ndani ya mnyororo wa polipeptidi (usanidi wa helical) au kati ya minyororo miwili ya polipeptidi (tabaka zilizokunjwa).
Protini ya keratini ina usanidi wa α-helical kabisa. Ni protini ya muundo wa nywele, manyoya, kucha, makucha, midomo, manyoya na pembe. Muundo wa sekondari wa ond ni tabia, pamoja na keratini, ya protini za nyuzi (kama nyuzi) kama myosin, fibrinogen, na kolajeni.
Katika protini nyingi, sehemu za helical na zisizo za helical za mnyororo wa polipeptidi hujikunja kuwa umbo la duara la pande tatu - globule (tabia ya protini za globula). Globule ya usanidi fulani ni muundo wa elimu ya juu squirrel. Muundo wa elimu ya juu umeimarishwa na ionic, vifungo vya hidrojeni, vifungo vya disulfidi covalent (ambazo hutengenezwa kati ya atomi za sulfuri zinazounda cysteine), pamoja na mwingiliano wa hydrophobic. Muhimu zaidi katika kuibuka kwa muundo wa elimu ya juu ni mwingiliano wa hydrophobic; Katika kesi hiyo, protini hupiga kwa namna ambayo minyororo yake ya upande wa hydrophobic imefichwa ndani ya molekuli, yaani, inalindwa kutokana na kuwasiliana na maji, na minyororo ya upande wa hydrophilic, kinyume chake, inakabiliwa nje.
Protini nyingi zilizo na muundo mgumu sana zinajumuisha minyororo kadhaa ya polipeptidi iliyoshikiliwa pamoja kwenye molekuli kwa sababu ya mwingiliano wa hydrophobic, na vile vile kwa msaada wa vifungo vya hidrojeni na ionic - hutokea. muundo wa quaternary. Muundo huu unapatikana, kwa mfano, katika hemoglobin ya globular ya protini. Molekuli yake ina subunits nne tofauti za polypeptide (protomers) ziko katika muundo wa juu, na sehemu isiyo ya protini - heme. Tu katika muundo huo ni hemoglobini inayoweza kufanya kazi yake ya usafiri.
Chini ya ushawishi wa mambo mbalimbali ya kemikali na kimwili (matibabu na pombe, asetoni, asidi, alkali, joto la juu, mionzi, shinikizo la juu, nk), muundo wa juu na wa quaternary wa protini hubadilika kutokana na kupasuka kwa vifungo vya hidrojeni na ionic. . Mchakato wa kuvuruga muundo wa asili (asili) wa protini unaitwa denaturation. Katika kesi hiyo, kuna kupungua kwa umumunyifu wa protini, mabadiliko katika sura na ukubwa wa molekuli, kupoteza shughuli za enzymatic, nk. Mchakato wa denaturation wakati mwingine unaweza kubadilishwa, yaani, kurudi kwa hali ya kawaida ya mazingira inaweza kuambatana na marejesho ya hiari ya muundo wa asili wa protini. Utaratibu huu unaitwa upya upya. Inafuata kwamba vipengele vyote vya muundo na utendaji wa macromolecule ya protini imedhamiriwa na muundo wake wa msingi.
Kulingana na muundo wao wa kemikali, protini imegawanywa kuwa rahisi na ngumu. KWA rahisi ni pamoja na protini zinazojumuisha tu amino asidi, na changamano- iliyo na sehemu ya protini na sehemu isiyo ya protini (prostatic) - ioni za chuma, wanga, lipids, nk Protini rahisi ni albin ya serum, immunoglobulin (antibodies), fibrin, baadhi ya vimeng'enya (trypsin), nk Protini tata zote ni proteolipids. na glycoproteins, hemoglobin , enzymes nyingi, nk.
Kazi za protini
Kimuundo.
Protini ni sehemu ya utando wa seli na organelles za seli. Kuta za mishipa ya damu, cartilage, tendons, nywele, kucha, na makucha katika wanyama wa juu hujumuisha hasa protini.
Kichocheo (enzymatic).
Protini za enzyme huchochea athari zote za kemikali katika mwili. Wanahakikisha kuvunjika kwa virutubisho katika njia ya utumbo, kurekebisha kaboni wakati wa photosynthesis, athari za awali za tumbo, nk.
Usafiri.
Protini zina uwezo wa kuunganisha na kusafirisha vitu mbalimbali. Albamu za damu husafirisha asidi ya mafuta, globulini husafirisha ioni za chuma na homoni. Hemoglobini hubeba oksijeni na dioksidi kaboni.
Molekuli za protini zinazounda utando wa plasma hushiriki katika usafirishaji wa vitu ndani na nje ya seli.
Kinga.
Inafanywa na immunoglobulins (antibodies) katika damu, ambayo hutoa ulinzi wa kinga ya mwili. Fibrinogen na thrombin zinahusika katika kuganda kwa damu na kuzuia kutokwa na damu.
Contractile.
Inahakikishwa na harakati za nyuzi za actin na protini za myosin zinazohusiana na kila mmoja katika misuli na ndani ya seli. Sliding ya microtubules, iliyojengwa kutoka kwa tubulin ya protini, inaelezea harakati za cilia na flagella.
Udhibiti.
Homoni nyingi ni oligopeptidi au protini, kwa mfano: insulini, glucagon, homoni ya adenocorticotropic, nk.
Kipokeaji.
Baadhi ya protini zilizowekwa kwenye utando wa seli zinaweza kubadilisha muundo wao kwa kukabiliana na mazingira ya nje. Hivi ndivyo ishara zinavyopokelewa kutoka kwa mazingira ya nje na habari hupitishwa kwenye seli. Mfano itakuwa phytochrome- protini nyeti nyepesi ambayo inasimamia majibu ya picha ya mimea, na opsin- sehemu rhodopsin, rangi inayopatikana katika seli za retina.
Muundo wa msingi - mlolongo wa amino asidi katika mnyororo wa polipeptidi. Katika molekuli ya protini, wakati wa kubadilisha rigid (bond ya peptidi) na sehemu zinazobadilika (α-carbon atomi), mpangilio wa compact wa mnyororo katika nafasi huundwa.
Mbinu ya Akobori ni kutumia phenylhydrazine. Phenylhydrazine huvunja vifungo vya peptidi katika protini na kuambatanisha na amino asidi zote isipokuwa C-terminal moja. Uchanganuzi unaofuata wa kromatografia huwezesha kutambua amino asidi ya C-terminal katika protini.
Utafiti wa muundo wa msingi ni muhimu Umuhimu wa jumla wa kibaolojia na matibabu:
- muundo wa msingi huamua miundo ya protini inayofuata.
- ujuzi wa muundo wa msingi wa protini ni muhimu kwa ajili ya awali ya bandia ya protini.
- muundo wa msingi huamua utaalam wa spishi, kwa mfano, katika protini ya insulini, kawaida katikati ya molekuli katika spishi anuwai za wanyama na wanadamu, uingizwaji hufanyika, kama sheria, ya asidi 3 za amino sawa.
- mabadiliko katika muundo wa msingi yanaweza kusababisha magonjwa mengi, kwa mfano, anemia ya seli ya mundu, ambayo katika hemoglobini katika mnyororo wa β kwenye nafasi ya 6, asidi ya glutamic inabadilishwa na valine. Uingizwaji huu na asidi ya amino isiyo sawa husababisha usumbufu wa utendaji wa hemoglobin na kuonekana kwa seli nyekundu za damu zenye umbo la mundu.
Muundo wa sekondari - muundo unaorudiwa mara kwa mara wa mpangilio wa mnyororo wa polipeptidi katika nafasi. Mara nyingi, aina 2 za muundo wa sekondari hupatikana katika protini: α - helix na β - muundo.
α - helix mwaka wa 1951 ilichunguzwa na L. Pauling kwa kutumia njia ya mseto wa X-ray. Ni muundo wa helical wa mkono wa kulia, kwa upande mmoja ambao asidi 3.6 za amino zinafaa. Lami ya ond (umbali kati ya zamu za karibu) ni 0.54 n.m. α-helix imewekwa na vifungo vya hidrojeni, ambavyo hufungwa kati ya vifungo vya peptidi vinavyoundwa na kila asidi ya 4 ya amino. α ya sekondari - muundo hujikunja kwa hiari na imedhamiriwa na muundo wa msingi wa protini. Uwiano wa mikoa iliyopangwa katika muundo wa helical inatofautiana katika protini tofauti. Kwa mfano, katika hemoglobin na myoglobin, safu ya α - muundo hutawala, ambayo hupunguza saizi ya molekuli ya protini kwa mara 4.
β-muundo ina sura ya "accordion" na imeimarishwa na vifungo vya hidrojeni kati ya sehemu za mbali za mlolongo wa polypeptidi au kati ya molekuli kadhaa za protini. Kuna miundo sambamba ya β, ambayo N na C mwisho zinahusiana na kila mmoja, na miundo ya antiparallel. Mfano wa protini ambazo kwa kiasi kikubwa zina miundo ya β ni immunoglobulini.
Muundo wa sekondari unasomwa na uchambuzi wa diffraction ya X-ray na kwa kusoma ngozi ya mionzi ya ultraviolet na protini (idadi kubwa ya α - miundo, kunyonya zaidi).
Muundo wa sekondari huharibiwa wakati wa denaturation.
Muundo wa elimu ya juu - na aina ya mpangilio wa anga wa mnyororo wa polipeptidi maalum kwa kila protini. Muundo huu umeundwa kwa hiari na imedhamiriwa na muundo wa msingi. Muundo wa elimu ya juu huongeza kwa kiasi kikubwa ushikamano wa protini kwa makumi. Vifungo visivyo na ushirikiano (hydrophobic, ionic) na covalent (disulfide) vifungo vinahusika katika malezi ya muundo wa juu.
Muundo wa elimu ya juu huamua shughuli za kibiolojia na mali ya physicochemical ya protini. Ikiwa muundo wa juu umevunjwa, protini hupoteza shughuli zake za kibiolojia.
Mbinu za kusoma muundo wa elimu ya juu ni uchambuzi wa diffraction ya X-ray na uamuzi wa shughuli za kemikali za itikadi kali ya amino katika protini. Muundo wa juu wa protini ya myoglobin ulichunguzwa kwa mara ya kwanza na J. Kendrew (1957). M. Perutz (1959) alisoma muundo wa hemoglobin.
Muundo wa juu wa protini ni pamoja na α - helical, β - miundo iliyokunjwa, β - loops (ambapo mnyororo wa polipeptidi umeinama na 180 0) na kinachojulikana kama coil iliyoharibika. Kwa mfano, protini ya insulini ina 57% α - mikoa ya helical, 6% β - miundo iliyokunjwa, 10% ya molekuli hupangwa kwa namna ya β - loops na 27% ya molekuli ni coil iliyoharibika.
Jumla ya shule za msingi, za sekondari, za juu ni kufanana molekuli ya protini. Uundaji wa maisha (asili) huundwa kwa hiari na uundaji wake unaitwa kukunja. Uundaji wa protini hauna msimamo sana na huundwa na ushiriki wa protini maalum - waongozaji(maswahaba). Chaperones wanaweza kushikamana na protini ambazo hazijabadilika na kurejesha muundo wao wa asili. Chaperones huwekwa kwa uzito wa Masi (60 - 100 cd.). Zilizochunguzwa zaidi ni Sh-60, Sh-70 na Sh-90. Kwa mfano, Sh-70 huingiliana na protini zilizo na matajiri katika radicals ya hydrophobic na kuwalinda kutokana na uharibifu wa joto la juu. Kwa ujumla, chaperones hulinda protini kuu za mwili, kuzuia denaturation na kukuza uundaji wa muundo, kuwezesha usafirishaji wa protini zilizobadilishwa kuwa lysosomes, na kushiriki katika mchakato wa usanisi wa protini.
Kulingana na muundo, protini zote zimegawanywa katika vikundi vitatu:
- protini za nyuzi: collagen, elastini, fibroin.
- Protini za globular: hemoglobin, albumin, globulin.
- Protini zilizochanganywa: myosin.
Muundo wa kiwango cha juu ni asili katika protini zote. Protini za oligomeric tu, ambazo zina subunits kadhaa, protomers, zina muundo wa quaternary. Protoma inachukuliwa kuwa mnyororo tofauti wa polipeptidi, kitengo kidogo ni sehemu inayofanya kazi ya protini ya oligomeri. Kitengo kidogo kinaweza kuwa na protoma moja au kadhaa.
Muundo wa Quaternary - idadi na mpangilio wa jamaa wa subunits katika protini za oligomeric. Protini za oligomeric tu, ambazo zina subunits kadhaa, protomers, zina muundo wa quaternary. Protoma inachukuliwa kuwa mnyororo tofauti wa polipeptidi, kitengo kidogo ni sehemu inayofanya kazi ya protini ya oligomeri. Kitengo kidogo kinaweza kuwa na protoma moja au protoma nyingi.
Uundaji wa muundo wa quaternary unahusisha vifungo dhaifu visivyo na covalent (hydrophobic, ionic, hidrojeni). Muundo wa quaternary wa protini huunda moja kwa moja na huvunjika kwa urahisi wakati unafanywa. Sehemu ndogo za kibinafsi katika protini ya oligomeri huingiliana na kila mmoja, ambayo husababisha mabadiliko katika muundo wa juu wa protomers za kibinafsi. Jambo hili linaitwa mabadiliko ya ushirika katika upatanisho wa protoma na kwa kawaida huambatana na ongezeko la shughuli za protini.
Protini za oligomeri zina idadi ya vipengele ikilinganishwa na protini za monomeri.
- Wana upakiaji ulio ngumu sana na uso mdogo wa kiolesura, kwa hivyo, kwa kuwa iko ndani ya seli, hufunga maji kidogo.
- Shughuli yao inadhibitiwa katika mwili. Protomers kawaida hazifanyi kazi, lakini protini za oligomeric zinafanya kazi zaidi.
- Ikiwa aina hiyo hiyo ya protoma inahusika katika usanisi wa protini ya oligomeri, hii huokoa nyenzo za kijeni (protoma kadhaa zinazofanana "zimepigwa muhuri" kwenye sehemu fupi ya DNA)
- Wao ni kazi zaidi ilichukuliwa na hali ya mwili.
Utendaji wa protini za oligomeri unaonyeshwa kwa kulinganisha protini za hemoglobini na myoglobin, ambazo zinahusika katika usafirishaji wa oksijeni kwa tishu. Hemoglobin ya erythrocytes ni protini ya oligomeric ambayo inajumuisha minyororo 4 ya polypeptide. Myoglobin ya misuli ni protini ya monomeriki inayojumuisha mnyororo 1 wa polipeptidi. Curve ya kueneza oksijeni ya myoglobin inaonyesha utegemezi wake wa moja kwa moja kwenye mkusanyiko wa oksijeni. Kwa himoglobini, mkunjo wa kueneza oksijeni una umbo la S. Hii ni kutokana na mabadiliko ya taratibu katika muundo (conformation) ya kila protomers 4 katika muundo wa hemoglobin, kama matokeo ya ambayo mshikamano wa hemoglobin kwa oksijeni huongezeka kwa kasi. Asili hii ya kueneza kwa hemoglobin na oksijeni huongeza kwa kasi uwezo wake wa oksijeni ikilinganishwa na myoglobin.
Nafasi maalum kati ya protini inachukuliwa protini za kikoa .
Vikoa ni sehemu tofauti za kimuundo na kiutendaji za mnyororo mmoja wa polipeptidi. Vikoa vinaweza kuwajibika kwa mwingiliano wa protini na vitu mbalimbali - ligand (dutu za chini za Masi, DNA, RNA, polysaccharides, nk) Mifano ya protini za kikoa ni albin ya serum, immunoglobulins, na baadhi ya vimeng'enya (trypsin ya kongosho).
Kwa sababu ya uteuzi mkubwa wa protini, zinaweza kuunganishwa kuwa tata, ambazo mara nyingi huitwa tata za multienzyme - hizi ni vyama vya kimuundo vya enzymes kadhaa ambazo huchochea hatua za kibinafsi za mchakato mgumu wa kemikali. Mfano: pyruvate dehydrogenase complex (PDC), tata ya aina tatu za vimeng'enya ambavyo huchochea oxidation ya asidi ya pyruvic (PVA).
Inawezekana kuchanganya hasa protini za kibinafsi, lakini pia protini zilizo na lipids (mafuta) wakati wa kuundwa kwa membrane za seli, na protini zilizo na asidi ya nucleic wakati wa kuundwa kwa chromatin.
Tabia ya physicochemical ya protini.
Kwa kiasi kikubwa imedhamiriwa na muundo wa molekuli ya protini (muundo wa msingi - wa juu wa protini). Sifa za kifizikia za protini zinaonekana katika suluhisho.
Umumunyifu protini hutofautiana kutoka kwa protini hadi protini.
Kwa ujumla, umumunyifu wa protini ni wa juu, lakini hutofautiana kati ya aina tofauti za protini. Inaathiriwa na mambo yafuatayo:
- umbo la molekuli ya protini (protini za globular ni mumunyifu zaidi kuliko protini za fibrillar)
- asili ya protini amino asidi radical, uwiano wa itikadi kali zisizo za polar (radicals zaidi ya polar hydrophilic katika protini, umumunyifu wake bora zaidi)
- mali ya kutengenezea, uwepo wa chumvi. Mkusanyiko mdogo wa chumvi (KCL, NaCl) wakati mwingine huongeza umumunyifu wa protini. Kwa mfano, albamu ni bora mumunyifu katika maji safi distilled, globulini ni kufutwa tu mbele ya 10% chumvi (KCL, NaCl). Protini za tishu-unganishi collagen na elastini haziyeyuki katika maji au miyeyusho ya salini.
Masi ya molekuli protini ni kubwa kabisa, kuanzia 6,000 hadi 1,000,000. Kwa mfano, uzito wa molekuli ya hemoglobini ni 68,000, albumin ni 100,000, ribonuclease ni karibu 14,000, myosin ni 500,000.
Njia za kuamua molekuli ya molar ya protini lazima iwe mpole na usiharibu molekuli za protini. Kwa mfano, njia ya ebullioscopic, kulingana na kupima kiwango cha kuchemsha cha ufumbuzi, haitumiki kwa protini. Njia sahihi zaidi za kuamua uzito wa molekuli ya protini ni njia ya ultracentrifugation na njia ya diffraction ya X-ray.
Njia ya Ultracentrifugation(sedimentation) inategemea mabadiliko katika kiwango cha mchanga wa protini za uzito tofauti wa molekuli wakati wa kuzungusha miyeyusho ya protini kwa kasi ya juu. Uzito wa molekuli ya protini inayopatikana kwa njia hii imeteuliwa na kitengo cha Svedberg (S = 10 -13 c.)
Njia ya mgawanyiko wa X-ray hukuruhusu kuhesabu uzito wa Masi kwa kuchambua picha nyingi za X-ray za molekuli ya protini.
Njia ya electrophoretic Inategemea utegemezi wa kasi ya harakati ya protini katika uwanja wa umeme wa mara kwa mara kwenye uzito wa molekuli ya protini (uhamaji wa electrophoretic ni wa juu kwa protini zilizo na uzito wa chini wa Masi)
Mbinu ya Chromatografia inategemea viwango tofauti vya kupita kwa protini tofauti kupitia "sieves" za gel ya molekuli.
Molekuli kubwa zaidi ya saizi ya pore ya gel hupitia jeli haraka kuliko molekuli ndogo za protini ambazo huhifadhiwa ndani ya chembe za jeli.
Njia ya microscopic ya elektroni hufanywa kwa kulinganisha saizi ya molekuli ya protini na sampuli za marejeleo za misa inayojulikana.
Mbinu za kemikali kuhusishwa na sifa za muundo wa kemikali wa protini
Muundo wa molekuli za protini tofauti. Molekuli za protini zinaweza kuwa fibrillar au globular kwa umbo. Protini za nyuzi zina umbo la molekuli kama nyuzi. Kwa ujumla hazipatikani katika maji na hupunguza ufumbuzi wa salini. Protini za fibrillar ni pamoja na protini kuu za miundo ya tishu zinazojumuisha: collagen, keratin, elastin. Katika protini za globular, minyororo ya polipeptidi imefungwa kwa nguvu katika miundo ya spherical ya kompakt. Protini nyingi za globular ni mumunyifu sana katika maji na ufumbuzi dhaifu wa salini. Protini za globular ni pamoja na vimeng'enya, kingamwili, albamni, na himoglobini. Baadhi ya protini zina aina ya kati ya molekuli, iliyo na sehemu zinazofanana na uzi na duara. Mfano wa protini hizo ni protini ya myosin ya misuli, ambayo ni mumunyifu katika ufumbuzi wa salini.
Ukubwa wa molekuli za protini ziko katika safu kutoka 1 hadi 100 nm, karibu na saizi za chembe za colloidal. Kwa sababu ya hili, ufumbuzi wa protini una mali ya ufumbuzi wa kweli na ufumbuzi wa colloidal.
Sifa nyingi za kinetic za molekuli za ufumbuzi wa protini ni sawa na mali ya ufumbuzi wa colloidal .
- Kiwango cha polepole cha kuenea kwa protini muhimu kwa kubadilishana kwao.
- Kutokuwa na uwezo wa protini kupita kwenye utando unaoweza kupenyeza. Katika vyumba vilivyo na mkusanyiko wa juu wa protini, shinikizo la ziada la hidrostatic huundwa kutokana na harakati ya njia moja ya molekuli za maji kupitia utando wa nusu-penyeza kuelekea mkusanyiko wa juu wa protini. Shinikizo la ziada linaloundwa na protini huitwa shinikizo la oncotic. Ni jambo muhimu kuamua harakati ya maji kati ya tishu, damu, na matumbo.
- Viscosity ya juu ya protini ni kutokana na mwingiliano mbalimbali wa intermolecular wa molekuli kubwa za protini. Kuongezeka kwa viscosity ya damu, hasa, huongeza mzigo kwenye misuli ya moyo.
- Baadhi ya protini zina uwezo wa kutengeneza jeli, ambayo huongeza nguvu ya protini (km collagen).
Mali ya macho ya protini imedhamiriwa na saizi ya molekuli za protini, muundo wa itikadi kali ya amino katika protini, uwepo wa vifungo vya peptidi na kanda za alpha-helical katika protini.
- Suluhisho za protini zina athari ya refraction mwanga (refraction) na kueneza mwanga. Sifa hizi zinatokana na saizi kubwa ya molekuli za protini, zinazolingana na urefu wa mawimbi ya sehemu inayoonekana ya wigo Katika kesi hii, miale mifupi ya bluu hutawanywa kwa kiwango kikubwa kuliko miale nyekundu ya urefu wa wimbi. Kiwango cha refraction ni sawia na mkusanyiko wa ufumbuzi wa protini.
- Ufumbuzi wa protini kunyonya mionzi ya ultraviolet katika anuwai ya 190-230 nm kwa sababu ya uwepo wa vifungo vya peptidi na katika anuwai ya 260-280 nm kwa sababu ya uwepo wa asidi ya amino ya mzunguko katika protini. Kiwango cha kunyonya kwa UV kinalingana na mkusanyiko wa protini katika suluhisho.
- Ufumbuzi wa protini unaweza kuzunguka ndege ya mwanga wa polarized, ambayo ni kutokana na shughuli ya macho ya amino asidi zilizomo katika protini na kuwepo kwa sehemu za alpha-helical ndani yake. Kuna uhusiano wa moja kwa moja kati ya mgawanyiko wa mwanga na mkusanyiko wa protini katika suluhisho.
Protini, kuwa suluhisho za Masi, zina sifa za ufumbuzi wa kweli . Kuwa suluhisho la kweli, suluhisho za protini ni thabiti sana.
Squirrels- Hizi ni misombo ya kikaboni ya biopolymer ya juu ya molekuli ambayo monoma ni amino asidi. Protini zilitambuliwa kama darasa tofauti la molekuli za kibaolojia katika karne ya 18. kama matokeo ya kazi ya duka la dawa la Ufaransa A. de Fourcroix. Kwanza alielezea protini na akapendekeza jina protini, ambayo kwa maana ya kisasa ina maana ya protini, mwanakemia wa Uholanzi E. J. Berzelius. Kutengwa kwa kwanza kwa protini (kwa namna ya gluten) kutoka kwa unga wa ngano ulifanyika na J. Beccari. Kipengele cha utafiti wa protini mwanzoni mwa karne ya 21. upatikanaji wa wakati huo huo wa data juu ya muundo wa protini wa seli nzima, tishu au viumbe, ambayo ni sayansi tofauti - protini .
Uzito wa molekuli ya protini kutoka 5000 hadi 150000 Ndiyo na zaidi.
Moja ya protini kubwa zaidi ni titini(sehemu ya sarcomeres ya misuli), iliyo na asidi ya amino zaidi ya elfu 29 na ina uzito wa Masi ya Da 3,000,000. Lakini protini kubwa zaidi kwa wingi (zaidi ya Da 40,000,000) ni tabia ya virusi.
Muundo wa kemikali . Protini zinajumuisha C, Η, O, N; katika baadhi ya protini ni S, baadhi ya protini huunda changamano na molekuli nyingine zilizomo P, Fe, Zn, Cu. Protini ni biopolymers ya monomers 20 tofauti - asili asidi ya amino ya msingi. Protini zinaweza kuunda tata za interpolymer na wanga, lipids, asidi ya nucleic, asidi ya fosforasi, nk.
Tabia za physicochemical. Kwa sababu ya uwepo wa vikundi vya bure vya amino na vikundi vya carboxyl, protini zina sifa ya mali yote ya asidi na besi. mali ya amphoteric) Kutengana kwa asidi ya amino na vikundi vya protini vya carboxyl huamua uhamaji wa elektroni wa protini. Kwa viwango vya chini vya pH vya suluhisho la protini, vikundi vya amino vilivyo na chaji vyema hutawala ndani yake, kwa hivyo protini ziko katika fomu ya cationic. Katika viwango vya juu vya pH, vikundi vya COOH vilivyo na chaji hasi hutawala na protini zitakuwa katika hali ya anionic. Kwa thamani fulani ya pH ya kati, vikundi vya amino na vikundi vya carboxyl vinaweza kuingiliana, basi jumla ya malipo ni sifuri, na protini hubaki bila kusonga kwenye uwanja wa umeme. mali ya umeme) Uzito mkubwa wa Masi hutoa suluhisho za protini na tabia ya mifumo ya colloidal, ambayo ni: uwezo wa kuunda gels, mnato wa juu, kiwango cha chini cha uenezi, kiwango cha juu cha uvimbe, kwa sababu ambayo hufunga karibu 80-90% ya maji yote kwenye mwili. mali ya colloidal) Kuvunjika kwa protini hutokea chini ya hatua ya asidi, alkali au enzymes maalum ya hydrolase, ambayo huvunja ndani ya peptidi na amino asidi. Mchanganyiko unafanywa kutoka kwa asidi ya amino na kanuni ya template kwa kutumia mjumbe RNA. Chini ya ushawishi wa kemikali mbalimbali, protini zinaweza kuganda na kushuka, na kupoteza mali zao za asili. Kutokuwepo kwa chaji na ganda la unyevu huchangia muunganiko wa molekuli za protini, kushikamana kwao pamoja na kunyesha. Jambo hili linaitwa kuganda, inaweza kuwa kinyume na isiyoweza kutenduliwa. Mgando usioweza kurekebishwa unaweza kuzingatiwa kama ubadilishanaji wa protini. Denaturation ni mchakato wa kuvuruga muundo wa asili wa protini. Wakati huo huo, umumunyifu wa protini hupungua, sura na ukubwa wa molekuli hubadilika, nk Mchakato wa denaturation unaweza kubadilishwa, yaani, kurudi kwa hali ya kawaida kunafuatana na urejesho.
uboreshaji wa muundo wa asili wa protini. Utaratibu huu unaitwa urekebishaji upya . Inafuata kwamba sifa za protini zinatambuliwa na muundo wake wa msingi. Lakini mchakato wa uharibifu wa muundo wa msingi wa protini daima hauwezi kurekebishwa, inaitwa uharibifu . Mali ya protini hutegemea muundo, muundo na mlolongo wa asidi ya amino.
Muundo wa protini. Molekuli za protini ni polima za mstari zinazojumuisha amino asidi. Kwa kuongezea mlolongo wa asidi ya amino ya mnyororo wa polipeptidi (muundo wa msingi), muundo wa pande tatu (sekondari ya juu na quaternary) ni muhimu sana kwa utendakazi wa protini, ambayo iko kama matokeo ya mwingiliano wa miundo chini ya viwango. na hutengenezwa wakati wa mchakato wa kukunja protini. Muundo wa pande tatu wa protini chini ya hali ya kawaida ya asili, ambayo protini hufanya kazi zao za kibaolojia, inaitwa. kushonwa kwa masharti protini, na muundo yenyewe ni muundo wa asili Kuna viwango vinne vya muundo wa protini.
Viwango vya shirika la molekuli za protini
Muundo wa msingi iliyosimbwa na jeni inayolingana, ni maalum kwa kila protini ya mtu binafsi na kwa kiwango kikubwa huamua mali ya protini iliyoundwa. Muundo wa sekondari ni umbo la hesi (α-muundo) au muundo wa karatasi iliyokunjwa (β-conformation) na ni hali thabiti ya thermodynamically ya mnyororo wa polipeptidi na muundo rahisi wa upatanishi wa biomolecules. Mfano wa protini zilizo na muundo wa sekondari kwa namna ya ond ni protini za keratin (fomu ya nywele, misumari, manyoya, nk) na kwa namna ya karatasi iliyopigwa - fibroin (protini ya hariri). Katika muundo wa sekondari, kanda za α-helical mara nyingi hubadilishana na zile za mstari. Muundo wa elimu ya juu hutokea kiatomati kama matokeo ya mwingiliano wa mabaki ya asidi ya amino na molekuli za maji. Katika kesi hii, radicals ya hydrophobic "hutolewa" kwenye molekuli ya protini, na vikundi vya hydrophilic vinaelekezwa kuelekea kutengenezea. Kwa njia hii, molekuli ya protini ya kompakt huundwa, ndani ambayo hakuna molekuli za maji. Protini zilizo na muundo wa juu ni pamoja na myoglobin. Muundo wa Quaternary hutokea kama matokeo ya mchanganyiko wa subunits kadhaa ( protoma), ambayo kwa pamoja hutimiza kawaida

kazi. Mchanganyiko huu unaitwa tata ya protini. multimer, au epimer) Protini za kawaida za muundo wa quaternary ni hemoglobin, STM, na baadhi ya enzymes.
Muundo wa mwisho unaweza kuwa mgumu sana, na mchakato wa kupitishwa kwake kwenye mnyororo wa polipeptidi mpya uliosanisishwa unahitaji muda. Mchakato wa protini kupitisha muundo unaitwa kuganda, au Kukunja. Protini nyingi haziwezi kukamilisha kujikunja zenyewe na kufikia hali ya asili, mara nyingi kupitia mwingiliano na protini zingine za seli. Protini kama hizo zinahitaji msaada wa nje kutoka kwa protini za darasa maalum - Masi waongozaji. Protini nyingi hupata muundo sahihi tu chini ya hali fulani za mazingira. Wakati hali hizi zinabadilika, protini hubadilika, kubadilisha muundo wake. Mambo ambayo husababisha mabadiliko katika muundo wa protini ni joto, mionzi, asidi kali, besi kali, chumvi iliyokolea, metali nzito, vimumunyisho vya kikaboni na kadhalika.
Aina za vifungo vya kemikali katika protini. Asidi za amino zina uwezo wa kuunda idadi ya vifungo vya kemikali (peptidi, disulfide, hidrojeni, ionic, hydrophobic) na vikundi mbalimbali vya kazi, na mali hii ni muhimu sana kwa muundo na kazi za protini.
Kifungo cha peptide - ni dhamana ya polar ya nitrojeni-kaboni ambayo huundwa na mwingiliano wa NH 2 amino asidi moja na COOH ya nyingine na kutolewa kwa maji. Dhamana hii ya asidi ya amide (-CO-NH-) ndio dhamana kuu ya kemikali ya molekuli za protini na huamua muundo wao wa msingi na upatanisho. Kiwanja kinachoundwa na condensation ya amino asidi mbili ni dipeptide. Katika mwisho mmoja wa molekuli hii kuna kikundi cha amino, kwa upande mwingine - kikundi cha bure cha carboxyl. Shukrani kwa hili, dipeptide inaweza kushikamana na asidi nyingine za amino yenyewe.
Dhamana ya disulfide ni dhamana ya polar ya ushirikiano ambayo huundwa na mwingiliano wa vikundi vya sulfhydryl. (-SH) itikadi kali ya amino asidi cysteine iliyo na salfa. Muunganisho huu (-S-S-) inaweza kutokea kati ya sehemu tofauti za mnyororo mmoja wa polipeptidi na kati ya minyororo tofauti, kuamua sifa za molekuli za protini. Utulivu wa protini nyingi kwa kiasi kikubwa imedhamiriwa na idadi ya vifungo hivi, kana kwamba "huunganisha" molekuli, kuwapa nguvu na kutokuwepo (kwa mfano, katika collagen ya ngozi, keratini ya nywele, pamba).
Dhamana ya hidrojeni - Hiki ni kifungo cha polar ambacho hutokea wakati hidrojeni ya elektroni inapoingiliana na oksijeni ya elektroni katika vikundi vya hidroksili, kaboksili na amini vya asidi tofauti za amino. Viunganishi hivi (-HE) dhaifu sana kuliko peptidi, disulfidi na ionic, lakini kutokana na wingi wao (hutokea kati ya makundi ambayo ni mengi zaidi katika molekuli za protini), huwa muhimu sana katika kuimarisha muundo wa molekuli za protini.
Kifungo cha ioni ni kifungo cha polar ya kielektroniki ambacho hutokea kati ya kikundi cha amino kilicho na ioni, kilicho na chaji chanya ya asidi moja ya amino na kikundi cha kaboksili kilicho na chaji hasi cha amino asidi nyingine. Uunganisho huu wa chumvi (-COO - HN 3+ -) inaweza kuchanganya zamu zote mbili za minyororo ya polipeptidi moja au zaidi katika protini za muundo wa elimu ya juu, na zamu za minyororo tofauti katika protini za muundo wa quaternary. Katika mazingira yenye maji, vifungo vya ioni ni dhaifu zaidi kuliko vifungo vya peptidi na vinaweza kuvunjwa na mabadiliko katika pH.
Mwingiliano wa Hydrophobic - Huu ni uhusiano usio wa polar kati ya itikadi kali za amino ambazo hazibeba chaji ya umeme na haziyeyuki katika maji. Njia ya radicals hizi ni kutokana na asili ya mwingiliano wa vikundi vya hydrophobic (-CH3, -C2H5, nk) na maji. Viunganishi hivi (-R-R-) hata dhaifu kuliko zile za hidrojeni, zinaunga mkono muundo wa juu na wa quaternary wa protini.
BIOLOGIA + Hemoglobini (kutoka Kigiriki Naita - damu na "lat. Globus - mpira") - protini tata iliyo na chuma ya erythrocytes ya wanyama na binadamu; ina uwezo wa kumfunga oksijeni, kuhakikisha uhamisho wake kwa tishu. Aidha, hemoglobini ina uwezo wa kumfunga kiasi kidogo cha CO katika tishu na kuifungua kwenye mapafu. Hemoglobin ni protini changamano ya darasa la chromoprotein na ina 1) sehemu ya protini - globin, ambayo ina protoma nne - minyororo miwili inayofanana na β-minyororo miwili inayofanana, 2.) sehemu isiyo ya protini - heme, ambayo inawakilishwa na vikundi vinne vya bandia vilivyo na kituo cha uratibu katika mfumo wa Fe 2+ . Subunits zimeunganishwa na hidrojeni, vifungo vya ionic, lakini mchango mkuu wa mwingiliano huu unafanywa na mwingiliano wa hydrophobic. Maudhui ya hemoglobini ya kawaida katika damu ya binadamu ni: kwa wanaume - 130-170 g / l, kwa wanawake - 120-150 g / l, kwa watoto - 120-140 g / l. Hemoglobini ni sumu kali wakati kiasi kikubwa chake kinapoingia kwenye plasma ya damu kutoka kwa seli nyekundu za damu (kwa mfano, wakati wa kuongezewa damu isiyoendana) . Kwa kuzingatia sumu ya juu ya hemoglobin ya bure, mwili una mifumo maalum ya kuifunga na kuipunguza. Hasa, moja ya vipengele vya mfumo wa neutralization ya hemoglobini ni protini maalum ya plasma, haptoglobin, ambayo hufunga globin ya bure na globin katika muundo wa hemoglobin.
Ni kawaida kutofautisha viwango vinne vya shirika la kimuundo la molekuli ya protini: muundo wa msingi, sekondari, wa juu na wa quaternary. Wacha tuangalie sifa za kila moja ya viwango hivi.
2.1.1. Muundo wa msingi wa protini ni mlolongo wa amino asidi zinazobadilishana katika mnyororo wa polipeptidi. Muundo huu unaundwa na vifungo vya peptidi kati ya vikundi vya α-amino na α-carboxyl ya amino asidi (ona 1.4.2). Kumbuka kwamba hata mabadiliko madogo katika muundo wa msingi wa protini yanaweza kubadilisha sana mali zake. Mfano wa magonjwa ambayo yanaendelea kutokana na mabadiliko katika muundo wa msingi wa protini ni hemoglobinopathies (hemoglobinoses).
Hemoglobin A (Hb A) iko kwenye chembechembe nyekundu za damu za watu wazima wenye afya. Damu ya watu wengine ina hemoglobini isiyo ya kawaida (iliyobadilishwa) - hemoglobin (Hb S). Tofauti pekee kati ya muundo msingi wa Hb S na Hb A ni uingizwaji wa mabaki ya asidi hidrofili ya glutamic na mabaki ya valine haidrofobi katika eneo la mwisho la minyororo yao ya beta:
Kama unavyojua, kazi kuu ya hemoglobini ni kusafirisha oksijeni kwa tishu. Chini ya hali ya kupungua kwa shinikizo la sehemu ya O2, umumunyifu wa hemoglobin S katika maji na uwezo wake wa kumfunga na kusafirisha oksijeni hupungua. Seli nyekundu za damu huchukua umbo la mundu na kuharibiwa haraka, na kusababisha upungufu wa damu (anemia ya seli mundu).
Imeanzishwa kuwa mlolongo wa mabaki ya amino asidi ya mlolongo wa polipeptidi ya protini hubeba taarifa muhimu kwa ajili ya kuunda muundo wa anga wa protini. Imeanzishwa kuwa kila mlolongo wa polipeptidi unalingana na lahaja moja tu thabiti ya muundo wa anga. Mchakato wa kukunja mnyororo wa polypeptidi katika muundo wa kawaida wa pande tatu unaitwa kukunja
Hadi hivi karibuni, iliaminika kuwa uundaji wa muundo wa anga wa protini hutokea kwa hiari, bila ushiriki wa vipengele vyovyote. Walakini, hivi majuzi iligunduliwa kuwa hii ni kweli kwa protini ndogo tu (takriban mabaki 100 ya asidi ya amino). Katika mchakato wa kukunja protini kubwa, protini maalum hushiriki - wachungaji, ambayo huunda uwezekano wa malezi ya haraka ya muundo sahihi wa anga wa protini.
2.1.2. Muundo wa sekondari wa protini inawakilisha njia ya kukunja mnyororo wa polipeptidi katika muundo wa helical au mwingine. Katika kesi hii, vifungo vya hidrojeni huundwa kati ya CO na vikundi vya NH vya uti wa mgongo wa peptidi wa mnyororo mmoja au minyororo ya polipeptidi iliyo karibu. Aina kadhaa za muundo wa sekondari wa minyororo ya peptidi hujulikana, kati ya hizo kuu ni safu ya α-helix na β-karatasi.
α-Helix- muundo mgumu, unaonekana kama fimbo. Sehemu ya ndani ya fimbo hii imeundwa na uti wa mgongo wa peptidi uliopotoka, radicals ya amino asidi huelekezwa nje. Katika kesi hii, kikundi cha CO cha kila mabaki ya amino asidi huingiliana na kikundi cha NH cha mabaki ya nne kutoka kwake. Kuna mabaki ya asidi ya amino 3.6 kwa kila upande wa helix, na lami ya helix ni 0.54 nm (Mchoro 2.1).

Kielelezo 2.1.α-Helix.
Asidi zingine za amino huzuia mnyororo kukunja ndani ya α-hesi, na katika eneo lao mwendelezo wa helix huvurugika. Asidi hizi za amino ni pamoja na prolini (ambapo atomi ya nitrojeni ni sehemu ya muundo wa pete dhabiti na mzunguko kuzunguka dhamana ya N - C α hauwezekani), pamoja na asidi ya amino yenye radikali zilizochajiwa ambazo huzuia kielektroniki au kiufundi kufanyizwa kwa α-. helix. Ikiwa kuna radicals mbili kama hizo (au zaidi) ndani ya zamu moja (kama mabaki 4 ya asidi ya amino), huingiliana na kuharibu hesi.
safu ya β-fold hutofautiana na α-hesi kwa kuwa ni bapa badala ya umbo la fimbo. Imeundwa na vifungo vya hidrojeni ndani ya minyororo moja au zaidi ya polipeptidi. Minyororo ya peptidi inaweza kupangwa kwa mwelekeo sawa (sambamba) au kwa mwelekeo tofauti (antiparallel), inayofanana na mvuto wa accordion. Radicals za baadaye ziko juu na chini ya ndege ya safu.

Kielelezo 2.2. safu iliyokunjwa β.
Kumbuka kwamba aina ya muundo wa sekondari wa protini imedhamiriwa na muundo wake wa msingi. Kwa mfano, katika eneo la mabaki ya proline (atomi za pete ya pyrrolidine katika proline ziko kwenye ndege moja), minyororo ya peptidi huinama, na vifungo vya hidrojeni kati ya amino asidi hazijaundwa. Kwa hiyo, protini zilizo na maudhui ya juu ya proline (kwa mfano, collagen) haziwezi kuunda α-helix. Radikali za amino asidi, ambazo hubeba malipo ya umeme, pia huzuia helicalization.
2.1.3. Muundo wa juu wa protini ni usambazaji katika nafasi ya atomi zote za molekuli ya protini, au kwa maneno mengine, ufungaji wa anga wa mnyororo wa polipeptidi ya helical. Jukumu kuu katika malezi ya muundo wa juu wa protini unachezwa na vifungo vya hidrojeni, ionic, hydrophobic na disulfide, ambayo huundwa kama matokeo ya mwingiliano kati ya itikadi kali ya amino.

Kulingana na sura ya molekuli na sifa za malezi ya muundo wa juu, protini zinagawanywa katika globular na fibrillar.
Protini za globular- kuwa na umbo la molekuli ya spherical au ellipsoidal (globule). Wakati wa kuundwa kwa globule, radicals ya amino asidi ya hydrophobic huingizwa katika mikoa ya ndani, wakati radicals ya hydrophilic iko kwenye uso wa molekuli. Wakati wa kuingiliana na awamu ya maji, radicals ya polar huunda vifungo vingi vya hidrojeni. Protini hufanyika katika hali ya kufutwa kwa sababu ya malipo yao na shell ya hydration. Katika mwili, protini za globular hufanya kazi za nguvu (usafiri, enzymatic, udhibiti, kinga). Protini za globular ni pamoja na:
- Albamu - protini ya plasma ya damu; ina mabaki mengi ya glutamate na aspartate; huchochea kwa kueneza kwa 100% ya suluhisho na sulfate ya amonia.
- Globulins - protini za plasma ya damu; Ikilinganishwa na albumin, zina uzito wa juu wa molekuli na zina mabaki machache ya glutamate na aspartate; hupita kwa 50% ya ujazo wa suluhisho na sulfate ya amonia.
- Historia - ni sehemu ya viini vya seli, ambapo huunda changamano na DNA. Ina mabaki mengi ya arginine na lysine.
Protini za fibrillar- kuwa na sura inayofanana na nyuzi (fibrils), tengeneza nyuzi na vifurushi vya nyuzi. Kuna viungo vingi vya ushirikiano kati ya minyororo ya polipeptidi iliyo karibu. Hakuna katika maji. Mpito katika suluhisho huzuiwa na itikadi kali za asidi ya amino zisizo za polar na viungo vya msalaba kati ya minyororo ya peptidi. Katika mwili wao hufanya hasa kazi ya kimuundo, kutoa nguvu za mitambo kwa tishu. Protini za fibrillar ni pamoja na:
- Collagen - protini ya tishu zinazojumuisha. Utungaji wake unaongozwa na amino asidi glycine, proline, na hydroxyproline.
- Elastin - elastic zaidi kuliko collagen, ni sehemu ya kuta za mishipa na tishu za mapafu, muundo wake unaongozwa na asidi ya amino glycine, alanine, na valine.
- Keratini - protini ya epidermis na derivatives ya ngozi; amino asidi cysteine hutawala katika muundo wake.
2.1.4. Muundo wa quaternary wa protini ni mpangilio katika nafasi ya subunits zinazoingiliana zinazoundwa na minyororo ya polipeptidi ya kibinafsi ya protini. Muundo wa Quaternary ni kiwango cha juu zaidi cha shirika la molekuli ya protini, na pia ni chaguo - zaidi ya nusu ya protini zinazojulikana hazina. Protini zilizo na muundo wa quaternary pia huitwa protini za oligomeric, na minyororo ya polipeptidi iliyojumuishwa katika muundo wao ni subunits au protomers. Katika baadhi ya protini, subunits hizo ni sawa au zina muundo sawa, wakati protini nyingine zinajumuisha subunits na minyororo ya aina tofauti.
Kila moja ya protoma imeundwa kama mnyororo tofauti wa polipeptidi, ambayo hukunjwa kuwa globuli na kisha kuunganishwa na zingine kupitia kujikusanya. Kila kitengo kidogo kina maeneo ambayo yanaweza kuingiliana na maeneo yanayolingana ya vitengo vingine. Mwingiliano huu unafanywa kupitia vifungo vya hidrojeni, ioniki na haidrofobu kati ya itikadi kali ya amino ambayo ni sehemu ya minyororo tofauti.
Protini za oligomeri zinaweza kuwepo katika miunganisho kadhaa thabiti na kuwa nazo mali ya allosteric, Hiyo ni, wana uwezo wa kuhama kutoka kwa muundo mmoja hadi mwingine na mabadiliko katika shughuli zao za utendaji. Mifano ya protini za oligomeric ni pamoja na protini ya erythrocyte hemoglobin, kimeng'enya phosphofructokinase na wengine wengi.
Mpangilio wa kimuundo na utendaji wa protini za oligomeri utajadiliwa kwa undani zaidi katika mada inayofuata kwa kutumia hemoglobini kama mfano (Mchoro 2.3).

Kielelezo 2.3. Muundo wa anga wa hemoglobin. Molekuli yake ina vijisehemu vinne vinavyofanana kwa jozi, vilivyoteuliwa na herufi α na β. Sehemu isiyo ya protini ya hemoglobin, heme, inaonyeshwa kwa bluu.
Protini pia zinajulikana ambazo molekuli zinajumuisha minyororo miwili au zaidi ya polypeptide iliyounganishwa na vifungo vya disulfide (insulini, thrombin). Protini kama hizo haziwezi kuwa oligomeric. Protini kama hizo huundwa kutoka kwa mnyororo mmoja wa polipeptidi kama matokeo ya proteolysis ya sehemu - mgawanyiko wa ndani wa vifungo vya peptidi. Protini kama hizo hazina mali ya allosteric tabia ya protini za oligomeric.
Kuna viwango vinne vya shirika la kimuundo la protini: msingi, sekondari, sekondari na quaternary. Kila ngazi ina sifa zake.
Muundo wa msingi wa protini ni mnyororo wa polipeptidi wa mstari wa asidi ya amino iliyounganishwa na vifungo vya peptidi. Muundo wa msingi ni kiwango rahisi zaidi cha shirika la kimuundo la molekuli ya protini. Utulivu wa hali ya juu hutolewa kwake na vifungo vya peptidi shirikishi kati ya kikundi cha α-amino cha asidi moja ya amino na kikundi cha α-carboxyl cha asidi nyingine ya amino. [onyesha] .
Ikiwa kikundi cha imino cha proline au hydroxyproline kinahusika katika uundaji wa dhamana ya peptidi, basi ina fomu tofauti. [onyesha] .

Wakati vifungo vya peptidi vinapoundwa kwenye seli, kikundi cha kaboksili cha asidi moja ya amino huwashwa kwanza, na kisha huchanganyika na kikundi cha amino cha mwingine. Mchanganyiko wa maabara ya polypeptides unafanywa kwa takriban njia sawa.
Kifungo cha peptidi ni kipande kinachojirudia cha mnyororo wa polipeptidi. Ina idadi ya vipengele vinavyoathiri sio tu sura ya muundo wa msingi, lakini pia viwango vya juu vya shirika la mnyororo wa polypeptide:


- coplanarity - atomi zote zilizojumuishwa katika kikundi cha peptidi ziko kwenye ndege moja;
- uwezo wa kuwepo katika aina mbili za resonance (keto au fomu ya enol);
- nafasi ya mpito ya vibadala vinavyohusiana na dhamana ya C-N;
- uwezo wa kuunda vifungo vya hidrojeni, na kila moja ya vikundi vya peptidi vinaweza kuunda vifungo viwili vya hidrojeni na vikundi vingine, ikiwa ni pamoja na peptidi.
Isipokuwa ni vikundi vya peptidi vinavyohusisha kundi la amino la proline au hydroxyproline. Wana uwezo wa kuunda dhamana moja ya hidrojeni (tazama hapo juu). Hii inathiri malezi ya muundo wa sekondari wa protini. Mlolongo wa polipeptidi katika eneo ambalo proline au hydroxyproline iko hujipinda kwa urahisi, kwani haushikiliwi, kama kawaida, na dhamana ya pili ya hidrojeni.
Nomenclature ya peptidi na polypeptides . Jina la peptidi linaundwa na majina ya amino asidi zao. Asidi mbili za amino huunda dipeptidi, tatu hufanya tripeptidi, nne hufanya tetrapeptidi, n.k. Kila mnyororo wa peptidi au polipeptidi wa urefu wowote una asidi ya amino ya N-terminal iliyo na kikundi cha amino cha bure na asidi ya amino ya C-terminal iliyo na kaboksili ya bure. kikundi. Wakati wa kutaja polipeptidi, amino asidi zote zimeorodheshwa kwa kufuatana, kuanzia na N-terminal moja, kuchukua nafasi katika majina yao, isipokuwa kwa C-terminal moja, kiambishi tamati -in na -yl (kwa kuwa amino asidi katika peptidi hazina tena kikundi cha carboxyl, lakini moja ya kaboni). Kwa mfano, jina lililoonyeshwa kwenye Mtini. 1 tripeptide - leuc udongo phenylalane udongo tatu katika.
Vipengele vya muundo wa msingi wa protini . Katika uti wa mgongo wa mnyororo wa polipeptidi, miundo thabiti (vikundi vya peptidi tambarare) hupishana na sehemu zinazohamishika kiasi (-CHR), ambazo zina uwezo wa kuzunguka kwenye vifungo. Vipengele vile vya kimuundo vya mnyororo wa polypeptide huathiri mpangilio wake wa anga.
Muundo wa sekondari ni njia ya kukunja mnyororo wa polipeptidi katika muundo ulioamriwa kutokana na uundaji wa vifungo vya hidrojeni kati ya vikundi vya peptidi vya mnyororo sawa au minyororo ya polipeptidi iliyo karibu. Kwa mujibu wa usanidi wao, miundo ya sekondari imegawanywa katika helical (α-helix) na layered-folded (β-muundo na msalaba-β-fomu).


α-Helix. Hii ni aina ya muundo wa pili wa protini ambayo inaonekana kama hesi ya kawaida, iliyoundwa kwa sababu ya vifungo vya hidrojeni ya interpeptidi ndani ya mnyororo wa polipeptidi. Mfano wa muundo wa α-helix (Mchoro 2), ambayo inazingatia mali yote ya dhamana ya peptidi, ilipendekezwa na Pauling na Corey. Sifa kuu za α-helix:
- usanidi wa helical wa mnyororo wa polipeptidi kuwa na ulinganifu wa helical;
- uundaji wa vifungo vya hidrojeni kati ya vikundi vya peptidi vya kila mabaki ya kwanza na ya nne ya asidi ya amino;
- mara kwa mara za zamu za ond;
- usawa wa mabaki yote ya asidi ya amino katika α-hesi, bila kujali muundo wa radicals yao ya upande;
- itikadi kali ya upande wa asidi ya amino haishiriki katika uundaji wa α-hesi.
Kwa nje, α-helix inaonekana kama ond iliyoinuliwa kidogo ya jiko la umeme. Kawaida ya vifungo vya hidrojeni kati ya vikundi vya kwanza na vya nne vya peptidi huamua kawaida ya zamu ya mnyororo wa polipeptidi. Urefu wa zamu moja, au lami ya α-helix, ni 0.54 nm; inajumuisha mabaki ya asidi ya amino 3.6, yaani, kila mabaki ya amino asidi husogea kando ya mhimili (urefu wa mabaki ya asidi ya amino moja) kwa 0.15 nm (0.54:3.6 = 0.15 nm), ambayo huturuhusu kuzungumza juu ya usawa wa mabaki yote ya asidi ya amino. katika α-hesi. Kipindi cha kawaida cha α-helix ni zamu 5 au mabaki 18 ya asidi ya amino; urefu wa kipindi kimoja ni 2.7 nm. Mchele. 3. Pauling-Corey a-helix model
β-Muundo. Hii ni aina ya muundo wa pili ambao una usanidi uliopinda kidogo wa mnyororo wa polipeptidi na huundwa na vifungo vya hidrojeni ya interpeptidi ndani ya sehemu za kibinafsi za mnyororo wa polipeptidi au minyororo ya polipeptidi iliyo karibu. Pia inaitwa muundo wa safu-safu. Kuna aina za miundo β. Maeneo yenye tabaka pungufu yanayoundwa na mnyororo mmoja wa polipeptidi ya protini huitwa umbo la msalaba-β (muundo fupi wa β). Vifungo vya hidrojeni katika fomu ya msalaba-β huundwa kati ya makundi ya peptidi ya loops ya mnyororo wa polipeptidi. Aina nyingine - muundo kamili wa β - ni tabia ya mnyororo mzima wa polipeptidi, ambayo ina sura ndefu na inashikiliwa na vifungo vya hidrojeni ya interpeptidi kati ya minyororo ya polipeptidi inayofanana (Mchoro 3). Muundo huu unafanana na mvuto wa accordion. Zaidi ya hayo, lahaja za miundo ya β zinawezekana: zinaweza kuundwa na minyororo sambamba (mwisho wa N-terminal wa minyororo ya polypeptide huelekezwa kwa mwelekeo huo huo) na antiparallel (N-terminal mwisho huelekezwa kwa mwelekeo tofauti). Radikali za upande wa safu moja huwekwa kati ya itikadi kali za upande wa safu nyingine.
Katika protini, mabadiliko kutoka kwa α-miundo hadi β-miundo na nyuma yanawezekana kutokana na upangaji upya wa vifungo vya hidrojeni. Badala ya vifungo vya hidrojeni vya kawaida vya interpeptidi kando ya mnyororo (shukrani ambayo mnyororo wa polipeptidi husokota kuwa ond), sehemu za helical hujifungua na vifungo vya hidrojeni hufunga kati ya vipande vidogo vya minyororo ya polipeptidi. Mpito huu hupatikana katika keratin, protini ya nywele. Wakati wa kuosha nywele na sabuni za alkali, muundo wa helical wa β-keratin huharibiwa kwa urahisi na hugeuka kuwa α-keratin (nywele za curly hunyoosha).
Uharibifu wa miundo ya sekondari ya kawaida ya protini (α-helices na β-miundo), kwa mlinganisho na kuyeyuka kwa fuwele, inaitwa "kuyeyuka" kwa polipeptidi. Katika kesi hii, vifungo vya hidrojeni vinavunjwa, na minyororo ya polypeptide huchukua fomu ya tangle ya random. Kwa hiyo, utulivu wa miundo ya sekondari imedhamiriwa na vifungo vya hidrojeni ya interpeptide. Aina zingine za vifungo hazishiriki karibu katika hili, isipokuwa vifungo vya disulfide kando ya mnyororo wa polipeptidi kwenye maeneo ya mabaki ya cysteine. Peptidi fupi hufungwa kwa mizunguko kwa sababu ya vifungo vya disulfide. Protini nyingi zina kanda α-helical na miundo β. Karibu hakuna protini za asili zinazojumuisha 100% α-hesi (isipokuwa paramyosin, protini ya misuli ambayo ni 96-100% α-helix), wakati polipeptidi za syntetisk zina hesi 100%.
Protini zingine zina viwango tofauti vya kukunja. Mzunguko wa juu wa miundo ya α-helical huzingatiwa katika paramyosin, myoglobin, na hemoglobin. Kinyume chake, katika trypsin, ribonuclease, sehemu kubwa ya mnyororo wa polipeptidi inakunjwa katika miundo ya β-tabaka. Protini za tishu zinazounga mkono: keratin (protini ya nywele, pamba), collagen (protini ya tendons, ngozi), fibroin (protini ya hariri ya asili) ina usanidi wa β wa minyororo ya polypeptide. Viwango tofauti vya helicity ya minyororo ya polipeptidi ya protini zinaonyesha kwamba, ni wazi, kuna nguvu ambazo zinavuruga kwa kiasi fulani helicity au "kuvunja" kukunja kwa kawaida kwa mnyororo wa polipeptidi. Sababu ya hii ni kukunja kwa kompakt zaidi ya mlolongo wa polipeptidi ya protini kwa kiasi fulani, yaani, katika muundo wa juu.
Muundo wa kiwango cha juu cha protini
Muundo wa juu wa protini ni jinsi mnyororo wa polipeptidi unavyopangwa katika nafasi. Kulingana na sura ya muundo wao wa juu, protini zinagawanywa hasa katika globular na fibrillar. Protini za globula mara nyingi huwa na umbo la ellipsoid, na protini za fibrillar (kama-nyuzi) zina umbo la kuinuliwa (fimbo au umbo la spindle).
Hata hivyo, usanidi wa muundo wa juu wa protini bado hautoi sababu ya kufikiri kwamba protini za fibrillar zina muundo wa β tu, na protini za globular zina muundo wa α-helical. Kuna protini za fibrillar ambazo zina helical, badala ya safu, zilizopigwa muundo wa sekondari. Kwa mfano, α-keratin na paramyosin (protini ya misuli ya obturator ya mollusks), tropomyosins (protini za misuli ya mifupa) ni ya protini za fibrillar (zina sura ya fimbo), na muundo wao wa sekondari ni α-helix; kinyume chake, protini za globula zinaweza kuwa na idadi kubwa ya miundo ya β.
Kueneza kwa mnyororo wa polipeptidi ya mstari hupunguza saizi yake kwa takriban mara 4; na kufunga kwenye muundo wa elimu ya juu hufanya makumi ya nyakati kushikana zaidi kuliko mnyororo wa asili.
Vifungo vinavyoimarisha muundo wa juu wa protini . Vifungo kati ya itikadi kali za upande wa asidi ya amino huchangia katika kuleta utulivu wa muundo wa elimu ya juu. Viunganisho hivi vinaweza kugawanywa katika:
- nguvu (covalent) [onyesha]
.
Vifungo vya mshikamano ni pamoja na vifungo vya disulfidi (-S-S-) kati ya itikadi kali za upande wa cysteines ziko katika sehemu tofauti za mnyororo wa polipeptidi; isopeptidi, au pseudopeptide, - kati ya vikundi vya amino vya itikadi kali ya lysine, arginine, na sio vikundi vya α-amino, na vikundi vya COOH vya itikadi kali za aspartic, glutamic na aminocitric, na sio vikundi vya α-carboxyl ya asidi ya amino. Kwa hivyo jina la aina hii ya dhamana - kama peptidi. Kifungo cha nadra cha ester huundwa na kikundi cha COOH cha asidi ya amino ya dicarboxylic (aspartic, glutamic) na kikundi cha OH cha asidi ya hidroksiamino (serine, threonine).
- dhaifu (polar na van der Waals) [onyesha]
.
KWA vifungo vya polar ni pamoja na hidrojeni na ionic. Vifungo vya hidrojeni, kama kawaida, hutokea kati ya -NH 2 , -OH au -SH kikundi cha upande wa radical wa amino asidi moja na kikundi cha kaboksili cha mwingine. Vifungo vya ionic, au umemetuamo huundwa wakati vikundi vya kushtakiwa vya itikadi kali ya upande -NH + 3 (lysine, arginine, histidine) na -COO - (asidi ya aspartic na glutamic) inapogusana.
Non-polar, au van der Waals, vifungo sumu kati ya itikadi kali ya hidrokaboni ya amino asidi. Radikali za haidrofobu za asidi ya amino alanine, valine, isoleusini, methionine, na phenylalanine huingiliana katika mazingira yenye maji. Vifungo hafifu vya van der Waals hukuza uundaji wa kiini cha haidrofobu cha itikadi kali zisizo za polar ndani ya globuli ya protini. Kadiri asidi za amino zisizo za polar zinavyozidi, ndivyo dhima kubwa ya vifungo vya van der Waals katika kukunja kwa mnyororo wa polipeptidi.
Vifungo vingi kati ya itikadi kali za upande wa asidi ya amino huamua usanidi wa anga wa molekuli ya protini.
Makala ya shirika la muundo wa juu wa protini . Uundaji wa muundo wa juu wa mnyororo wa polypeptide imedhamiriwa na mali ya radicals ya upande wa asidi ya amino iliyojumuishwa ndani yake (ambayo haina athari inayoonekana juu ya malezi ya miundo ya msingi na ya sekondari) na mazingira, i.e. mazingira. Inapokunjwa, mnyororo wa polipeptidi wa protini huwa na umbo zuri kwa uchangamfu, unaojulikana na kiwango cha chini cha nishati ya bure. Kwa hivyo, vikundi vya R-nonpolar, "kuepuka" maji, huunda, kana kwamba, sehemu ya ndani ya muundo wa juu wa protini, ambapo sehemu kuu ya mabaki ya hydrophobic ya mnyororo wa polypeptide iko. Karibu hakuna molekuli za maji katikati ya globule ya protini. Vikundi vya polar (hydrophilic) R vya asidi ya amino ziko nje ya msingi huu wa haidrofobu na zimezungukwa na molekuli za maji. Mlolongo wa polipeptidi umepinda kwa ustadi katika nafasi ya pande tatu. Inapoinama, muundo wa pili wa helical huvurugika. Mlolongo "huvunjika" katika pointi dhaifu ambapo proline au hydroxyproline ziko, kwa kuwa asidi hizi za amino ni za simu zaidi katika mlolongo, na kutengeneza dhamana moja tu ya hidrojeni na makundi mengine ya peptidi. Tovuti nyingine ya bend ni glycine, ambayo ina kikundi kidogo cha R (hidrojeni). Kwa hiyo, vikundi vya R vya asidi nyingine za amino, wakati zimefungwa, huwa na kuchukua nafasi ya bure kwenye eneo la glycine. Idadi ya asidi ya amino - alanine, leucine, glutamate, histidine - huchangia katika uhifadhi wa miundo thabiti ya helical katika protini, na kama vile methionine, valine, isoleusini, asidi aspartic hupendelea uundaji wa miundo ya β. Katika molekuli ya protini yenye usanidi wa elimu ya juu, kuna mikoa katika mfumo wa α-heli (helical), miundo ya β (layered) na coil random. Mpangilio sahihi tu wa anga wa protini hufanya iwe hai; ukiukaji wake husababisha mabadiliko katika mali ya protini na kupoteza shughuli za kibiolojia.
Muundo wa protini ya Quaternary
Protini zinazojumuisha mnyororo mmoja wa polipeptidi zina muundo wa juu tu. Hizi ni pamoja na myoglobin - protini ya tishu ya misuli inayohusika katika kumfunga oksijeni, idadi ya vimeng'enya (lysozyme, pepsin, trypsin, nk). Hata hivyo, baadhi ya protini hujengwa kutoka kwa minyororo kadhaa ya polypeptide, ambayo kila mmoja ina muundo wa juu. Kwa protini hizo, dhana ya muundo wa quaternary imeanzishwa, ambayo ni shirika la minyororo kadhaa ya polypeptide na muundo wa juu katika molekuli moja ya kazi ya protini. Protein hiyo yenye muundo wa quaternary inaitwa oligomer, na minyororo yake ya polypeptide yenye muundo wa juu huitwa protomers au subunits (Mchoro 4).

Katika ngazi ya quaternary ya shirika, protini huhifadhi usanidi wa msingi wa muundo wa juu (globular au fibrillar). Kwa mfano, hemoglobini ni protini yenye muundo wa quaternary na inajumuisha subunits nne. Kila moja ya subunits ni protini ya globular na, kwa ujumla, hemoglobini pia ina usanidi wa globular. Protini za nywele na pamba - keratini, zinazohusiana na muundo wa juu kwa protini za fibrillar, zina conformation ya fibrillar na muundo wa quaternary.
Uimarishaji wa muundo wa quaternary ya protini . Protini zote ambazo zina muundo wa quaternary zimetengwa kwa namna ya macromolecules ya mtu binafsi ambayo haigawanyika katika subunits. Mawasiliano kati ya nyuso za subunits inawezekana tu kwa sababu ya vikundi vya polar vya mabaki ya asidi ya amino, kwani wakati wa malezi ya muundo wa juu wa kila minyororo ya polipeptidi, radicals ya upande wa asidi ya amino isiyo ya polar (ambayo hufanya sehemu kubwa ya minyororo ya polypeptide). amino asidi zote za protini) zimefichwa ndani ya kitengo kidogo. Ionic nyingi (chumvi), hidrojeni, na katika hali nyingine vifungo vya disulfide huundwa kati ya vikundi vyao vya polar, ambavyo vinashikilia kwa nguvu subunits kwa namna ya tata iliyopangwa. Matumizi ya vitu vinavyovunja vifungo vya hidrojeni au vitu vinavyopunguza madaraja ya disulfide husababisha mgawanyiko wa protomers na uharibifu wa muundo wa quaternary wa protini. Katika meza 1 ni muhtasari wa data kwenye vifungo vinavyoimarisha viwango tofauti vya mpangilio wa molekuli ya protini [onyesha] .
| Jedwali 1. Tabia za vifungo vinavyohusika katika shirika la kimuundo la protini | ||
| Kiwango cha shirika | Aina za vifungo (kwa nguvu) | Aina ya mawasiliano |
| Msingi (mnyororo wa polipeptidi ya mstari) | Covalent (nguvu) | Peptidi - kati ya vikundi vya α-amino na α-carboxyl ya asidi ya amino |
| Sekondari (α-hesi, β-miundo) | Dhaifu | Haidrojeni - kati ya vikundi vya peptidi (kila la kwanza na la nne) la mnyororo mmoja wa polipeptidi au kati ya vikundi vya peptidi vya minyororo ya polipeptidi iliyo karibu |
| Covalent (nguvu) | Disulfidi - vitanzi vya disulfidi ndani ya eneo la mstari wa mnyororo wa polipeptidi | |
| Elimu ya juu (globular, fibrillar) | Covalent (nguvu) | Disulfidi, isopeptidi, ester - kati ya itikadi kali za amino za sehemu tofauti za mnyororo wa polipeptidi. |
| Dhaifu | Hidrojeni - kati ya itikadi kali za amino za sehemu tofauti za mnyororo wa polipeptidi Ionic (chumvi) - kati ya vikundi vilivyochajiwa kinyume vya itikadi kali za amino asidi ya mnyororo wa polypeptide. Van der Waals - kati ya itikadi kali zisizo za polar za asidi ya amino ya mnyororo wa polypeptide |
|
| Quaternary (globular, fibrillar) | Dhaifu | Ionic - kati ya vikundi vilivyochajiwa kinyume vya itikadi kali za amino za kila sehemu ndogo Hidrojeni - kati ya radicals upande wa mabaki ya amino asidi iko juu ya uso wa maeneo ya kuwasiliana ya subunits. |
| Covalent (nguvu) | Disulfide - kati ya mabaki ya cysteine ya kila moja ya nyuso zinazowasiliana za subunits tofauti | |
Makala ya shirika la kimuundo la protini fulani za fibrillar
Shirika la kimuundo la protini za fibrillar lina idadi ya vipengele ikilinganishwa na protini za globular. Vipengele hivi vinaweza kuonekana kwa mfano wa keratin, fibroin na collagen. Keratini zipo katika muundo wa α- na β. α-Keratini na fibroin zina muundo wa sekondari wa safu, hata hivyo, katika keratini minyororo ni sambamba, na katika fibroin ni antiparallel (tazama Mchoro 3); Kwa kuongeza, keratin ina vifungo vya interchain disulfide, wakati fibroin haina. Kuvunjika kwa vifungo vya disulfide husababisha kutenganishwa kwa minyororo ya polypeptide katika keratini. Kinyume chake, uundaji wa idadi ya juu ya vifungo vya disulfide katika keratini kupitia yatokanayo na mawakala wa vioksidishaji hujenga muundo wa anga wenye nguvu. Kwa ujumla, katika protini za fibrillar, tofauti na protini za globular, wakati mwingine ni vigumu kutofautisha madhubuti kati ya viwango tofauti vya shirika. Ikiwa tunakubali (kama protini ya globular) kwamba muundo wa juu unapaswa kuundwa kwa kuweka mnyororo mmoja wa polypeptide katika nafasi, na muundo wa quaternary na minyororo kadhaa, basi katika protini za fibrillar minyororo kadhaa ya polypeptide tayari inahusika wakati wa kuundwa kwa muundo wa sekondari. . Mfano wa kawaida wa protini ya fibrillar ni collagen, ambayo ni mojawapo ya protini nyingi zaidi katika mwili wa binadamu (karibu 1/3 ya molekuli ya protini zote). Inapatikana katika tishu zilizo na nguvu nyingi na upanuzi wa chini (mifupa, tendons, ngozi, meno, nk). Katika collagen, theluthi moja ya mabaki ya asidi ya amino ni glycine, na karibu robo au kidogo zaidi ni proline au hydroxyproline.

Mlolongo wa polipeptidi uliotengwa wa collagen (muundo wa msingi) unaonekana kama mstari uliovunjika. Ina kuhusu amino asidi 1000 na ina uzito wa Masi ya karibu 10 5 (Mchoro 5, a, b). Mlolongo wa polipeptidi hujengwa kutoka kwa utatu unaorudiwa wa amino asidi (triplet) ya muundo ufuatao: gly-A-B, ambapo A na B ni asidi yoyote ya amino isipokuwa glycine (mara nyingi proline na hydroxyproline). Minyororo ya polypeptide ya Collagen (au α-minyororo) wakati wa kuunda miundo ya sekondari na ya juu (Mchoro 5, c na d) haiwezi kuzalisha α-heli za kawaida na ulinganifu wa helical. Proline, hydroxyproline na glycine (antihelical amino asidi) huingilia hii. Kwa hivyo, minyororo mitatu ya α huunda, kana kwamba, ond iliyosokotwa, kama nyuzi tatu zinazozunguka silinda. Minyororo mitatu ya helical α huunda muundo wa collagen unaorudiwa unaoitwa tropocollagen (Mchoro 5d). Tropocollagen katika shirika lake ni muundo wa juu wa collagen. Pete tambarare za prolini na hidroksiprolini zikipishana mara kwa mara kando ya mnyororo huipa uthabiti, kama vile vifungo baina ya minyororo ya α ya tropocollagen (ndio maana kolajeni hustahimili kunyoosha). Tropocollagen kimsingi ni sehemu ndogo ya nyuzi za collagen. Uwekaji wa subunits za tropocollagen katika muundo wa quaternary wa collagen hutokea kwa njia ya hatua (Mchoro 5e).
Uimarishaji wa miundo ya collagen hutokea kutokana na vifungo vya hidrojeni, ionic na van der Waals ya interchain na idadi ndogo ya vifungo vya covalent.
Minyororo ya α ya collagen ina miundo tofauti ya kemikali. Kuna aina tofauti za α 1 minyororo (I, II, III, IV) na α 2 minyororo. Kulingana na ambayo α 1 - na α 2 -minyororo inahusika katika malezi ya helix yenye nyuzi tatu ya tropocollagen, aina nne za collagen zinajulikana:
- aina ya kwanza - mbili α 1 (I) na moja α 2 mnyororo;
- aina ya pili - minyororo mitatu α 1 (II);
- aina ya tatu - minyororo mitatu α 1 (III);
- aina ya nne - minyororo mitatu α 1 (IV).
Collagen ya kawaida ni aina ya kwanza: hupatikana katika tishu za mfupa, ngozi, tendons; aina ya 2 collagen hupatikana katika tishu za cartilage, nk. Aina moja ya tishu inaweza kuwa na aina tofauti za collagen.
Mkusanyiko ulioagizwa wa miundo ya collagen, rigidity yao na inertness kuhakikisha nguvu ya juu ya collagen nyuzi. Protini za Collagen pia zina vipengele vya kabohaidreti, i.e. ni tata za protini-wanga.
Collagen ni protini ya ziada ya seli ambayo huundwa na seli za tishu zinazopatikana katika viungo vyote. Kwa hiyo, kwa uharibifu wa collagen (au kuvuruga kwa malezi yake), ukiukwaji mwingi wa kazi zinazounga mkono za tishu zinazojumuisha za viungo hutokea.
| Ukurasa 3 | jumla ya kurasa: 7 |