21-01-2013, 21:54
В основе классификации антибактериальных препаратов лежит их молекулярная структура, так как идентичные по структуре группы имеют сходные фармакодинамические и фармакокинетические параметры. Классификация антибактериальных препаратов представлена в табл. 11.
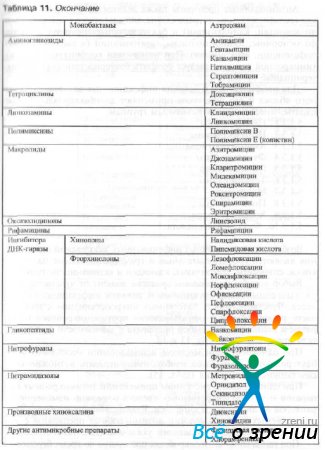
Таблица 11. Классификация антибактериальных препаратов
Для профилактики и лечения инфекционных заболеваний глазного яблока и его придатков применяют антибактериальные препараты, относящиеся к различным группам.
- Пенициллины
- Цефалоспорины
- Аминогликозиды
- Фторхинолоны
- Гликопептиды
- Тетрациклины
- Макролиды
- Полимиксины
- Хлорамфеникол
- Фузидиевая кислота.
Возбудителями различных инфекционных заболеваний органа зрения являются грамотрицательные и грамположительные палочки и кокки, спирохеты, микоплазма, хламидии и актиномицеты (табл. 12).
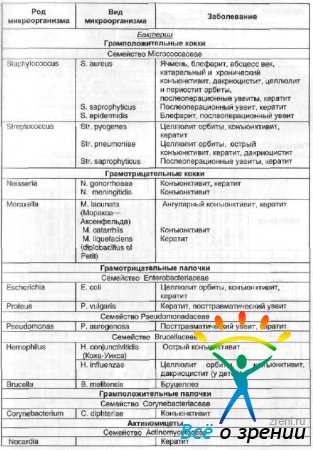
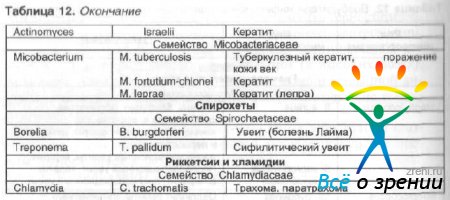
Таблица 12. Возбудители инфекционных заболеваний органа зрения
Выбор антибактериального средства зависит от чувствительности патогенных микроорганизмов и тяжести инфекционного процесса. Чувствительность патогенных микроорганизмов к наиболее часто используемым в офтальмологии противомикробным препаратам и рациональный выбор препарата в зависимости от возбудителя представлены в табл. 13 и 14.
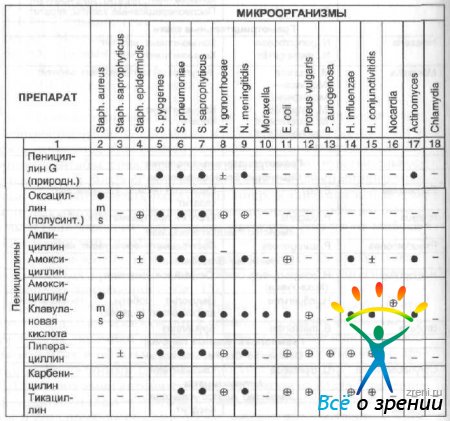
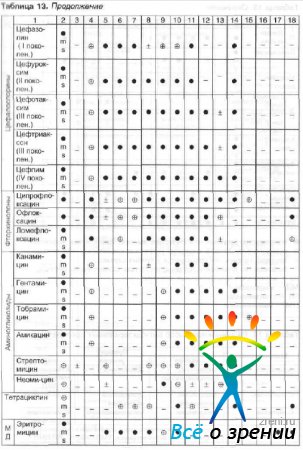
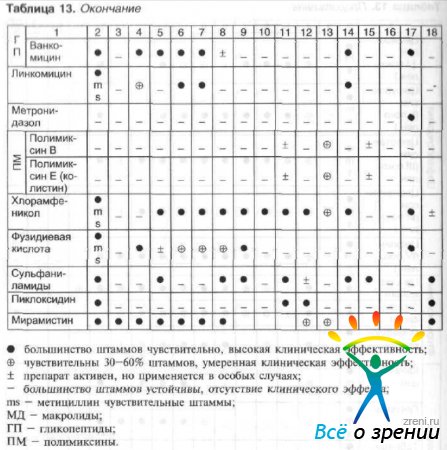
Таблица 13. Антимикробные спектры
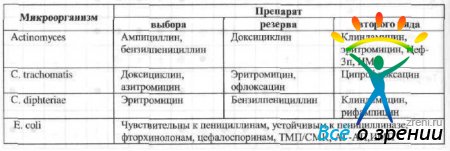

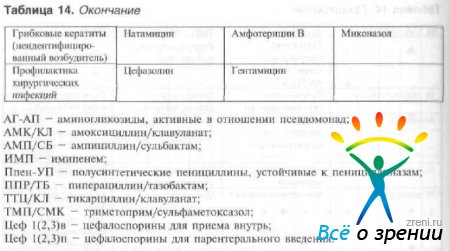
Таблица 14. Рациональный выбор антибактериальных препаратов
При одновременном местном использовании нескольких антибактериальных препаратов необходимо учитывать возможность их сочетанного применения (табл. 15).
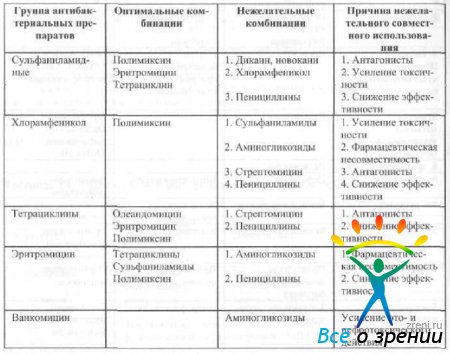
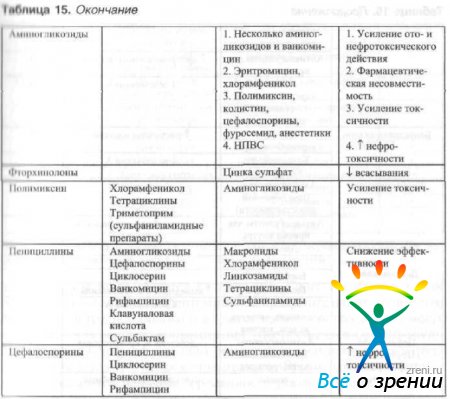
Таблица 15. Эффективность комбинированного местного применения антибактериальных средств
При одновременно системном применении антимикробных препаратов и других лекарственных средств возможно изменение параметров их динамики и кинетики. Взаимодействие наиболее часто применяемых в офтальмологии антимикробных препаратов с другими лекарственными средствами указано в табл. 16.
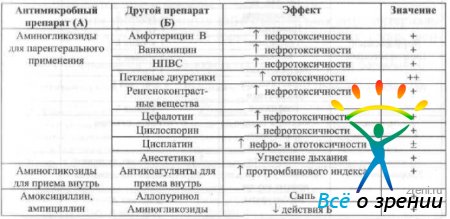
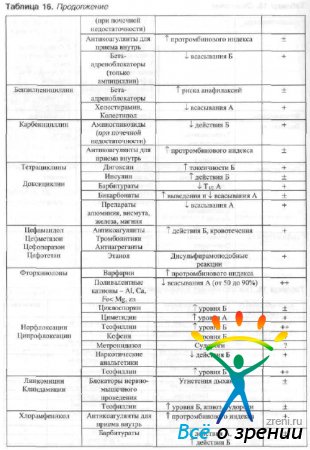
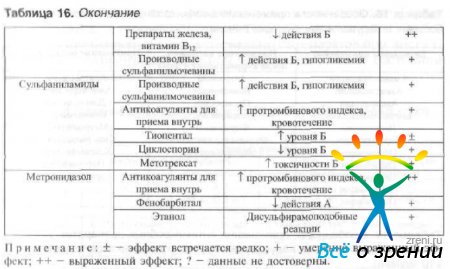
Таблица 16. Лекарственные взаимодействия
При назначении антимикробных препаратов во время беременности и лактации следует учитывать трансплацентарный переход препарата и его способность выделяться с материнским молоком. С грудным молоком не выделяется оксациллин. Такие антибиотики, как гентамицин, колистин, стрептомицин в незначительном количестве проникают в грудное молоко и в плазме крови новорожденных могут определяться небольшие концентрации этих препаратов (до 0,05 мг/л). Ампициллин, бензилпенициллин, эритромицин накапливаются в грудном молоке в значительных концентрациях. Рекомендации по применению препаратов во время беременности указаны в табл. 17.

Таблица 17. Применение антимикробных препаратов во время беременности
При назначении антимикробных препаратов больным с заболеваниями печени и почек важно знать особенности их кинетики. Рекомендации по дозированию антимикробных препаратов у этой группы пациентов представлены в табл. 18 и 19.

Таблица 18. Особенности применения антимикробных препаратов у больных с нарушениями функции печени

Таблица 19. Особенности применения антимикробных препаратов у больных с выраженными нарушениями функции почек (клиренс креатинина <10 мл/мин)
При лечении инфекционных заболеваний глаз антибактериальные препараты используются не только в виде глазных лекарственных форм (глазные капли, мази и пленки), но также широко применяется инъекционное (субконъюнктивальные, парабульбарные, внутримышечные и внутривенные инъекции) и интраокулярное введение лекарственных средств.
При парентеральном введении необходимо учитывать способность препарата проникать через гематоофтальмический барьер. Хорошо через гематоофтальмический барьер проникают хлорамфеникол, сульфаниламиды, пенициллины, аминогликозиды, линкомидин, цефалоспорины, фторхинолоны, плохо проходят барьер тетрациклины, эритромицин, полимиксины. Средние дозы наиболее часто применяемых антибактериальных препаратов при инстилляционном, субконъюнктивальном, интраокулярном и системном применении указаны в табл. 20.
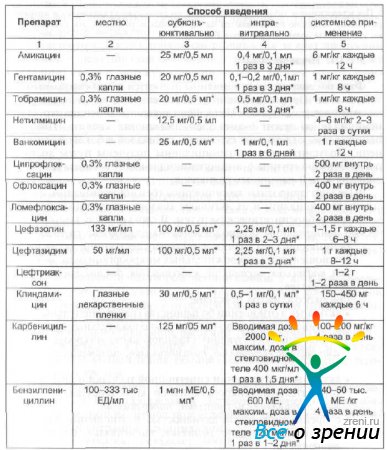
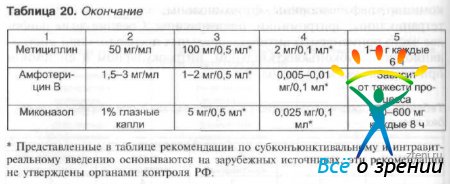
Таблица 20. Средние дозы антибиотиков для взрослых при различных способах введения
Пенициллины
Фармакодинамика : пенициллины относятся к бета-лактамным антибиотикам. Природные пенициллины синтезируются некоторыми видами плесневых грибов (Penicillium notatum). В основе структуры пенициллинов лежит 6-аминоиенициллановая кислота. Гомологи пенициллина отличаются строением радикалов в боковой аминной цепи. Полусинтетические пенициллины получены путем ацетилирования аминогруппы 6-аминопенициллановой кислоты и присоединения к ней различных радикалов.
Выделяют природные пенициллины (бензилпенициллин, феноксиметилпенициллин) и их активные аналоги, полученные синтетическим или биосинтетическим путем. В свою очередь полусинтетические пенициллины подразделяются на следующие группы:
- пенициллиназоустойчивые с преимущественной активностью в отношении грамположительных микроорганизмов: метициллин, нафциллин, оксациллин, клоксациллин, диклоксациллин, флуклоксациллин;
- широкого спектра действия:
- активные в отношении большинства грамотрицательных (кроме синегнойной палочки) и грамположительных (кроме пенициллиназообразующих стафилококков) микроорганизмов: ампициллин, гетациллин, пивампициллин, талампициллин, амоксициллин;
- активные в отношении синегнойной палочки и других грамотрицательных микроорганизмов: карбенициллин, тикарциллин, азлоциллин, мезлоциллин, пиперациллин;
- с преимущественной активностью в отношении грамотрицательных бактерий: мециллин, пивмециллин, бакмециллин, ацидоциллин;
- комбинированные антибиотики: ампиокс;
- кислотоустойчивые антибиотики, но инактивируемые пенициллиназой: фенетициллин, пропициллин.
Спектр антибактериального действия зависит от структуры пенициллинов и отличается у природных и полусинтетических препаратов (более подробно см. табл. 13).
Пенициллины нарушают процесс биосинтеза клеточной стенки за счет прекращения синтеза пептогликана клеточной стенки микроорганизмов. Действуют как на микроорганизмы, находящиеся внутри метки, так и вне клетки. Действие на внутриклеточные микроорганизмы менее выражено.
Резистентность к пенициллинам развивается за счет продукции фермента - пенициллиназы (бета-лактамаза), которая разрушает пептидные связи в молекуле пенициллина и лишает его бактерицидного эффекта.
Некоторые полусинтетические пенициллины устойчивы к действию пенициллиназы, кроме того, для повышения эффективности пенициллиназочувствительных пенициллинов их применяют совместно с ингибиторами пенициллиназы (клавулановая кислота, сульбактам).
Фармакокинетика : пенициллины плохо проникают через гематоофтальмический барьер. Однако на фоне воспалительного процесса их проникновение во внутренние структуры глаза увеличивается, и концентрация пенициллинов в тканях глаза может достигать терапевтически значимого уровня. Пенициллины выделяются преимущественно почками (80% через почечные канальцы, 20% - путем клубочковой фильтрации). В небольшом количестве выделяются с желчью.
При закапывании растворов пенициллинов в конъюнктивальный мешок они обнаруживаются в терапевтической концентрации в строме роговицы, во влагу передней камеры глаза пенициллины при местном применении практически не проникают.
При субконъюнктивальном введении терапевтические концентрации определяются в роговице и влаге передней камеры. В стекловидном теле концентрация пенициллинов находится ниже терапевтического уровня.
При интравитреальном введении период полувыведения составляет около 3 ч. При параллельном системном применении ингибиторов пенициллиназы период полувыведения увеличивается. Минимальная концентрация пенициллина, вызывающая токсическое повреждение сетчатки, составляет 5000 ЕД.
Показания - пенициллины применяются для лечения:
- гонококкового конъюнктивита (бензилпенициллин);
- каналикулитов, особенно вызванных актиномицетами (бензилпенициллин, феноксиметилпениииллин);
- абсцесса и флегмоны орбиты (феноксиметилпениииллин, метициллин, оксициллин, клоксациллин, нафциллин, диклоксациллин, сочетание ампициллина и клавуланата, ампициллина и сульбактама, тикарциллина и клавуланата);
- кератитов (бензилпенициллин, метициллин, оксициллин, ампициллин, тикарциллин, пиперациллин);
- поражения органа зрения при болезни Лайма (бензилпенициллин);
- поражения органа зрения при сифилисе (бензилпенициллин).
Пенициллины применяются также для профилактики инфекционных осложнений при травмах век и орбиты, особенно при проникновении инородных тел в ткани орбиты (сочетание ампициллина и клавуланата, ампициллина и сульбактама, тикарциллина и клавуланата).
Противопоказания : гиперчувствительность к антибиотикам пенициллинового ряда и цефалоспоринам.
Полусинтетические антибиотики противопоказаны при:
- инфекционном мононуклеозе;
- лимфолейкозе;
- нарушениях функции печени;
- бронхиальной астме;
- тяжелых аллергических диатезах (амоксициллин, карбенициллин, ампициллин, оксациллин);
- неспецифическом язвенном колите (карбенициллин).
Особенности применения (следует учитывать, прежде всего, при системном применении).
Амоксициллин в комбинации с метронидазолом не рекомендуется применять у лиц моложе 18 лет.
Безопасность применения карбенициллина в педиатрии не установлена.
Снижение функции почек и метаболической активности у лиц пожилого возраста может потребовать коррекции дозы пенициллинов.
При почечной и/или печеночной недостаточности возможна кумуляция препаратов. При умеренной и тяжелой недостаточности функции почек и/или печени требуется коррекция дозы препаратов и удлинения периодов между введениями.
Применение при беременности возможно только в случае, когда предполагаемая польза для матери превышает потенциальный риск для плода.
При необходимости применения во время лактации следует прекратить грудное вскармливание.
Побочные эффекты :
- Аллергические реакции - крапивница, эритема, отек Квинке, ринит, конъюнктивит. В редких случаях возможно развитие лихорадки, болей в суставах , эозинофилии, в единичных случаях - анафилактический шок.
- Эффекты, связанные с химиотерапевтическим действием - развитие суперинфекции. При системном применении возможно развитие кандидоза полости рта, влагалища, кишечного дисбактериоза.
- Со стороны пищеварительной системы - при системном применении возникает тошнота, рвота, диарея.
- Со стороны ЦНС - тошнота, рвота. Повышение рефлекторной возбудимости, симптомы менингизма, судороги, кома. Нейротоксические эффекты развиваются при применении бензилпенициллина в высоких дозах, особенно при эндолюмбальном введении.
- Со стороны свертывающей системы крови - геморрагический синдром. Наблюдается при применении карбенициллина у пациентов с нарушениями функции почек.
- Со стороны вводно-электролитного обмена - гипонатриемия или гипокалиемия. Наблюдается при применении карбенициллина в высоких дозах.
- Со стороны мочевыделительной системы - гематурия, протеинурия, интерстициальбный нефрит. Наблюдается при применении оксациллина.
- При применении амоксициллина в сочетании с клавуланатом возможно развитие холестатической желтухи.
- Местные реакции - жжение.
Способ применения и дозы : пенициллины в офтальмологии применяются парентерально, внутрь, в виде глазных капель, а также вводятся субконъюнктивально и интравитреально. Дозы при приеме внутрь и парентеральном введении соответствуют средним дозам, применяемым для лечения других бактериальных заболеваний.
В виде глазных капель пенициллины используются для лечения заболеваний конъюнктивы и роговицы. Частота закапываний зависит от тяжести воспалительного процесса.
При умеренно тяжелом инфекционном процессе 1-2 капли препарата закалывают в коньюнктивальный мешок каждые 4 ч или полоску мази длиной 1,5 см закладывают за нижнее веко пораженного глаза 2-3 раза в день. В случае развития тяжелого инфекционного процесса препарат закапывают каждый час или мазь закладывают за нижнее веко каждые 3-4 ч. По мере уменьшения явлений воспаления уменьшают частоту инстилляций препарата. Длительность применения не более 14 дней.
Для промывания слезных путей при лечении каналикулитов используют растворы пенициллинов.
Растворы для местного применения готовятся ex temporae.
- Бензилпенициллин (Benzylpenicillin) [МНИ]
В конъюнктивальный мешок закапывают раствор, содержащий 100 000-333 000 ЕД/мл (в педиатрии для лечения гонобленнореи у новорожденных применяют растворы, содержащие 10 000-20 000 ЕД/мл). Для приготовления раствора для инстилляций растворяют 500 000 ЕД в 5 мл физиологическою раствора. Для приготовлении раствора, используемого для инстилляций в педиатрии, 250 000 ЕД растворяют в 5 мл физиологического раствора, далее берут 1 мл полученного раствора и добавляют физиологический раствор до 5 мл.
Субконъюнктивально вводят 0,5-1 млн ЕД/0,5 мл.
Интравитреально вводят не более 2000 ЕД бензилпенициллина. Для приготовления раствора для интравитреального введения 250 000 ЕД растворяют в 5 мл физиологического раствора, далее берут 1 мл полученного раствора и добавляют физиологический раствор до 12 мл. Интравитреально вводят не более 0,5 мл получен нога раствора. Параллельно внутрь назначают пробенецид по 0,5 г 4 раза в день.
- Метициллин (Methicillin) [МНН]
В конъюнктивальный мешок закапывают раствор, содержащий 50 мг/мл.
Субконъюнктивально вводят 75-100 мг/0,5 мл.
Интравитреалыю вводят не более 2 мг метициллина. Параллельно внутрь назначают пробенецид по 0,5 г 4 раза в день.
- Океациллин (Oxacillin) [МНН]
В конъюнктивальный мешок закапывают раствор, содержащий 66 мг/мл. Для приготовления раствора для инстилляций 250 мг вещества растворяют в 4 мл физиологического раствора.
Субконъюнктивально вводят 75-100 мг/0,5 мл. Для приготовления раствора 250 мг вещества растворяют в 2 (1.5) мл физиологического раствора или 500 мг вещества растворяют в 3,0 (2,5) мл физиологического раствора.
Интравитреально вводят не более 500 мкг оксациллина. Для приготовления раствора для интравитреального введения 250 мг вещества растворяют в 5 мл физиологического раствора, далее берут 1 мл полученного раствора и добавляют физиологический раствор до 10 мл. Далее берут 1 мл полученного раствора и добавляют физиологический раствор до 5 мл. Интравитреально вводят не более 0,5 мл полученного раствора.
- Ампициллин (Ampicillin) [МНН]
В конъюнктивальный мешок закапывают раствор, содержащий 50 мг/мл. Для приготовления раствора для инстилляций 250 мг вещества растворяют в 5 мл физиологического раствора.
Субконъюнктивально вводят 100 мг/0,5 мл. Для приготовлении раствора 250 мг вещества растворяют в 1,5 мл физиологического раствора или 500 мг вещества растворяют в 2,5 мл физиологического раствора.
Интравитреально вводят не более 5000 mkг ампициллина. Для приготовления раствора для интравитреального введения 250 мг растворяют в 5 мл физиологического раствора, далее берут 1 мл полученного раствора и добавляют физиологический раствор до 5 мл. Интравитреально вводят не более 0,5 мл полученного раствора.
- Тикарциллин (Ticarcillin) [МНН]
В коньюнктивальный мешок закапывают раствор, содержащий 6-20 мг/мл.
Субконъюнктивально вводит 100 мг/0,5 мл.
- Пинерациллин (Piperacillin) [МНН]
В конъюнктивальный мешок закапывают раствор, содержащий 6-20 мг/мл. Для приготовления раствора для инстилляций 2 г вещества растворяют в 10 мл физиологического раствора. Далее берут 1 мл порученного раствора и добавляют физиологический раствор до 10 мл.
Субконъюнктивально вводят 100 мг/0,5 мл. Для приготовления раствора 2 г вещества растворяют в 5 мл физиологического раствора.
- Карбенициллин (Carbenicillin) [МНН]
Интравитреально вводят не более 1000-2000 мкг карбенициллина. Для приготовления раствора для интравитреального введения 1 г вещества растворяют в 10 мл физиологического раствора, далее берут I мл полученного раствора и добавляют физиологический раствор до 10 мл. Далее берут 1 мл полученного раствора и добавляют физиологический раствор до 5 мл. Интравитреально вводят не более 0,5 мл полученного раствора.
Взаимодействие с другими лекарственными препаратами.
При совместном применении с бактериостатическими препаратами (макролиды, хлорамфеникол, линкозамиды, тетрациклины, сульфаниламиды) бактерицидное действие снижается.
Пенициллины (ампициллин, оксациллин) уменьшают эффективность контрацептивов для приема внутрь . Пробенецид, диуретики, аллопуринол, фенилбутазон, НПВС могут повысить плазменную концентрацию пенициллинов. Антациды, глюкозамин, слабительные средства и аминогликозиды замедляют всасывание пенициллинов для приема внутрь. Пенициллины для приема внутрь усиливают действие непрямых антикоагулянтов. Карбенициллин усиливает антиагрегантные свойства НПВС.
Фармацевтическая несовместимость имеет место при комбинации аминогликозидов и карбенициллина.
Комбинация пенициллинов с бактерицидными антибиотиками и ингибиторами пенициллиназы приводит в большинстве случаев к изменению активности. Оптимальной комбинацией является сочетание пенициллинов и аминогликозидов, цефалоспоринов, циклосерина, ванкомицина, рифампицина, клавулановой кислоты, сульбактама.
Препараты
- Бензилпенициллин натриевая соль (Benzylpenicillin sodium salt) (Россия) - порошок для приготовления раствора для инъекций 250 000, 500 000 и 1 000 000 ЕД;
- Оксациллин (Oxacillin) (Россия) - порошок для приготовления раствора для инъекций по 250 и 500 мг;
- Пипрацил (Pipracil) (фирма Lederle, США) - порошок для приготовления раствора для инъекций по 2 и 4 г пиперациллина;
- Карбенициллина натриевая соль (Carbenicillin sodium salt) (Россия) - порошок для приготовления раствора для инъекций 1 г.
В практике лечения инфекционных больных используется огромное количество этиотропных средств. Это связано с тем, что появляются высокопатогенные штаммы возбудителей и возникает лекарственная устойчивость их к противобактериальным препаратам, а также с изменением резистентности макроорганизма и вторичным иммунодефицитом. Для правильного применения лекарственных средств и получения желаемых результатов надо владеть знаниями свойств препаратов, придерживаться принципиальных установок отечественной науки лечения инфекционных заболеваний. Без этого практическому врачу трудно ориентироваться во множестве антибактериальных средств и в различных методах их применения. Основные положения лечения больных инфекционными заболеваниями, с точки зрения клинициста, сформулированы еще А.Ф. Би-либиным (1958). Наибольшее внимание уделялось не только выбору антибиотика, методу его введения, но и, что особенно важно, инфекционному процессу, подчиненному трем факторам: «возбудителю, макроорганизму и окружающей среде».
В настоящее время успехи микробиологии, достижения фармакокинетики позволяют выбрать антибиотики с выраженным противомикробным действием и «узкой» направленностью, что снижает опасность диз-бактериоза.
В данном разделе представлены общие и частные положения по использованию противомикробных средств. В отличие от уже опубликованных сведений [Ю. В. Лобзин и др., 1998] в этой работе дополнительно приведены нежелательные эффекты взаимодействия антибактериальных препаратов и других лекарственных средств, а также клинические аспекты антибактериальной терапии инфекционных больных.
В настоящее время определенное значение, помимо данных об эффективности химиопрепаратов, приобретает их возрастающая стоимость, что нередко может влиять на выбор антибиотика.
Выполнение основных требований к применению антибактериальных средств, изложенных в «Руководстве», призвано способствовать успешному лечению инфекционных больных.
Антибактериальные средства существенно влияют на течение и исходы большинства инфекционных заболеваний. Поэтому комплексное лечение инфекционных больных должно быть направлено в первую очередь на возбудителя болезни. Назначение препаратов обосновывается этиологией заболевания, его патогенезом с учетом физиологических особенностей организма, тяжестью и периодом болезни.
Для воздействия на возбудителя проводят химиотерапию и антибио-тикотерапию. Под химиотерапией понимается антимикробное, антипаразитарное лечение при помощи химических веществ. Этот термин введен, чтобы принципиально выделить антимикробную терапию из фармакотерапии вообще. Сущность антибиотикотерапии заключается в лечении препаратами природного происхождения, продуцируемыми микроорганизмами; это лечение направлено на подавление роста или уничтожение болезнетворных микробов при инфекционных заболеваниях. Многие современные антибиотики являются полусинтетическими, т.е. созданы путем видоизменения первоначальной молекулы.
Первым из противомикробных препаратов в клинической практике был использован сульфаниламид (1936). Чуть позже, в 1941 г., в Оксфордском университете А. Флемингом был получен и впервые с успехом применен пенициллин. Сегодня число естественных, полусинтетических и синтетических антибактериальных препаратов измеряется тысячами. Однако на практике могут быть использованы лишь десятки антибиотиков, которые мало токсичны и, одновременно, имеют выраженный антибактериальный эффект. Большое количество антибиотиков обусловлено многообразием патогенных и условнопатогенных бактерий.
Классификация антибиотиков.
Современная классификация антибиотиков разработана в Государственном центре по антибиотикам [С. М. Навашин, 1994], в соответствии с которой они характеризуются по механизму действия, химической структуре, противомикробному спектру, типу действия на клетку.
С учетом механизма действия антибиотики разделяют на три основные группы:
» ингибиторы синтеза клеточной стенки микроорганизма (пенициллины, цефалоспорины, ванкомицин, тейкопланин и др.);
» антибиотики, нарушающие молекулярную организацию, функции клеточных мембран (полимиксин, нистатин, леворин, амфотерицин и др);
» антибиотики, подавляющие синтез белка и нуклеиновых кислот, в частности ингибиторы синтеза белка на уровне рибосом (хлорамфеникол, тетрациклины, макролиды, линкомицин, аминогликозиды) и ингибиторы РНК-полимеразы (рифампицин) и др. По химическому строению выделяют следующие группы антибиотиков: беталактамы (пенициллины, цефалоспорины и др.), аминогликозиды, хлорамфеникол, тетрациклины, фузидин, ансамакролиды (рифампи-цины), полимиксины, полиены, макролиды и др.
В зависимости от типа воздействия на микробную клетку антибиотики классифицируют на две группы:
» бактерицидные (пенициллины, цефалоспорины, аминогликозиды,
рифампицин, полимиксины и др.);
» бактериостатические (макролиды, тетрациклины, линкомицин,
хлорамфеникол и др.).
Для инфекциониста-клинициста особенно важно знать спектр противомикробного действия антибиотиков, так как с его учетом определяется выбор антибиотика.
По спектру противомикробного действия антибиотики разделяют на следующие группы.
1. Препараты, действующие на грамположительные бактерии и кокки: биосинтетические пенициллины, изоксазолпенициллины (оксациллин), линкозамиды, ванкомицин, фузидин.
2. Антибиотики, активные в отношении грамотрицательных бактерий: азтреонам, полимиксины.
3. Антибиотики широкого спектра действия, активные в отношении грамположительных и грамотрицательных бактерий: аминопенициллины (ампициллин), карбенициллин, уреидопенициллины (пиперациллин), цефалоспорины, аминогликозиды, левомицетин, тетрациклины, макролиды, рифамицины, карбапенемы (имипенем, морепенем), фосфомицин.
4. Противотуберкулезные антибиотики (стрептомицин, рифампицин, флоримицин).
5. Противогрибковые антибиотики (нистатин, леворин, гризеофульвин, амфотерицин В, кетоконазол, анкотил, дифлюкан и др.).
Вышеперечисленные свойства в основном и диктуют выбор антибиотика для лечения инфекционного больного. При этом обязательно учитываются фармакодинамика и фармакокинетика препарата, индивидуальные особенности больного (возраст, состояние иммунитета, сопутствующие заболевания и др.).
Эффективность лечения антибиотиками при своевременном их назначении во многом определяется следующими факторами:
» этиологической диагностикой заболевания, клинической диагностикой нозологических форм инфекционного заболевания, выделением возбудителя болезни с последующим определением его чувствительности к антибиотикам;
» выбором наиболее активного и в то же время наименее токсичного
для конкретного больного препарата;
» определением оптимальной дозы антибиотика, метода его введения для создания концентрации в очаге инфекции, в 2-3 раза превышающей минимальную подавляющую концентрацию (МПК) для данного микроба;
» знанием и учетом возможных побочных реакций на антибиотик; » применением по соответствующим показаниям комбинации препаратов с целью расширения спектра их действия и/или усиления противомикробного эффекта.
Фармакокинетика и фармакодинамика антибиотиков. Фармакокинетика - раздел фармакологии, изучающий пути поступления, распределения и метаболизм лекарственных веществ в организме, а также их выведение.
Фармакодинамика - раздел фармакологии, изучающий реакцию органов, тканей или организма в целом и величину этой реакции в ответ на введенный препарат, а также характеристику активности антибиотиков по отношению к возбудителям болезни.
Клиническая эффективность антибиотика во многом определяется его распределением в органах и тканях, способностью проникать через физиологические и патологические барьеры организма. Она может изменяться при печеночно-клеточной недостаточности, при нарушении выделительной функции почек и т.д. Судьба антибиотиков в организме определяется их метаболизмом и степенью связывания белками. Предпосылкой для хорошего терапевтического действия является также достаточная всасываемость. Кроме того, в организме антибиотики подвергаются ферментативному воздействию (метаболизму), в результате чего образуются неактивные, а иногда токсичные продукты.
Процесс взаимодействия введенного в организм антибиотика с «мишенями» подразделяется на три главные хронологические фазы: фармакоцевтическую, фармакокинетическую и фармакодинамическую.
В фармакоцевтинеской фазе происходит дезинтеграция лекарственной формы за счет растворения, высвобождения активного и действующего вещества, которое становится доступным для всасывания. В результате взаимодействия антибиотиков и химиопрепаратов с ингредиентами пиши и пищеварительными соками часть лекарственных средств может подвергнуться различным видоизменениям, в том числе инактивированию. Связывание пищевых компонентов с лекарственными препаратами происходит, в основном, в желудочно-кишечном тракте, где образуются нерастворимые или слаборастворимые, плохо всасывающиеся в кровь соединения. Антибиотики тетрациклинового ряда связываются с кальцием (в том числе с кальцием молока, творога и других молочных продуктов), сульфаниламиды - с белками пищи. Всасывание сульфадиметоксина, сульфаметоксипиридазина и других сульфаниламидов существенно замедляется в первые 3 ч с момента приема пищи. Однако через 6, 8 и 27 ч концентрация сульфаниламидов в крови становится одинаковой у всех, принявших эти препараты как натощак, так и сразу после еды. Под влиянием пищи снижается в количественном отношении всасывание тетрациклинов, пенициллина, эритромицина, рифампицина, хлорамфеникола и других препаратов. Пища, богатая солями железа, также как и препараты неорганического железа, принятые вместе с препаратами тетрациклинового ряда, вызывают торможение всасывания этих антибиотиков, что приводит к снижению их концентрации в крови на 50% и более. Из этого следует, что в период лечения тетрациклином необходимо воздержаться от приема препаратов железа и пищи, богатой солями железа. Фурадо-нин, введенный вместе с жирной пищей, дольше задерживается в желудке, где растворяется и распадается, что приводит к уменьшению его концентрации в кишечнике, а в итоге - к снижению терапевтической активности. В то же время прием пищи не оказывает влияние на всасывание цефалексина, левомицетина и других антибиотиков.
Предлагаемые в различных справочниках рекомендации о времени приема антибиотиков и химиопрепаратов не могут быть однозначными, а должны быть использованы с учетом многих моментов и, в частности, индивидуальных особенностей больного, характера болезни, функционального состояния системы пищеварения, лекарственной формы и физико-химических свойств лекарственного средства.
В фармакокинетической фазе происходит всасывание, распределение, метаболизм, экскреция препарата. В эту фазу антибиотик оказывает биологическое воздействие на возбудителя. Фаза длится от момента появления лекарства в крови до его исчезновения из нее.
При внутрисосудистом введении антибиотика происходит непосредственный контакт с циркулирующим в крови возбудителем, более быстрое проникновение в очаг инфекции. Если антибиотик вводят подкожно или внутримышечно, то скорость всасывания находится в прямо пропорциональной зависимости от его растворимости в воде и липидах. При парентеральном введении антибиотиков их биодоступность также во многом зависит и от скорости преодоления барьеров, таких как, например, гематоэнцефалического. Проницаемость гематоэнцефалического барьера для пенициллина, тетрациклина, цефалоспоринов ограничена. Концентрация антибиотиков может снижаться в очагах инфекции (синуситы, абсцессы и пр.) в силу снижения их проникновения через воспалительные биологические барьеры [Ю. П. Финогеев и др., 1976]. В связи с этим более эффективным может оказаться введение химиотерапевтических средств и антибиотиков непосредственно в очаг инфекции, например в виде аэрозолей при заболевании органов дыхания [Ю. П. Финогеев, 1980], в растворах - в полость амебных абсцессов печени [В. М. Волжанин, 1992].
В фармакодинамическоп фазе происходит взаимодействие антибиотика (химиопрепарата) с микроорганизмом при достижении определенной биологической активности. Продолжительность 3-й фазы - от нескольких часов до нескольких суток (отдельные антибиотики и сульфаниламиды пролонгированного действия).
Сила действия лекарств (антибиотиков) определяется следующими факторами:
» дозированной лекарственной формой, обеспечивающей соответствующую фармакоцевтическую доступность лекарственного вещества;
» количеством антибиотика; целостностью его в тканях, органе (в очаге инфекции), что обусловлено скоростью его метаболизма и элиминации.
Временные интервалы между приемами лекарств, длительность лечения зависят также от фармакокинетики и фармакодинамики препаратов. Следует всегда помнить, что любой химиопрепарат и антибиотик являются чужеродными для организма, поэтому иногда их называют ксенобиотиками, а также что химиотерапевтические вещества не всегда индифферентны к макроорганизму.
Выбор антибиотика при лечении больных бактериальными инфекциями. Основным показанием к антибактериальной терапии инфекционного больного является присутствие в организме такого бактериального возбудителя, с которым организм сам не в силах справиться, или при котором возможны значительные осложнения. При этом главное и решающее в выборе антибактериального средства - это возбудитель и его чувствительность к избранному препарату [В. Г. Бочоришвили, 1988].
В большинстве случаев начальную антибактериальную терапию проводят эмпирически. Однако до назначения антибактериального препарата обязателен отбор материала (кровь, цереброспинальная жидкость, слизь из миндалин и т.п.) для бактериологического исследования, т.е. выделения возбудителя болезни и определения его чувствительности к антибиотикам. При установлении клинического диагноза заболевания можно выбрать препарат, наиболее эффективный при данной инфекции (брюшной тиф, псевдотуберкулез, рожа, дифтерия, лептоспироз и др.). Менингиты, пневмонии, сепсис, госпитальные инфекции и некоторые другие патологические состояния могут быть вызваны различными возбудителями, поэтому после назначения эмпирической терапии необходимо тщательно контролировать динамику процесса и проводить повторные бактериологические исследования, чтобы точно идентифицировать возбудителя и, тем самым, сделать антибактериальную терапию целенаправленной с учетом чувствительности выделенного микроорганизма с предпочтением препаратам с узким спектром действия.
Больным в тяжелом состоянии антибактериальную терапию назначают неотложно, при неуточненной этиологии используют препараты с широким спектром действия, в некоторых случаях применяют комбинацию препаратов. Больным с иммунодефицитом предпочтительнее назначать препараты бактерицидного действия: беталактамы, аминогликози-ды, ванкомицин, фосфомицин, фторхинолоны и др.
Рекомендации по оптимальному выбору антибиотиков в зависимости от этиологии инфекционного заболевания приведены в табл. 3, 4 и 5.
Антибактериальные средства для лечения инфекционных заболеваний, вызываемых грамположительными и грамотрицятельными кокками
Таблица 3
Таблица 4


Клиницисту всегда необходимо проводить корреляцию данных лабораторного
исследования с клиническим течением заболевания в динамике, а также учитывать
возможную смену возбудителя и особенно изменение его чувствительности к
антибиотику (пневмония, сепсис и др.).
Следует указать, что чувствительность возбудителей к антибиотикам может
варьировать в широких пределах в различных регионах в зависимости от применяемых
в течение длительного времени определенных антибиотиков, от состояния макроорганизма
и других факторов. Реакция органов и тканей или организма в целом на введенный
препарат зависит не только от химических особенностей действующего вещества,
но и от его взаимодействия с теми или иными реагирующими органами.
Нередко в клинической практике инфекционисты используют комбинированную
антибиотикотерапию. Основные показания к ее проведению следующие:
» смешанные инфекции;
» необходимость предупреждения развития устойчивости микроорганизмов
к антибиотику;
» целесообразность усиления антибактериального эффекта;
» недостаточная чувствительность возбудителей к моноантибиотикам.
Возможны следующие варинты взаимодействия антибиотиков при сочетанном
их применении:
» индифферентное действие - изменение эффекта каждого из противомикробных
средств не отмечается (левомицитин + эритромицин);
» аддитивное действие (суммация) - антибактериальный эффект применяемых
препаратов равен сумме действия каждого из них в отдельности, независимо
один от другого (ампициллин + оксациллин);
» синергидное действие - эффект совместного применения двух антибиотиков
превышает простую суммацию действия каждого препарата в отдельности (беталактамы
+ аминогликозиды);
» антагонистическое действие - эффект, достигаемый при сочетании нескольких
препаратов, ниже, чем эффект каждого в отдельности (беталактамы + тетрациклины).
Антагонистическое взаимодействие
антибиотиков объясняется их
механизмом действия на микробную клетку. Беталактамы, ванкомицин и фосфомицин
действуют на микроорганизмы только во время митоза и поэтому одновременное
назначение бактериостатиков, которые нарушают деление микробных клеток,
может лишить бактерицидные антибиотики субстрата, на который направлено
их действие. Оптимальной является комбинация двух бактерицидных антибактериальных
средств.
При сочетании различных антибиотиков бактерицидного типа случаев антагонизма,
как правило, не наблюдается. Комбинация бактериостатических и бактерицидных
препаратов иногда приводит к их антагонизму.
Известно, что свойства микрофлоры под влиянием антибиотиков изменялись,
претерпели трансформацию взгляды на механизмы резистентности, появилась
множественная резистентность. Это осложнило принятие решения по применению
комбинации различных антибиотиков. Однако на практике врач не должен полностью
отказываться от рекомендуемых в справочниках и руководствах их сочетаний.
При этом необходим всесторонний учет свойств возбудителей инфекций. Однако
все же следует иметь в виду, что приоритетной является моноантибиотикотерапия,
при которой предпочтительнее назначение препаратов более узкого спектра
действия, особенно в случаях продолжительного лечения. При назначении комбинации
антибиотиков целесообразно пользоваться таблицами их совместимости. Они
при определенной условности помогут избежать неблагоприятных (снижения
эффективности и др.) последствий.
Взаимодействие антибиотиков с другими лекарственными препаратами. На
выбор антибактериальных средств влияют особенности их фармакокинетики и
фармакодинамики: проникновение через гематоэнцефалический барьер, изменение
активности в зависимости от рН.
При лечении бактериальных инфекций с внутриклеточной локализацией возбудителя
следует учитывать разную степень проникновения антибактериальных препаратов
в клетку. Аминогликозиды проникают в клетку в незначительном количестве
и проявляют в ней низкую антибактериальную активность. Макролиды и фторхинолоны
хорошо проникают в цитоплазму и вакуоли клеток и оказывают антибактериальный
эффект на внутриклеточные бактерии. Беталактамы проникают только в цитоплазму
клеток и за малым исключением имеют низкую внутриклеточную активность .
При инфекциях центральной нервной системы важно, чтобы антибактериальный
препарат проникал через гематоэнцефалический барьер, через который хорошо
проникают левомицетин, сульфаниламиды, котримоксазол, нитроимидазолы, флуконазол.
Проникают только при воспалении - бензилпенициллин, ампициллин, оксациллин,
пиперациллин, цефуроксим, цефтриаксон, цефотаксим, цефтазидим, цефпиром,
меропенем, азтреонам, амикацин, канамицин, ванкомицин, доксициклин, пефлоксацин,
офлоксацин, ципрофлоксацин.
При лечении тяжелых больных следует иметь в виду, что активность аминогликозидов
при ацидозе и гипоксии снижается.
Путь введения препарата определяется его биоусвояемостью, под которой
подразумевается та часть препарата, которая после приема внутрь попадает
в системный кровоток в активной форме.
Антибактериальные препараты с биоусвояемостью более 60%: левомицетин,
доксициклин, флуклоксациллин, аминопенициллины (кроме ампициллина), энтеральные
формы цефалоспоринов, фузидин, фосфо-мицин, рифамицины, фторхинолоны (кроме
норфлоксацина), котримоксазол, нитроимидазолы должны при возможности назначаться
энтераль-но, так как высокая биоусвояемость обеспечивает близость доз энтераль-ного
и парентерального введения препарата при минимальной опасности нежелательных
явлений, простоте и экономической эффективности.
Антибактериальные препараты с биоусвояемостью 30-60% более эффективны
при парентеральном введении (оксациллин. клоксациллин, ампициллин, линкозамиды),
применяют внутрь при высокой чувствительности к ним возбудителя (тетрациклин,
метациклин, макролиды, феноксиметилпенициллин, норфлоксацин, нитрофураны).
Антибактериальные препараты с биоусвояемостью
менее 30% - аминогликозиды,
уреидопенициллины, инъекционные формы цефалоспоринов, карбапенемы, азтреонам,
ванкомицин применяют парентерально. При приеме внутрь они дают лишь местный
эффект [И. Б. Михайлов, 1998].
Режим дозирования
антибиотиков (аминогликозиды), активность
которых зависит главным образом от их концентрации (concentration dependent
killing drugs), заключается в создании возможно бульших пиков концентрации
препарата в крови, близких к токсическим [С. Н. Nightingall, 1998]. Рекомендуется
однократное введение всей суточной дозы аминогликозидов, как правило, внутривенно
капельно. При этом высокая пиковая концентрация антибиотика обеспечивает
максимальное уничтожение бактерий, меньшую суммарную токсичность, является
более удобной для больного, медперсонала и экономичной [Л. С. Страгунский,
С. Н. Козлов, 1998].
При использовании антибиотиков групп беталактамов, макролидов и линкозамидов,
активность которых в основном зависит от длительности сохранения концентрации
(time dependent killing drugs), необходимо постоянно поддерживать концентрацию
этих препаратов в крови выше уровня МПК между их введениями . Частота введения этих антибиотиков, как правило, зависит от периода
полувыведения (Ti/2), который в значительной степени определяет время сохранения
необходимой концентрации препарата в крови после однократного введения.
При введении постоянной поддерживающей дозы препарата при одинаковом интервале
введения в среднем через 4-5 Ti/2 в плазме крови создается его равновесная
концентрация. Так Ti/2 бензилпенициллина - 1 ч, поэтому он должен вводиться
каждые 4 часа. Лечебный эффект от применения бактерицидных антибактериальных
препаратов наступает через 1-2 дня, бактериостатических - через 3-4 дня.
Через это время проводят оценку клинического эффекта антибактериального
средства.
Продолжительность антибактериальной терапии зависит от клинического
течения нозологической формы. При циклических, но рецидивирующих инфекциях
(сыпной тиф) антибактериальный препарат можно отменить через 1-2 дня после
получения клинического эффекта. При циклических, но рецидивирующих болезнях
(брюшной тиф, псевдотуберкулез) антибактериальное лечение продолжают столько
времени, сколько болезнь продолжалась бы без этиотропной терапии. При ациклических
инфекциях, к числу которых относится сепсис, а также большинство заболеваний,
вызванных условно-патогенной флорой, антибактериальные препараты назначают
в эмпирически установленные оптимальные сроки, с учетом клинического выздоровления.
При лечении антибактериальными препаратами необходимо иметь в виду
вторичную резистентность микроорганизмов. К беталактамам, тетрациклинам,
линкозамидам, левомицетину, ванкомицину, фосфомицину, фторхинолонам, нитрофуранам,
нитроимидазолам вторичная устойчивость развивается медленно («пенициллиновый»
вид резистентности). К аминогликозидам, макролидам, рифамицинам, фузидину,
производным 8-оксихинолина и хинолонам I-II поколения вторичная резистентность
развивается быстро («стрептомициновый» вид резистентности). Поэтому эти
препараты следует назначать курсом не более 5-7 дней или комбинировать
с другими антибактериальными препаратами [И. Б. Михайлов, 1998].
Взаимодействие антибиотиков с другими лекарственными препаратами при
одновременном применении может в конечном итоге оказывать как положительный,
так и отрицательный результат.
Так, препаратом выбора для лечения менингококкового менингита является,
как известно, бензилпенициллин. Необходимая терапевтическая концентрация
пенициллина в центральной нервной системе обычно обеспечивается применением
его в мегадозах (200 000-500 000 ЕД на 1 кг массы тела в сутки). В то же
время оптимальная суточная доза антибиотика зависит от его сочетания с
различными патогенетическими средствами, которые могут уменьшать концентрацию
пенициллина в цереброспинальной жидкости (антагонистический фармакокинетический
эффект) или увеличивать ее (синергидный фармакокинетический эффект). Например,
сочетание пенициллина с комплексом препаратов-синергистов (кофеин с эуфиллином
или баралгин вместе с фуросемидом и изотоническими растворами) позволяет
получить оптимальный терапевтический эффект у больных менингококковым менингитом
при снижении суточной дозы пенициллина в 2 раза за счет повышения его проницаемости
через гематоэнцефалический барьер [К. С. Иванов, 1982]. В то же время антагонистический
эффект при лечении менингита пенициллином наблюдается от применения осмотических
диуретиков (маннитол, мочевина), гипертонических растворов, глюкокортикостероидов.
Это объясняется усилением экскреции пенициллина с мочой, снижением проницаемости
гематоэнцефалического барьера при гормональной терапии за счет ее противовоспалительного
действия. Однако совместное введение некоторых антибиотиков (канамицина)
с глюкокортикостероидами (гидрокортизон) приводит к более продолжительному
сохранению высокой концентрации их в крови [К. С. Иванов и др., 1976].
При планировании комплексной этиопатогенетической терапии
необходимо
учитывать взаимное усиление возможных побочных (нежелательных) эффектов
антибиотиков, патогенетических средств и алкоголя. Данные о несовместимости
лекарственных веществ с антибиотиками приводятся в табл. 6, 7. Комбинации
указанных препаратов не рекомендуют для применения на практике, поскольку
они в той или иной степени неблагоприятны для пациентов. К лицам повышенного
риска побочного действия комбинаций лекарств с антибиотиками относят пожилых
людей, а также страдающих недостаточностью функции почек и печени. Эти
пациенты при инфекционных заболеваниях, как правило, получают терапию по
поводу сопутствующей патологии, когда особенно необходимо учитывать возможность
взаимодействия антибиотиков, химиопрепа-ратов с другими лекарственными
средствами. В группу лекарственных веществ, комбинации которых с антибиотиками
необходимо особо внимательно контролировать, включают антикоагулянты, антидиабетические
вещества, соли металлов, диуретики, нестероидные противовоспалительные
средства и другие препараты.
Оценка эффективности антибиотикотерапии.
В практике клинициста
нередко возникает ситуация, когда необходимо назначить антибактериальную
терапию до определения окончательного диагноза заболевания, уточнения его
этиологии (выделения возбудителя болезни и определения чувствительности
к антибиотикам и химиопрепаратам). В подобных случаях используют принцип
стартовой антимикробной терапии.
Нежелательные эффекты при взаимодействии антибиотиков с различными лекарственными средствами (по В. Е. Новикову, 1994)


Основным критерием эффективности
антибактериальной терапии чаще
всего являются уменьшение степени интоксикации с понижением температуры
тела. Наряду с клиническим контролем динамики инфекционного процесса используют
бактериологические приемы - выделение возбудителя, количественное и качественное
определение его чувствительности к антибиотикам, сопоставление фармакодинамических
и фармакокинетических показателей.
При целенаправленной терапии бактериальных инфекций идеальным является
применение методов бактериологической диагностики заболевания и знание
антибиотикограммы. Только таким образом можно сделать правильный выбор
наиболее эффективного препарата среди многих близких по спектру действия.
Это особенно важно в связи с широким распространением антибиотикоустойчивых
штаммов микроорганизмов.
Чувствительность микроорганизмов к антибиотикам. Некоторые возбудители
инфекционных заболеваний со времени открытия антибиотиков мало изменили
характер первоначальной чувствительности к этим препаратам (стрептококки
группы А, пневмококки, менингококки, бру-целлы, некоторые сальмонеллы).
Вместе с тем большинство патогенных микробов со временем приобрело
устойчивость к широко, подчас неконтролируемо и необоснованно, применяемым
противомикробным средствам. Наибольшее значение проблема устойчивости микроорганизмов
имеет в отношении стафилококков, шигелл, эшерихий, протея, среди которых
антибиотикоустойчивые штаммы выделяются с наибольшей частотой.
По степени чувствительности к основным антибиотикам микробы подразделяются
на чувствительные, умеренно чувствительные и устойчивые. В группу чувствительных
входит большинство штаммов микроорганизмов, рост которых на питательных
средах прекращается при использовании концентраций, соответствующих средним
терапевтическим дозам антибиотиков. Если он угнетается при применении только
максимальных доз препаратов, то такие микроорганизмы умеренно чувствительны
к антибиотику. Если подавление роста достигается в опыте в лаборатории
лишь при очень высоких концентрациях препарата, которые нельзя создать
в организме, то такие возбудители инфекции относятся к устойчивым к антибиотику.
Для определения чувствительности микробов к антибиотикам
существует
ряд методов: метод последовательных разведении в жидкой питательной среде
или питательном агаре, метод диффузии в агар, метод дисков, насыщенных
антибиотиками и ускоренные методы. Метод дисков прост, широко используется,
но дает лишь качественный ответ. Более надежным и точным количественным
методом является метод последовательных разведении антибиотиков в питательной
среде в стандартных условиях опыта. В большинстве случаев корреляция данных
лабораторных исследований с клиническими бывает достаточно полной, а терапия
- эффективной при изучении в динамике не только клинического течения процесса,
но и возможной смены возбудителя или его чувствительности к антибиотикам.
Концентрацию антибиотиков в тканях и жидкостях организма, как и их
антимикробную активность, относятся к основным параметрам, определяющим
эффективность антибиотикотерапии. При ее изучении наиболее широко применяют
микробиологические методы исследования, основанные на способности антибиотика
задерживать рост тест-микроба. Среди микробиологических методов определения
концентраций антибиотиков в жидкостях и тканях организма наибольшее распространение
получили метод диффузии в агар и метод серийных разведении в жидкой питательной
среде.
В настоящее время созданы микробиологические системы автоматизированной
и полуавтоматизированной идентификации и оценки анти-биотикоустойчивости,
позволяющие существенно ускорить бактериологический анализ, повысить степень
его точности. Имеются ускоренные физико-химические и химические методы
(иммуноферментный, иммунофлюоресцентный и др.) изучения фармакокинетики
антибиотиков, помогающие быстро оптимизировать схемы лечения, индивидуализировать
их и повысить эффективность этиотропной терапии.
При выборе антибиотика должны быть использованы сведения о минимальных
подавляющих концентрациях для отдельных возбудителей болезни, которые могут
быть разными по отношению как к виду микроба, так и к различным тканям
(средам) организма больного. На практике терапевтическая активность достигается
при назначении антибактериальных препаратов в дозах, обеспечивающих более
высокий их уровень в средах преимущественного обитания и возбудителей болезни.
Причины отсутствия эффекта антибактериальной терапии. Неудачи антибиотикотерапии
связаны, прежде всего, с тем, что лечение проводится без учета чувствительности
возбудителей инфекционного заболевания к назначенному препарату, при этом
не соблюдается индивидуальная тактика антибиотикотерапии. Кроме того, неудачи
лечения могут быть обусловлены неправильным выбором доз и методов введения
препарата, поздним началом лечения, применением антибиотиков в заниженных
дозах при комбинированной терапии, недостаточностью продолжительности курса.
Не всегда принимается во внимание возможность инактивации препаратов ферментными
системами организма, связывания их белками крови и тканей. Даже при должной
чувствительности возбудителя к антибиотику возможны неудовлетворительные
результаты лечения из-за плохого проникновения препарата в очаг инфекции
вследствие недостаточного кровоснабжения, образования биологического барьера
(грануляционного вала, наличия фибринозных наложений, некроза тканей и
т.п.) вокруг очага инфекции, неблагоприятных условий всасывания при гене-рализованном
капилляротоксикозе.
В настоящее время существует понятие «химиотерапевтическая резистентность
макроорганизма», когда отсутствие результатов лечения не связано с антибиотиком,
а определяется состоянием организма больного, снижением его реактивности.
Поэтому применение этиотропных средств обязательно должно сочетаться с
активной патогенетической терапией. Антибиотики часто не оказывают окончательного
санирующего эффекта при инфекционных заболеваниях, протекающих на фоне
применения глюкокортикостероидов, цитостатиков, при сопутствующей лучевой
болезни и др.
Иногда имеются положительные результаты лечения даже при устойчивости
выделенного возбудителя к данному препарату. Это объясняется применением
антибиотиков (особенно бензилпенициллина) в высоких («мега») дозах, намного
превышающих установленную в лаборатории МПК.
Побочное действие антибиотиков. В процессе антибиотике- и химиотерапии
нужно не только хорошо знать противомикробную активность применяемых для
лечения препаратов, но и представлять возможность побочного их действия,
его патогенез, формы проявления, профилактику и лечение. Побочное действие
антибиотиков и химиопрепаратов в основном сводится к аллергическим, токсическим
реакциям или зависит от побочного химиотерапевтического эффекта - реакция
бактериолиза, дисбактериоз, суперинфекции и др.

Клинические проявления аллергических реакций выражаются в виде анафилактического
шока, поражения кожи, слизистых оболочек, отека Квинке, астматического
бронхита.
Проявление токсических реакций характеризуется четкой симптоматикой
и возникает чаще аллергических. При приеме аминогликозидов они характеризуются
невритом слухового нерва, поражением зрительного нерва, вестибулярными
расстройствами, возможным развитием полиневрита, токсическим поражением
почек. Тетрациклины, рифампицин, эритромицин, сульфаниламиды обладают гепатотоксичным
действием. Патологическое влияние на кроветворную систему могут оказывать
хлорамфеникол, рифампицин, стрептомицин. Токсически действуют на желудочно-кишечный
тракт тетрациклин, эритромицин, амфотерицин В и др.
К побочному эффекту антибиотиков,
связанному с биологической
активностью, следует отнести реакцию Яриша-Герксгеймера, инфекционно-токсический
шок, которые обусловлены так называемым «токсинным ударом» в результате
массивного бактериолиза. Инфекционно-токсический шок чаще развивается при
инфекциях с напряженной бактериемией (менингококцемия, брюшной тиф, лептоспироз
и др.), особенно в случаях применения антибактериальных препаратов бактерицидного
действия. Развитию шока препятствуют одновременное назначение глюкокортико-стероидов
(пульс-терапия), проведение инфузионно-дезинтоксикационной терапии. По
этой же причине лечение больных менингококцемией рекомендуют начинать с
применения препарата бактериостатического действия - левомицетина.
Противомикробные препараты могут вызвать дисбактериоз, снижение напряженности
иммунного ответа организма, что в конечном итоге проявляется реинфекцией
или суперинфекцией. Вследствие подавления нормальной микрофлоры кишечника
может развиться гиповитаминоз.
В основе профилактики побочных реакций от антибиотиков и хими-опрепаратов
лежит радикальная терапия со знанием общих свойств препарата, механизмов
его действия, фармакокинетики и схем применения.
Вернуться к номеру
Характеристика основных групп антибактериальных препаратов, применяемых в медицине критических состояний
Антибиотики классифицируют по результату воздействия на микрофлору, химическому строению и механизму действия.
Основой классификации антибактериальных препаратов (АБП) является их химическое строение. Классификация антибиотиков в соответствии с их химическим строением приведена в табл. 1.
Формально под термином «антибиотики» понимают только те вещества, которые вырабатываются микробами. Следовательно, такие антибактериальные или противомикробные средства, как сульфаниламиды, хинолоны и триметоприм, строго говоря, не антибиотики.
Если исходить из общетеоретических понятий бактерицидности и бактериостатичности, то эти понятия относительные, так как обе группы препаратов нарушают синтез белка в различных структурах клетки. Разница лишь в том, что бактерицидная активность зависит от величины концентрации препарата в биологических жидкостях, а бактериостатическая — не зависит или мало зависит от нее. По результату воздействия на микроорганизмы выделяют бактерицидные антибиотики, уничтожающие микробную клетку, и бактериостатические — подавляющие ее рост и размножение. Бактерицидные препараты используются при тяжелых острых инфекционных процессах Острый инфекционный процесс обусловливается интенсивным делением клеток. Действие на делящиеся клетки с нарушение синтеза белка — процесс не длительный, поэтому препараты бактерицидного действия — недлительного применения, их используют до получения клинического эффекта.
Бактериостатические препараты — препараты длительного использования для лечения хронического течения или инфекций в стадии утихания острых процессов. Однако к макролидам, рифампицину, линкомицину, фузидину быстро развивается устойчивость, поэтому их рекомендуют применять короткими курсами до 5 дней. По механизму действия антибиотики, как правило, делят на 3 группы:
I группа — антибиотики, нарушающие синтез микробной стенки во время митоза: пенициллины, цефалоспорины (ЦС), карбапенемы, монобактамы (азтреонам), ристомицин, фосфомицин, гликопептидные препараты (ванкомицин, тейкопланин). По фармакологическому эффекту препараты этой группы являются бактерицидными антибиотиками.
II группа — антибиотики, нарушающие функцию цитоплазматической мембраны: полимиксины, полиеновые препараты (нистатин, леворин, амфотерицин В и др).
По фармакологическому эффекту они также являются бактерицидными.
III группа — антибиотики, нарушающие синтез белков и нуклеиновых кислот: левомицетин, тетрациклины, линкозамиды (линкомицин, клиндамицин), макролиды (эритромицин, рокситромицин, азитромицин и др.), рифамицины, фузидин, гризеофульвин, аминогликозиды (АГ) (канамицин, гентамицин, нетилмицин и др.).
По фармакологическому эффекту они являются бактериостатическими. Исключение составляет амикацин, который действует бактерицидно независимо от концентрации.
В последнее время принято разделение антибиотиков по механизму действия на 5 основных групп (табл. 2).
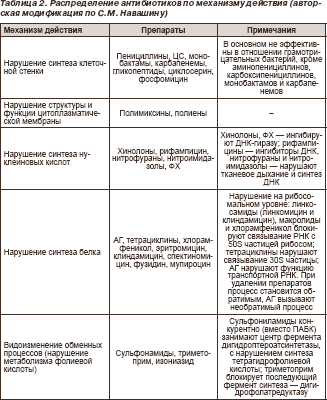
Характеристика основных групп АБП
С целью систематизации использования АБП существует Перечень жизненно важных лекарственных средств ВОЗ (WHO Моde1 List of essential Drugs). Представленный ВОЗ перечень является примерной моделью разработки такого списка в каждой стране с учетом особенностей местного здравоохранения. Как показывает практика, количество антимикробных препаратов примерно совпадает в разных странах. В своем обзоре мы хотим представить основные АБП, которые используются в медицине критических состояний.
Пенициллины
Пенициллиназостабильные пенициллины. Спектр антимикробной активности оксациллина близок к природным пенициллинам (грамположительные бактерии), однако уровень активности против стрептококков и пневмококков в несколько раз ниже; не действует на энтерококки, гонококки и анаэробные бактерии. Основным отличием оксациллина от природных и других полусинтетических пенициллинов является устойчивость к стафилококковым бета-лактамазам — ферментам, разрушающим бета-лактамное кольцо пенициллинов.
Оксациллин является высокоактивным средством в отношении золотистого и коагулазонегативных стафилококков, однако не действует на стафилококки с другим механизмом устойчивости — так называемые метициллин- или оксациллин-резистентные стафилококки. Основные показания для оксациллина — инфекции, вызванные стафилококками, чувствительными к оксациллину, а также при предполагаемой стафилококковой этиологии (острый артрит, острый остеомиелит, неосложненные инфекции кожи и мягких тканей, эндокардит трикуспидального клапана). Адекватный режим дозирования оксациллина при госпитальных стафилококковых инфекциях — 2 г внутривенно с интервалом 4-6 ч. При пероральном приеме оксациллин плохо всасывается в пищеварительном тракте, поэтому предпочтительнее использовать клоксациллин или диклоксациллин.
Аминопенициллины обладают более широким спектром активности по сравнению с природными пенициллинами за счет некоторых грамотрицательных бактерий — Е.соli, Shigella spp., Salmonella spp., Proteus mirabilis, Haemophilus influenzae (преимущественно внебольничные штаммы); препараты проявляют также активность в отношении анаэробных микроорганизмов, но уровень резистентности к ним высокий. В то же время аминопенициллины гидролизуются β-лактамазами стафилококков и грамотрицательных бактерий, поэтому не имеют в настоящее время существенного значения при лечении внутрибольничных инфекций.
Ампициллин применяется парентерально (при пероральном приеме низкая биодоступность) при внебольничной пневмонии, инфекционном эндокардите, менингите. Амоксициллин применяется при нетяжелых внебольничных респираторных инфекциях, а также может назначаться для замены ампициллина при ступенчатой терапии.
Ингибиторзащищенные аминопенициллины не разрушаются большинством бета-лактамаз грамотрицательных бактерий, в результате чего их спектр антимикробной активности по сравнению с незащищенными препаратами более широкий в отношении некоторых грамотрицательных бактерий (Klebsiella spp., Proteus vulgaris, Moraxella catarrhalis, Citrobacter diversus ) и анаэробов (Bacteroides fragilis ). Основное показание для применения ингибиторзащищенных пенициллинов в стационаре — интраоперационная профилактика послеоперационных гнойно-септических осложнений. С этой целью препарат вводится в однократной дозе за 30-60 мин до операции (амоксициллин/клавуланат 1,2 г, ампициллин/сульбактам (амписульбин-КМП) 3 г, уназин) . Ингибиторзащищенные пенициллины высокоэффективны при абсцедирующей пневмонии и нетяжелых инфекциях малого таза. Амоксициллин/клавуланат также является базовым средством для лечения госпитализированных больных с внебольничной пневмонией средне-тяжелого течения или обострением хронического бронхита. При госпитальных инфекциях (пневмония, перитонит, кожи и мягких тканей) значение этих препаратов невелико из-за существенного уровня резистентности основных возбудителей.
Карбоксипенициллины и уреидопенициллины. Эти препараты обычно объединяют одним названием — антипсевдомонадные пенициллины. Они обладают более широким спектром активности по сравнению с аминопенициллинами (чувствительны большинство бактерий семейства Enterobacteriaceae, Рseudomonas aeruginosa ), однако эти препараты разрушаются β-лактамазами грамотрицательных бактерий и стафилококков, поэтому применение их в настоящее время ограничено. Основное показание — псевдомонадные инфекции, однако следует учитывать возросший уровень устойчивости Р.аeruginosa к карбокси- и уреидопенициллинам. При назначении этих препаратов при псевдомонадной инфекции (при установленной чувствительности!) следует их комбинировать с аминогликозидами, использовать адекватные дозировки: карбенициллин внутривенно 4-5 г с интервалом 4 ч, пиперациллин внутривенно 2-4 г с интервалом 6-8 ч. При использовании антипсевдомонадных пенициллинов (особенно карбоксипенициллинов!) необходимо контролировать электролиты в крови и показатели свертываемости крови.
Защищенные антипсевдомонадные пенициллины. Имеют более широкие показания при внутрибольничных инфекциях, однако следует также учитывать увеличившуюся в последние годы устойчивость грамотрицательных бактерий к этим препаратам. Тикарциллин/клавуланат и пиперациллин/тазобактам применяются в основном при смешанных аэробно-анаэробных инфекциях — интраабдоминальные и гинекологические инфекции, легочные нагноения. Целесообразно сочетание этих препаратов с аминогликозидами, особенно при тяжелых инфекциях. Режим дозирования тикарциллин/клавуланата составляет 3,2 г внутривенно с интервалом 6-8 ч, пиперациллин/тазобактама — 2,5-4,5 г с интервалом 8 ч.
Цефалоспорины
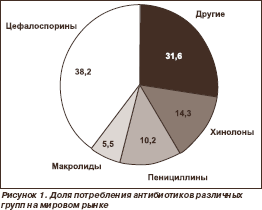
Потребление цефалоспоринов «так резко возросло, что можно сравнить его с первоначальной реакцией на появление пенициллина». Считаются самыми назначаемыми в ОИТ АБП в мире (рис. 1).
В эту группу входят препараты с различным спектром антимикробной активности, поэтому в зависимости от спектра их разделяют на поколения. Общим для всех цефалоспоринов (кроме цефоперазон/сульбактама) является слабая активность в отношении анаэробных микроорганизмов (поэтому при смешанных инфекциях их следует комбинировать с метронидазолом или линкозамидами). Все ЦС не активны в отношении энтерококков, метициллинрезистентных стафилококков, листерий и атипичных микроорганизмов (легионелла, хламидии, микоплазма).
Цефалоспорины I поколения. Обладают преимущественной активностью в отношении грамположительных бактерий (стафилококки, стрептококки, пневмококки) и некоторых грамотрицательных — Е.соli , Shigella spp., Salmonella sрр., Р.mirabilis .
Однако в связи с широким распространением приобретенной устойчивости госпитальных штаммов грамотрицательных бактерий клиническое значение цефалоспоринов I поколения при этих инфекциях невелико. Основная область клинического применения цефазолина в стационаре — установленная стафилококковая инфекция различной локализации.
Цефалоспорины II поколения, представителем которых является цефуроксим (зинацеф, кимацеф), обладающие более широким спектром активности против грамотрицательных бактерий, находят более широкое применение при внутрибольничных инфекциях, однако в большинстве случаев их целесообразно сочетать с аминогликозидами. Цефуроксим эффективен при неосложненной внебольничной пневмонии. Показан для профилактики инфекционных осложнений после операций.
Цефалоспорины III поколения характеризуются высокой активностью в отношении грамотрицательных энтеробактерий, причем цефотаксим и цефтриаксон превосходят цефтазидим и цефоперазон. Принципиальное различие между этими препаратами заключается в действии на синегнойную палочку: цефотаксим и цефтриаксон не обладают значимой активностью против Р.аeruginosa (их целесообразно выделить в подгруппу IIIа), цефтазидим и цефоперазон активны в отношении Р.аeruginosa (цефтазидим несколько превосходит цефоперазон) — подгруппа IIIб. Соответственно различается и место этих цефалоспоринов при внутрибольничных инфекциях. Цефтазидим (цефтум) и цефоперазон (гепацеф, цефобид) являются базовыми препаратами при лечении установленных псевдомонадных инфекций или заболеваний с высоким риском наличия Р.аeruginosa . Цефоперазон, в высоких концентрациях проникающий в желчь, также показан для лечения инфекций желчевыводящих путей. Цефотаксим и цефтриаксон (офрамакс) являются в настоящее время базовыми препаратами при лечении различных госпитальных инфекций. Уровень активности у этих цефалоспоринов одинаков, различия между ними связаны со скоростью элиминации: период полувыведения цефтриаксона составляет около 8 ч, поэтому препарат назначается в дозе 2 г с интервалом 24 ч, цефотаксим выводится быстрее, поэтому обычно дозируется 2 г с интервалом 6-8 ч.
Цефалоспорины IV поколения. Представлены в настоящее время одним препаратом — цефепимом (максипим), обладающим наиболее широким и сбалансированным спектром антимикробной активности среди цефалоспориновых антибиотиков. Клинически важно, что цефепим может сохранять активность в отношении некоторых штаммов Enterobacteriaceae (прежде всего Enterobacter spp., Serratia spp., Morganella morganii , Providencia rettgeri, C.freundii , являющихся гиперпродуцентами хромосомных бета-лактамаз класса С), резистентных к цефалоспоринам III поколения. Цефепим также проявляет активность в отношении некоторых штаммов Klebsiella spp., продуцирующих бета-лактамазы расширенного спектра, однако ряд штаммов устойчив. Основная область применения цефепима в клинике — тяжелые внутрибольничные инфекции, особенно в случае резистентных к цефалоспоринам III поколения энтеробактерий. Цефепим может применяться в клинике в схемах ротации, т. е. для временной замены в схемах эмпирической терапии цефалоспоринов III поколения в случае высокой к ним резистентности. Показано, что периодическая ротация цефалоспоринов III поколения на цефепим в отделениях реанимации и интенсивной терапии (ОПТ) позволяет ограничить рост устойчивых штаммов микроорганизмов и даже восстановить чувствительность микробов к цефалоспоринам III поколения.
Ингибиторзащищенные цефалоспорины. Комбинация антипсевдомонадного цефалоспорина III поколения цефоперазона и ингибитора бета-лактамаз сульбактама — цефоперазон/сульбактам (сульперазон) — обладает более широким спектром действия, чем ЦС III поколения, за счет сохранения активности против энтеробактерий и анаэробов, продуцирующих β-лактамазы, в том числе расширенного спектра (ЕSВL), и разрушающих другие ЦС. Препарат применяется при лечении тяжелых госпитальных инфекций различной локализации, причем при смешанных аэробно-анаэробных инфекциях может применяться в режиме монотерапии.
Карбапенемы
На украинском фармацевтическом рынке представлены в основном двумя антибиотиками — имипенемом/циластатином (тиенам) и меропенемом (меронем). Характеризуются наиболее широким спектром антимикробной активности среди всех бета-лактамных антибиотиков — грамположительные и грамотрицательные аэробные бактерии, анаэробы. Из возбудителей внутрибольничных инфекций природную устойчивость к карбапенемам проявляют только три микроорганизма: Enterococcus faecium , Stenotrophomonas maltophilia , а также метициллинрезистентные штаммы Staphylococcus sрр. Клинически важно, что вторичная устойчивость госпитальных штаммов микроорганизмов к карбапенемам развивается крайне редко (исключение — Р.аеruginosa ). Резистентность Р.аеruginosa к карбапенемам выше и в ОИТ может достигать 15-20 %. Карбапенемы сохраняют активность в отношении штаммов Enterobacteriaceae , резистентных н цефалоспоринам III и IV поколений, аминогликозидам и фторхинолонам (ФХ). Имипенем характеризуется несколько более высокой активностью in v itro в отношении грамположительных микроорганизмов, меропенем проявляет более высокую активность в отношении грамотрицательных бактерий (клинически эти различия вероятно не значимы); активность препаратов против анаэробов одинакова и превосходит таковую у метронидазола и линкозамидов. Карбапенемы применяются для лечения тяжелых внутрибольничных инфекций, вызванных полирезистентной и смешанной микрофлорой, прежде всего при неэффективности препаратов первого ряда — цефалоспоринов или фторхинолонов. В контролируемых клинических исследованиях показано, что карбапенемы равноэффективны или превосходят стандартные комбинированные режимы антибактериальной терапии на основе цефалоспоринов (или полусинтетических пенициллинов) и аминогликозидов.
Основные показания для карбапенемов: интраабдоминальные инфекции, послеоперационные раневые инфекции, внутрибольничная пневмония, в том числе связанная с ИВЛ, легочные нагноения (абсцесс, эмпиема), инфекции органов малого таза, осложненные инфекции мочевыводящих путей с сепсисом, остеомиелит, менингит (только меропенем ). Следует подчеркнуть, что при жизнеугрожающих инфекциях карбапенемы необходимо рассматривать не как резервные средства, а как антибиотики первого ряда, так как прогноз у тяжелых больных может быть улучшен только в случае возможно более раннего назначения адекватной антибактериальной терапии. К таким ситуациях прежде всего следует отнести инфекционные осложнения у больных в ОРИТ, находящихся на ИВЛ (особенно при АРАСНЕ II > 20), инфекции, вызванные Р.аеruginosa и Acinetobacter sрр., грамотрицательными бактериями (прежде всего, Klebsiella sрр., P.vulgaris ), продуцирующими бета-лактамазы расширенного спектра, инфекции у больных с иммунодефицитом (фебрильная нейтропения), гнойный послеоперационный менингит, вызванный грамотрицательными бактериями или Р.аеruginosa .
В последнее время в клинической практике появился новый карбапенем — эртапенем, МSD (инванз), который характеризуется улучшенными фармакокинетическими свойствами и назначается 1,0 грамма 1 раз в сутки; способ введения: внутримышечно и внутривенно.
Аминогликозиды
Выделяют препараты трех поколений. АГ I поколения (стрептомицин, канамицин) в настоящее время применяются исключительно во фтизиатрии. АГ II (гентамицин, тобрамицин) и III поколения (нетилмицин, амикацин (амикин, амицил) ) широко применяются в клинической практике. АГ обладают широким спектром природной антимикробной активности, однако препараты слабо действуют на стрептококки и пневмококки и не активны в отношении анаэробных бактерий. Наиболее высокие значения МПК in vitro против грамотрицательных бактерий отмечаются у амикацина, однако это компенсируется более высокими дозами амикацина по сравнению c другими аминогликозидами и соответственно более высокими сывороточными концентрациями. Уровень приобретенной резистентности грамотрицательных бактерий существенно варьирует и различается между различными аминогликозидами. Устойчивость к аминогликозидам нарастает в следующем порядке: амикацин < нетилмицин < гентамицин = тобрамицин, т.е. штаммы грамотрицательных бактерий, резистентные к амикацину, будут также резистентны к другим аминогликозидам, штаммы, резистентные к нетилмицину, могут сохранять чувствительность к амикацину, но всегда будут устойчивы к гентамицину и тобрамицину. В отношении стафилококков эталонным аминогликозидом является гентамицин: при устойчивости стафилококков к гентамицину другие АГ также будут не активны.
К недостаткам аминогликозидов, ограничивающим их применение, следует отнести токсичность (нейротоксичность, ототоксичность, нефротоксичность), плохое проникновение в ткани бронхолегочной системы, снижение активности при гнойных процессах. С целью уменьшения нефротоксических эффектов целесообразно однократное введение суточной дозы аминогликозидов (данный подход не применяется при инфекционном эндокардите, нейтропении, у новорожденных). Учитывая указанные недостатки, АГ при внутрибольничных инфекциях следует применять только в комбинации с другими антибиотиками. В стационаре оптимально использовать два аминогликозида — гентамицин и амикацин. Первый рациональнее применять в отделениях общего профиля; амикацин, из-за невысокого уровня резистентности к нему — в ОРИТ, а также при псевдомонадных инфекциях. Нетилмицин не имеет существенных преимуществ по сравнению с амикацином, но стоимость его выше.
АГ применяются также в базовых схемах этиотропной терапии некоторых инфекций: Enterococcus faecalis : гентамицин + ампициллин (бензилпенициллин); Enterococcus faecium : гентамицин + ванкомицин (тейкопланин); Streptococcus viridans (эндокардит): гентамицин + бензилпенициллин (цефтриаксон); Pseudomonas aeruginosa : амикацин (гентамицин) + цефтазидим (цефоперазон, цефепим).
Фторхинолоны
Обладают широким спектром антимикробной активности. Наиболее высокую активность проявляют в отношении грамотрицательных бактерий, включая P.aeruginosa . Активность в отношении стафилококков менее выражена, в отношении стрептококков и пневмококков — слабая. В последние годы появились ФХ с повышенной активностью против грамположительных бактерий (моксифлоксацин, авелокс). ФХ характеризуются невысокой природной активностью в отношении анаэробов, поэтому при смешанных инфекциях целесообразна их комбинация с линкозамидами (линкомицин или далацин С) или метронидазолом.
В последние годы отмечается рост устойчивости госпитальных штаммов грамотрицательных бактерий к фторхинолонам, прежде всего у P.aeruginosa . Уровень устойчивости грамотрицательных бактерий к ранним фторхинолонам условно можно расположить в следующей последовательности: ципрофлоксацин (цифран) < офлоксацин (заноцин) = пефлоксацин < ломефлоксацин.
ФХ в настоящее время рассматриваются как препараты второго ряда (после цефалоспоринов) при лечении различных госпитальных инфекций. В некоторых ситуациях ФХ могут использоваться в качестве средств первого ряда, например, при высоком уровне устойчивости в стационаре грамотрицательных бактерий к цефалоспоринам.
Гликопептиды
К гликопептидам относятся природные антибиотики — ванкомицин и тейкопланин. Ванкомицин применяется в клинической практике с 1958 г., тейкопланин — с середины 80-х. В последние годы возрос интерес к гликопептидам в связи с увеличением частоты госпитальных инфекций, вызванных грамположительными микроорганизмами. В настоящее время гликопептиды являются препаратами выбора при инфекциях, вызванных метициллинрезистентными стафилококками, а также энтерококками, резистентными к ампициллину. В качестве средств эмпирической терапии гликопептиды применяются при катетерассоциированном сепсисе и у больных с фебрильной нейтропенией (на втором этапе терапии).
Гликопептиды обладают бактерицидным действием, однако в отношении энтерококков, некоторых стрептококков и коагулазонегативных стафилококков они действуют бактериостатически. Гликопептиды обладают активностью в отношении грамположительных аэробных и анаэробных микроорганизмов: стафилококков (включая метициллинрезистентные штаммы), стрептококков, пневмококков (включая штаммы, резистентные к пенициллину), энтерококков, пептострептококков, листерий, коринебактерий, клостридий (включая С.difficile ). В отношении грамотрицательных микроорганизмов гликопептиды не активны, так как не проникают через их клеточную стенку. Спектр антимикробной активности ванкомицина и тейкопланина сходен, однако имеются некоторые различия в уровне природной активности и приобретенной резистентности. Тейкопланин проявляет in vitro более высокую активность в отношении золотистого стафилококка (в том числе штаммов, резистентных к метициллину), различных видов стрептококков (включая S.pneumoniae ) и энтерококков. Ванкомицин in vitro более активен в отношении коагулазонегативных стафилококков. В отношении анаэробных кокков и клостридий активность препаратов одинаковая.
Приобретенная резистентность к гликопептидам у грамположительных бактерий развивается редко. Несмотря на 40-летнее применение, не отмечено появления штаммов стафилококков, устойчивых к ванкомицину. В то же время в процессе применения тейкопланина может отмечаться снижение чувствительности к нему стафилококка и даже развитие резистентности. Период полувыведения ванкомицина составляет 6-8 ч, тейкопланина — от 40 до 120 ч в зависимости от метода его определения. Большой период полувыведения объясняет возможность назначения тейкопланина однократно в сутки. Ванкомицин и тейкопланин выводятся почками путем гломерулярной фильтрации, поэтому у больных с почечной недостаточностью требуется коррекция их режима дозирования. Препараты не удаляются при гемодиализе. Диапазон терапевтических концентраций гликопептидов в крови:
— ванкомицин: максимальные (через 0,5 ч) — 20-50 мг/л, минимальные (перед очередным введением) — 5-10 мг/л;
— тейкопланин: максимальные — 20-40 мг/л, минимальные — 5-15 мг/л.
Побочные эффекты гликопептидов. Нефротоксичность: обратимое нарушение функции почек (увеличение креатинина и мочевины в крови, анурия) наблюдается при применении ванкомицина в 5 % случаев и более; частота зависит от дозы и длительности применения препарата, возраста больных; риск увеличивается при сочетанном применении с аминогликозидами или петлевыми диуретиками и при превышении концентрации ванкомицина в крови свыше 10 мг/л. При применении тейкопланина нарушение функции почек отмечается реже. Ототоксичность: снижение слуха, вестибулярные нарушения (у больных с повышенной функцией почек). Нейротоксичность: головокружение, головная боль.
Реакции при внутривенном введении: покраснение лица и верхней части туловища, кожный зуд, боль за грудиной и тахикардия, иногда — гипотензия в результате высвобождения гистамина из тучных клеток, наблюдающееся при быстром внутривенном введении ванкомицина. На фоне применения тейкопланина эти реакции практически не наблюдаются.
Возможны также другие нежелательные реакции: флебиты, боль, жжение в месте введения, обратимая лейкопения, тромбоцитопения, транзиторное повышение трансаминаз, щелочной фосфатазы. Наиболее хорошо изученным и широко применяемым является ванкомицин. Ванкомицин применяется в следующих случаях:
— сокументированная инфекция различной локализации, вызванная метициллинрезистентными стафилококками (пневмония, инфекция кожи и мягких тканей, мочевыводящих путей, костей и суставов, перитонит, инфекционный эндокардит, сепсис);
— стафилококковые инфекции различной локализации при аллергии к пенициллинам и цефалоспоринам;
— тяжелые инфекции, вызванные чувствительными штаммами Enterococcus faecium, Enterococcus faecalis, Corynebacterium jejkeium ;
— инфекционный эндокардит, вызванный Streptococcus viridans и S.bovis (при аллергии к бета-лактамным антибиотикам), E.faecalis (в комбинации с гентамицином);
— менингит, вызванный пенициллинрезистентными штаммами S.pneumoniae .
В качестве средства эмпирической терапии жизнеопасных инфекций при подозрении на стафилококковую этиологию:
— инфекционный эндокардит трикуспидального или протезированного клапана (в сочетании с гентамицином);
— катетерассоциированный сепсис;
— посттравматический или послеоперационный менингит (в сочетании с цефалоспоринами III поколения или фторхинолонами);
— перитонит при перитонеальном диализе;
— фебрильная нейтропения (при неэффективности стартовой терапии).
Ванкомицин назначается также внутрь при антибиотикассоциированной диарее, вызванной Clostridium difficile . Ванкомицин назначается только внутривенно в виде медленной инфузии в течение 60-120 мин. У взрослых ванкомицин назначают по 1 г с интервалом 12 ч. У больных с нарушенной функцией почек дозу ванкомицина корректируют с учетом клиренса креатинина. При терминальной почечной недостаточности препарат вводят в дозе 1 г с интервалом 7-10 дней. При лечении псевдомембранозного колита, вызванного C.difficile , ванкомицин назначают внутрь в дозе 0,125 г каждые 6 ч (для приготовления раствора препарата порошок разводят в 30 мл воды; возможно использование сиропов или других добавок для улучшения вкусовых качеств).
Оксазолидиноны
Линезолид — первый представитель нового класса синтетических антимикробных средств — оксазолидинонов. Механизм действия линезолида связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, линезолид воздействует на ранних этапах трансляции (необратимое связывание с 30S- и 50S-субъединицей рибосом), в результате чего нарушается процесс образования 70S-комплекса и формирование пептидной цепи. Благодаря уникальному механизму действия не отмечается перекрестной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, АГ, тетрациклины и хлорамфеникол).
Принципиальным моментом в назначении линезолида является наличие в отделении МКSА-штаммов стафилококков, резистентность к гликопептидам (ванкомицину), наличие ванкомицинрезистентных штаммов энтерококков. Линезолид применяется при тяжелых нозокомиальных и вентиляторассоциированных пневмониях.
Постантибиотический эффект линезолида in vitro (ПАБЭ) для Staphylococcus aureus составляет примерно 2 часа. На экспериментальных моделях у животных ПАБЭ in vivo составлял 3,6-3,9 часа для Staphylococcus aureus и Streptococcus рпеиmоniае соответственно.
К линезолиду чувствительны микроорганизмы:
— грампозитивные аэробы: Corynebacterium jejkeium, Enterococcus faecalis (включая гликопептидрезистентные штаммы), Enterococcus faecium (гликопептидрезистентные штаммы), Enterococcus casseliflavus, Enterococcus gallinarum, Listeria monocytogenes, Staphylococcus aureus (включая МКSА-штаммы), Staphylococcus epidermidis, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus intermedius, Streptococcus рпеитоniае (включая штаммы с перекрестной чувствительностью к пенициллину и пенициллинрезистентные штаммы); Streptococcus pyogenes, стрептококки группы Viridans, стрептококки группы С;
— грамнегативные аэробы : Pasteurella canis, Pasteurella multocida;
— грампозитивные анаэробы : Clostridium perfingens, Peptostreptococcus anaerobius, Peptostreptococcus sрр.;
— грамнегативные анаэробы : Bacteroidas fragilis, Prevotella sрр.;
— другие : Chlamydia рпеито ni ае .
Умеренно чувствительные микроорганизмы:
— Legionella sрр ., Мо raxella са tarrhalis, Mycoplasma sрр .
Резистентные микроорганизмы :
— Neisseria sрр ., Pseudomonas sрр .
Практически важно, что линезолид сохраняет активность против метициллинрезистентных стафилококков, причем выраженность активности (по значениям МПК) не различается в отношении чувствительных и резистентных к метициллину штаммов. Линезолид проявляет выраженный эффект в отношении S.рпеитоniае , причем как штаммов чувствительных, так и устойчивых к пенициллину или эритромицину. В настоящее время не выделены штаммы S.рпеитоniае со сниженной чувствительностью к линезолиду. Линезолид также проявляет активность в отношении штаммов пневмококка, устойчивых к цефтриаксону, клиндамицину, тетрациклину, хлорамфениколу. Линезолид проявляет стабильную активность в отношении E.faecalis, E.faecium . Очень важное свойство линезолида — это сохранение активности в отношении тех штаммов энтерококков, которые резистентны к ванкомицину и тейкопланину, причем препарат проявляет действие при различных фенотипах устойчивости к гликопептидам. Линезолид проявляет сходную с ванкомицином активность в отношении грамположительных анаэробов — Clostridium perfingens , C.difficile и пептострептококков. В отличие от ванкомицина линезолид также действует на грамотрицательные анаэробные бактерии, в частности Bacteroidas fragilis , Fusobacterim sрр., Prevotella sрр.
Линезолид применяется в виде внутривенной инфузии и в лекарственной форме для приема внутрь. Линезолид быстро и полностью всасывается при приеме внутрь, максимальные концентрации в крови достигаются через 1-2 ч и составляют в среднем около 12 мкг/мл. Абсо лютная биодоступность препарата 100 %. Объем распределения линезолида составляет 50 л, связь с белками плазмы — 31 %, период полувыведения — 4,5-5,5 ч. Линезолид хорошо проникает в кожу и мягкие ткани, легкие, сердце, кишечник, печень, почки и ЦНС и умеренно — в синовиальную жидкость, кости, желчь. В большинстве органов концентрации линезолида составляют 60-70 % от величины сывороточных концентраций.
Линезолид метаболизирует в печени путем окисления с образованием двух метаболитов, обладающих очень слабой антибактериальной активностью. Линезолид применяется для лечения инфекций различной локализации у взрослых и детей, вызванных грамположительными микроорганизмами (стафилококками, пневмококками, энтерококками):
— тяжелая внебольничная или госпитальная пневмония;
— осложненные инфекции кожи и мягких тканей;
— неосложненные инфекции кожи и мягких тканей в амбулаторной практике;
— осложненные инфекции мочевыводящих путей;
— бактериемия или сепсис;
— интраабдоминальные инфекции;
— инфекционный эндокардит.



Линезолид оказывает слабое действие на грамотрицательные бактерии , поэтому при выделении последних следует к лечению присоединить цефалоспорин III-IV поколения или фторхинолон. В эмпирической терапии линезолид может рассматриваться как средство выбора при тяжелых инфекциях — остеомиелите, эндокардите или протезировании клапана, катетерассоциированной бактериемии или сепсисе, перитоните у больных на постоянном амбулаторном перитонеальном диализе. У больных с нейтропенической лихорадкой линезолид может назначаться на втором этапе лечения при неэффективности стартовой терапии. В стационарах с высокой частотой МRSА линезолид может рассматриваться в качестве средства эмпирической терапии тяжелых больных (ОРИТ, пневмония на ИВЛ, гемодиализ, ожоговая травма). Особыми показаниями для назначения линезолида в качестве средства этиотропной терапии являются:
— инфекции любой локализации, вызванные МRSА;
— инфекции, вызванные энтерококками, устойчивыми к ампициллину;
— инфекции, вызванные E.faecium , устойчивым к ванкомицину;
— тяжелые инфекции, вызванные S.рпеитоniае , устойчивым к пенициллину и цефалоспоринам III поколения, прежде всего менингит и сепсис.
Побочные эффекты. Боль, спазмы в животе, вздутие, отклонение гематологических показателей и показателей функции печени, диарея, головная боль, кандидомикоз, тошнота, рвота, тромбоцитопения, лейкопения и панцитопения. Нейропатия (периферическая глазного нерва) наблюдается при использовании линезолида при превышении максимально рекомендованой длительности лечения в 28 дней.
При гемодиализе выводится приблизительно 30 % дозы линезолида.
Особенности использования. У некоторых пациентов может развиться миелосупрессия (анемия, тромбоцитопения, лейкопения и панцитопения), что полностью зависит от длительности терапии. Линезолид назначается 2 раза в день внутривенно или перорально. При приеме внутрь хорошо всасывается из ЖКТ, максимум концентрации в крови через 2 ч. Раствор для инфузий следует вводить на протяжении 30-120 мин.
Пациентов, которые начали лечение с пероральной формы, по клиническим показаниям можно переводить на прием лекарственной формы препарата для инъекций, и наоборот. В таком случае дополнительный подбор дозы не нужен, так как биодоступность линезолида как при приеме внутрь, так и внутривенно составляет почти 100 %.
Использование при беременности и лактации. Адекватных исследований безопасности применения линезолида при беременности не проводилось, поэтому препарат следует использовать у данной категории пациентов только по абсолютным жизненным показаниям. Неизвестно, проникает ли линезолид в грудное молоко, поэтому его следует применять с осторожностью.
Фармакокинетика в разных группах больных. Клиренс линезолида выше у детей и снижается с возрастом. Фармакокинетика линезолида существенно не изменяется у группы пациентов старше 65 лет. Отмечены некоторые фармакокинетические отличия у женщин, которые выражаются в несколько меньшем объеме распределения, снижении клиренса приблизительно на 20 %, иногда в более высоких концентрациях в плазме. Для пациентов с умеренной, средней и тяжелой почечной недостаточностью коррекции дозы не нужно, поскольку нет зависимости между клиренсом креатинина и выведением препарата через почки. Поскольку 30 % дозы препарата выводится на протяжении 3 часов гемодиализа, пациентам, которые получают подобное лечение, линезолид необходимо назначать после диализа. Фармакокинетика линезолида не изменяется у пациентов с печеночной недостаточностью, в связи с этим нет необходимости корректировать дозу препарата. Фармакокинетика линезолида у пациентов с тяжелой печеночной недостаточностью не изучена. Однако поскольку линезолид метаболизируется вследствие неферментативного процесса, то очевидно, что функция печени существенно не изменяет метаболизм линезолида.
Взаимодействие с другими лекарственными препаратами.
Фармакологическое. Линезолид — раствор для инфузий совместим с такими растворами: 5% раствор декстрозы, 0,9% раствор хлорида натрия, раствор Рингералактат для инъекций. Не следует вводить дополнительные компоненты в раствор линезолида для инфузий. Линезолид в растворе для инфузий физико-химически несовместим с такими препаратами: амфотерицин В, хлорпромазина гидрохлорид, диазепам, пентамидина изетионат, фенитоин натрия, эритромицина лактобионат и триметоприм-сульфаметоксазол. Кроме того, раствор химически не может быть совместим с цефтриаксоном.
Фармакодинамическое. Линезолид является слабым обратным неселективным ингибитором моноаминоксидазы (МАО), поэтому у некоторых пациентов препарат может причинять умеренное усиление прессорного действия псевдоэфедрина гидрохлорида и фенилпропаноламина гидрохлорида. Рекомендуется уменьшить начальные дозы адренэргических препаратов, таких как допамин (или его агонистов), и в дальнейшем производить титрование дозы.
Фармакокинетическое. Фармакокинетика линезолида не изменяется при одновременном использовании азтреонама и гентамицина.
Бактерицидные макролиды
Макролиды-азолиды — азитромицин (наименее токсичный антибиотик, активность в отношении грамположительных кокков и внутриклеточных возбудителей — хламидии, микоплазмы, кампилобактерии, легионеллы).
Макролиды-кетолиды — эритромицин-ацистрат (высокая активность против энтерококков, в том числе нозокомиальных, ванкомицинрезистентных штаммов, микобактерий, бактероидов).
Бактериостатические макролиды (препараты широкого спектра, имеют длительный период полувыведения, можно вводить 1-2 раза в сутки, широкое применение в лечении токсоплазмоза и профилактике менингита, активность в отношении хламидий и легионелл).
1-е поколение — эритромицин, олеандомицин.
2-е поколение — спиромицин, рокситромицин, мидекамицин, джозамицин, диритромицин, кларитромицин, китазамицин.
Общие свойства макролидов:
1. Преимущественно бактериостатическое действие.
2. Активность против грамположительных кокков (стрептококки, стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии, легионеллы).
3. Высокие концентрации в тканях (в 5-10-100 раз выше плазменных).
4. Низкая токсичность.
5. Отсутствие перекрестной аллергии с β-лактамами.
Среди макролидов особого внимания заслуживает кларитромицин (клацид) как единственный из новых макролидов, имеющий внутривенную форму введения. Данное обстоятельство позволяет использовать его при лечении неосложненной внегоспитальной пневмонии или как препарат 2-го ряда при терапии госпитальной пневмонии. Однако, по последним сообщениям, детального рассмотрения заслуживает проблема устойчивости S.рпеитоniае к макролидным антибиотикам. Устойчивость пневмококков к макролидам (так же, как и пиогенных стрептококков) может быть обусловлена либо ферментативной модификацией мишени действия (метилированием рибосомальной РНК), либо активным выведением препаратов из микробной клетки. При первом механизме наблюдают полную перекрестную устойчивость между всеми макролидами, при втором пневмококки проявляют устойчивость к 14- и 15-членным макролидам при чувствительности к 16-членным. Между всеми включенными в Аlexander Project макролидами наблюдали полную перекрестную резистентность. Вторым практически важным фактом является наличие ассоциации между устойчивостью к пенициллину и макролидам. Это наблюдение находит полное подтверждение во всех исследованиях, посвященных антибиотикорезистентности пневмококков. Тревожным фактом является также стабильный рост устойчивости к макролидам (в некоторых европейских странах устойчивость к макролидам выше, чем к пенициллину). Причем нарастание устойчивости коррелирует с увеличением потребления современных макролидов с пролонгированной фармакокинетикой (азитромицина и кларитромицина). Для макролидов традиционные и фармакодинамически обоснованные критерии чувствительности совпадают. Следовательно, есть все основания предполагать наличие у этих антибиотиков высокой бактериологической эффективности при пневмококковых инфекциях, вызванных чувствительными штаммами. Имеющиеся клинические данные находятся в полном соответствии с этим предположением. В то же время нерешенным является вопрос о клинической эффективности 14- и 15-членных макролидов при инфекциях, вызываемых пневмококками с устойчивостью, обусловленной активным выведением. Ряд наблюдений свидетельствует о том, что при пневмониях, вызываемых такими микроорганизмами, клиническая эффективность 14- и 15-членных макролидов сохраняется. Обсуждаются предложения о пересмотре критериев чувствительности пневмококков к макролидам (увеличение значения пограничной МПК эритромицина от 1 до 8 или 16 мкг/мл). Таким образом, как для β-лактамов, так и для макролидов микробиологическая устойчивость далеко не всегда означает неудачу лечения.
Антибактериальные препараты — так именуют целый кластер лекарственных средств, обладающих свойством подавлять рост и развитие живых клеток вредных микроорганизмов или вызывать их гибель. Поэтому они используются при лечении воспалительных процессов, которые были вызваны бактериальной микрофлорой. Такие лекарства имеют избирательную токсичность, при которой клетки человека не повреждаются.
По воздействию на микроорганизмы препараты делятся на две категории:
- Бактерицидного действия. В этом случае нарушается функция клеточных мембран и их целостность, что вызывает гибель микроорганизмов. Препараты с этим эффектом применяют при лечении таких инфекционных болезней, как сепсис и эндокардит, а также при лечении пациентов, когда организм ослаблен и не в состоянии самостоятельно бороться с опасной инфекцией.
- Бактериостатического действия. Основанные на этом принципе препараты, нарушают синтез белков и, как следствие, прекращается развитие и рост микроорганизмов, но не происходит их уничтожение. При лечении инфекционных заболеваний такое воздействие препарата вкупе с иммунной системой организма обеспечивает полное выздоровление больного.
По происхождению антибактериальные препараты делятся на три категории:
- Растительного
- Животного
- Микробного.
В аптечных пунктах чаще всего можно встретить препараты микробного происхождения. Вот наиболее популярные из них:
- Тетрациклин. Обладает бактериостатическим действием. Его назначают при ангине, бронхите и пневмонии. Он также помогает при кишечных инфекциях.
- Ампициллин. Это препарат полусинтетического действия, который помогает при синуситах, бронхитах и других бактериальных инфекциях.
- Граммидин. Широко применяется при лечении заболеваний глотки и полости рта — тонзиллите, ангине и других.
- Лизобакт. Это достаточно универсальный медикамент, назначаемый с целью профилактики и лечения инфекционных заболеваний слизистой полости рта, а также десен и гортани.
- Фурацилин. Очень эффективное средство, помогающее при повреждении кожных покровов, конъюнктивите, ангине, стоматите и других инфекционных заболеваниях.
К этим и многим другим препаратам на сайте содержится множество инструкций по применению, в которых есть все необходимые пояснения.
Показать весь текст





