Teema kokkuvõte:
HIV/AIDSi infektsiooni retroviirusevastane ravi. Ravimite omadused. Ravi näidustused, taktika ja strateegia.
Sissejuhatus………………………………………………………………………………….2
KUNSTI eesmärgid………………………………………………………………………………6
KUNSTI näidustused…………………………………………………………………….6
NRTI-d………………………………………………………………………………………..6
NNRTI…………………………………………………………………………………8
Proteaasi inhibiitorid………………………………………………………………..10
Penetratsiooni inhibiitorid………………………………………………………………………………………………………………………………………
Integratsiooni inhibiitorid……………………………………………………………..13
KUNSTI režiimid………………………………………………………………………..13
Järeldus……………………………………………………………………………..19
Viited…………………………………………………………………21
Sissejuhatus
Retroviirusevastane ravi on üks suurimaid edusamme meditsiini ajaloos. Retroviirusevastase ravi koidik - 1987–1990. Seda perioodi seostatakse suurte lootuste ja retroviirusevastase monoteraapia esimeste tagasihoidlike õnnestumistega. Kuid peagi jätsid uuringu tulemused nii patsiendid kui ka arstid mitmeks aastaks ilma roosilistest illusioonidest.
1987. aastal registreeriti esimene HIV-nakkuse juhtum NSV Liidu kodanikul. Esimene laialdaselt kasutatav retroviirusevastane ravim oli zidovudiin: 1985. aastal läbis see kliinilised uuringud ja alates 1987. aasta märtsist hakati seda patsientidele välja kirjutama. Usk temasse oli suur, kuid esialgu polnud tema kandideerimise tulemused pehmelt öeldes muljetavaldavad. Sama juhtus ka teiste nukleosiidsete pöördtranskriptaasi inhibiitoritega – zaltsitabiini, didanosiini ja stavudiiniga, mis ilmusid aastatel 1991–1994. Sel ajal polnud HIV-nakkuse ravimiseks muid tõsiseid võimalusi ja mitu aastat taandusid kõik vaidlused olemasolevate ravimite ja nende raviskeemi tõhususe aruteluks. Paljud patsiendid, kes nakatusid HIV-i 1980. aastate alguses või keskel, hakkasid surema. Avati hospiitsid, tekkis järjest rohkem haigete tugirühmi ja ambulatoorseid õendusteenuseid. AIDS ja sellega kaasnev kõrge suremus on muutunud igapäevaseks. Mõned arstid hakkasid tõsiselt lootma "terviklikule ennetamisele". Kuid üldiselt valitses HIV-nakatunud inimeste ümber lootusetus. Aastatel 1989–1994 kasvas HIV-i esinemissagedus ja suremus tohutult. Kuid peagi – 1995. aasta septembris – äratasid meditsiiniringkondade tähelepanu Euroopa-Austraalia uuringu DELTA (Delta, 1995) ja Ameerika uuringu ACTG 175 (Hammer, 1996) tulemused. Nendest järeldub, et kahe nukleosiid-pöördtranskriptaasi inhibiitori kombinatsioon on efektiivsem kui monoteraapia. Tõepoolest, kahe kahjuliku kliinilise tulemuse (AIDS ja surm) esinemissagedus kahekordse ravi ajal oli oluliselt väiksem. Mõlemad uuringud näitasid, et äärmiselt oluline tundus olevat kahe ravimi samaaegne väljakirjutamine, mitte nende kordamööda kasutamine. Kahtlemata on retroviirusevastases ravis toimunud läbimurre. Selleks ajaks olid esimesed täiesti uue klassi, proteaasi inhibiitorite, ravimite uuringud kestnud juba mitu kuud. Detsembrist 1995 kuni märtsini 1996 kiideti HIV-nakkuse raviks heaks kolm ravimit: sakvinaviir, ritonaviir ja indinaviir. Kuid AIDS pole kuhugi kadunud. Patsiendid surid jätkuvalt: vähesed neist osalesid proteaasi inhibiitorite uuringutes ja neid, kes said tõeliselt tõhusat ravi, oli veelgi vähem. Kahtlused jäid. 1996. aasta veebruaris Washingtonis toimunud retroviiruste ja oportunistlike infektsioonide kolmandal konverentsil läks Bill Cameroni aruanne ABT-247 uuringu esimeste tulemuste kohta hinge. Publik tardus. Šokeeritud kuulajad said teada, et lihtsalt ritonaviiri suukaudse lahuse lisamine ravile vähendas AIDS-i patsientide suremust 38%-lt 22%-le. Kahjuks ilmnes paljude patsientide kombineeritud retroviirusevastane ravi liiga hilja: seda on laialdaselt kasutatud alates 1996. aastast. Mõned raskelt haiged suutsid AIDS-ile vastu seista, kuid isegi 1996. aastal tappis see paljusid. Kui 1996. aastal vähenes AIDS-i suremus suurtes HIV-ravikeskustes 1992. aastaga võrreldes poole võrra, siis väiksemates keskustes suri sellesse ikkagi iga viies patsient. Olgu kuidas on, aga uute ravimite võimalused muutusid järk-järgult üha ilmsemaks ja 1996. aasta juunis Vancouveris toimunud AIDSi maailmakonverents muutus tõeliseks pidupäevaks proteaasi inhibiitorite hiilguses. Isegi peamised uudistesaated käsitlesid AIDSi kokteilide kohta väga üksikasjalikult. Üllatavalt ebateaduslik termin "kõrgelt aktiivne retroviirusevastane ravi" (HAART) on levinud.
1996. aasta juuniks registreeriti esimene mittenukleosiidne pöördtranskriptaasi inhibiitor nevirapiin ja praktikasse tuli uus retroviirusevastaste ravimite klass. Ilmus veel üks proteaasi inhibiitor – nelfinaviir. AIDS-i juhtumite arv on dramaatiliselt vähenenud. 1996. ja 1997. aastal kõlasid esimesed patsientide kaebused pidurdamatu söögiisu ja kaalutõusu kohta. Kuid kas see on halb pärast nii palju aastaid kestnud kurnatust ja parenteraalset toitumist? Jah, ja proteaasi inhibiitorite koostis sisaldab laktoosi želatiiniga ja madala vireemia tagajärjel energiakulud langevad. Lisaks leidsid eksperdid, et söögiisu suurenemine patsientidel on üsna loomulik, kuna paranenud on nii immuunsuse seisund kui ka üldine heaolu. Võib-olla ainuke asi, mis spetsialiste mõnevõrra häbistas, olid lihavate patsientide kõhnad näod. Samal ajal kasvas patsientide rahulolematus vajadusega võtta peotäie tablette. 1997. aasta juunis teatas toidu- ja ravimiamet (FDA) esimest korda suurenenud diabeediriskist proteaasi inhibiitorite kasutamisel. 1998. aasta veebruaris veenis Chicagos toimunud retroviiruste ja oportunistlike infektsioonide konverents lõpuks arste, et proteaasi inhibiitorid ei ole nii selektiivsed, kui kaua arvati. Ja 1998. aasta alguses ilmus uus mõiste - lipodüstroofia. Selgub, et headel ravimitel on kõrvalmõjud. Vahepeal jäi lipodüstroofia tegelik põhjus täiesti ebaselgeks. Kuid juba 1999. aasta alguses tekkis Hollandis oletus, et lipodüstroofia põhjuseks on ravimite toksiline toime mitokondritele. Sarnaselt paljudele teistele lootustele on luhtunud ka algul nii teostatavana tundunud lootus HIV-nakkuse täielikust likvideerimisest (ja väljaravimisest). Muidugi ei suuda matemaatilised mudelid täpseid ennustusi anda. Kuid 1997. aastal loodeti neile: siis arvati, et HIV-i täielikuks ja püsivaks elimineerimiseks organismist kulub maksimaalselt kolm aastat ravi retroviirusevastaste ravimitega terapeutilistes annustes. Hävitamine – see on nende aegade võlusõna. Algselt sellele eraldatud periood pikenes aga iga järgneva konverentsiga. Loodusnähtuste ennustamine polegi nii lihtne ja uued uuringud on muutnud kõik kainenema: selgub, et HIV jääb ka pärast pikaajalist allasurumist rakkudesse latentseks.
Seni ei tea keegi, kui kaua need nakatunud rakud võivad elada ja kas paarist neist rakkudest piisab, et infektsioon ilma ravita uuesti ägeneks. Lõpuks leppisid eksperdid Barcelonas ülemaailmsel AIDSi konverentsil kokku sünge tõsiasjaga, et HIV-i kehast on võimatu vabaneda. Viimastel andmetel eeldaks see HIV-i nakatunud inimeselt retroviirusevastaste ravimite võtmist 50–70 aastat. Praegu saab kindlalt väita vaid üht: järgmise 10 aasta jooksul ei muutu HIV-nakkus ravitavaks.
Tänapäeval tundub mõistlikum mõelda mitte HIV-i hävitamisele, vaid võimalusele saada HIV-nakkuse pikaajalist, elukestvat ravi – samamoodi nagu iga kroonilise haiguse, näiteks diabeedi puhul. See aga tähendab, et patsiendid peavad ravimeid võtma aastaid, järgides kõige rangemat distsipliini. Igaüks, kes on kursis diabeedi raviga, mõistab väljakutseid, millega arstid ja patsiendid silmitsi seisavad, ning seda, kui oluline on lähiaastatel täiustada retroviirusevastaste ravimite kombinatsioone. Mitte iga HIV-nakatunud inimesel ei ole sellist enesedistsipliini ning vaimset ja füüsilist jõudu, et kümme, kakskümmend või isegi kolmkümmend aastat järjest ei kalduks ta sammugi ravirežiimist kõrvale ega võtaks mitu korda päevas ravimeid. sama aeg. Õnneks ei tundu see vajalik. Retroviirustevastaseid raviskeeme täiustatakse ja ajakohastatakse. Skeemi lähenemisel, mille kohaselt tuleb ravimeid võtta üks kord päevas ja võib-olla isegi kaks korda nädalas. Kuna viimasel ajal on antiretroviirusravi kahjulike mõjude kohta kogunenud rohkem teavet, on paljud praktikud oluliselt muutnud oma lähenemist sellele, paljusid varasemate aastate karme soovitusi on muudetud.
Retroviirusvastase ravi eesmärgid:
Kliiniline (patsientide eluea kestuse ja kvaliteedi suurenemine);
Viroloogiline (viiruse koormuse vähendamine määramata tasemeni ja säilimine maksimaalse perioodi jooksul);
immunoloogiline (immuunsüsteemi funktsiooni taastamine);
Epidemioloogiline (HIV-nakkusest põhjustatud surmajuhtumite arvu vähenemine).
Näidustused retroviirusevastaseks raviks:
Absoluutne:
HIV-oportunistlike haiguste esinemine;
Viirusekoormus üle saja tuhande koopia 1 µl-s;
CD 4 kogus on väiksem kui 200 1 µl-s;
Patsiendi kõrge ravisoostumus (ei sõltu staadiumist).
Sugulane:
CD 4 arv 200 kuni 350 1 µl-s.
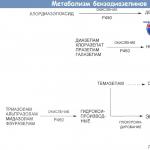
HIV-nakkuse raviks on praegu saadaval viis retroviirusevastaste ravimite rühma: nukleosiid- ja nukleotiid-pöördtranskriptaasi inhibiitorid (NRTI-d), mittenukleosiidsed pöördtranskriptaasi inhibiitorid (NNRTI-d), proteaasi inhibiitorid (PI-d), fusiooniinhibiitorid ja integraasi inhibiitorid.
Nukleosiid-pöördtranskriptaasi inhibiitorid (NRTI-d)
(Abakavir, Zidovudiin, Saltsitabiin, Didanosiin, Stavudiin, Emtritsitabiin, Lamivudiin, Tenofoviir)
NRTI-de toime on suunatud HIV ensüümi pöördtranskriptaasile. NRTI-d toimivad "vale ehitusplokina", konkureerides looduslike nukleosiididega, mille analoogid nad on ja erinevad neist vaid vähese muutuse poolest riboosi molekulis. Selle muutuse tõttu ei suuda nukleosiidi analoogid moodustada fosfodiestersidemeid, mis on vajalikud DNA kaksikahela ehitamiseks ja stabiliseerimiseks, nii et nende sisestamisel tekkivasse DNA-sse DNA süntees peatub. Toimimise alustamiseks peab NRTI esmalt sisenema rakku, seejärel läbima rakusisese fosforüülimise ja muutuma aktiivseks metaboliidiks - trifosfaadiks. Zidovudiin ja stavudiin on tümidiini analoogid ning zaltsitabiin, emtritsitabiin ja lamivudiin on tsütidiini analoogid. Seetõttu on mõttetu kombineerida zidovudiini stavudiiniga, zaltsitabiini lamivudiiniga või emtritsitabiini lamivudiiniga, kuna sellistes kombinatsioonides konkureerivad ravimid sama nukleosiidiga. Didanosiin on inosiini analoog ja muundatakse dideoksüadenosiintrifosfaadiks.
Abakaviir on guanosiini analoog. NRTI-resistentsus läheb väga sageli üle. NRTI-sid on lihtne kasutada, enamik neist võetakse üks kord päevas. Need on üldiselt hästi talutavad. Esimestel ravinädalatel täheldatakse sageli nõrkust, peavalu ja seedetrakti häireid. Viimased on mitmekesised – kergest ebamugavustundest kõhus kuni iivelduse, oksendamise ja kõhulahtisuseni – ning alluvad hästi sümptomaatilisele ravile.
Samal ajal on NRTI-del palju pikaajalisi kõrvaltoimeid, sealhulgas hematopoees, laktatsidoos, interstitsiaalne nefriit, polüneuropaatia ja pankreatiit. Kui varem seostati lipodüstroofiat ainult proteaasi inhibiitorite kasutamisega, siis nüüdseks on teada, et NRTI-d võivad põhjustada ka erinevaid lipiidide metabolismi häireid (peamiselt lipoatroofiat). NRTI-de pikaajalised kõrvaltoimed on tingitud toksilistest mõjudest mitokondritele. Fakt on see, et mitokondrid vajavad ka nukleosiide. Kui nad saavad tõeliste nukleosiidide asemel valesid, on nende ainevahetus häiritud ja nad degenereeruvad. Otsustades viimaste kliiniliste ja teaduslike andmete põhjal, erinevad NRTI-d üksteisest oluliselt mitokondritele avalduva toksilise toime raskusastme poolest. Seega kahjustab stavudiin mitokondreid rohkem kui abakaviiri.
NRTI-d elimineeruvad peamiselt neerude kaudu, mistõttu neil ei ole koostoimeid maksas metaboliseeruvate ravimitega. Sellega seoses ei ole NRTI-ravimite koostoimed nii levinud. Siiski võivad mõned ravimid (eriti ribaviriin), mis aktiveeruvad ka intratsellulaarse fosforüülimise teel, interakteeruda NRTI-de zidovudiini, stavudiini ja didanosiiniga.
Zidovudiin on esimene retroviirusevastane ravim. Tänapäeval kasutatakse zidovudiini väikestes - standardsetes - annustes, kuid kindlasti peaksid nad ravi ajal jälgima vere koostist. Zidovudiini pikaajaline kasutamine põhjustab peaaegu alati makrotsütoosi, mis on osaliselt adherentsi näitaja. Ei ole harvad juhud, kui zidovudiin põhjustab alguses seedetrakti häireid, kuid need taanduvad tavaliselt kiiresti. Müopaatia ja isegi kardiomüopaatia on zidovudiini harvaesinevad kõrvaltoimed. Üldiselt ei anna see palju pikaajalisi kõrvaltoimeid. Selle ravimi, mis on endiselt paljude HAART-režiimide ja retroviirusevastase profülaktika aluseks, peamised ja väga olulised eelised on neurotoksilisuse puudumine ja võime tungida kesknärvisüsteemi. Zidovudiin on osa kombinatsioonravimitest Combivir ja Trizivir. Nendes on selle üksikannus pisut suurem kui standardannus (mitte 250 mg, vaid 300 mg) ja seetõttu areneb nende tarbimise taustal vereloome pärssimine ja sellest tulenevalt aneemia mõnevõrra sagedamini.
Mittenukleosiidsed pöördtranskriptaasi inhibiitorid (NNRTI-d)
(Nevirapiin, efavirens, delavirdiin)
NNRTI-d, nagu NRTI-d, on suunatud HIV pöördtranskriptaasile. Erinevalt NRTI-dest ei toimi see ravimite rühm vale ehitusmaterjalina, vaid seostub otseselt ja mittekonkureerivalt pöördtranskriptaasiga selle nukleosiidi kinnituskoha vahetus läheduses. Saadud kompleks
blokeerib pöördtranskriptaasi sidumissaidi, mille tulemusena seondub ensüüm väiksema arvu nukleosiididega ja polümerisatsiooniprotsess aeglustub oluliselt. Erinevalt NRTI-dest ei vaja NNRTI-d rakusisest aktiveerimist.
Kolm praegu saadaolevat NNRTI-d – nevirapiin, delavirdiin ja efavirens – ilmusid aastatel 1996–1998.
Risk ristuva ravimiresistentsuse tekkeks NNRTI-de võtmise ajal on väga suur ja see võib areneda väga kiiresti – ühest punktmutatsioonist hüdrofoobse sidumiskoha positsioonis 103 (K103N) piisab terve rühma retroviirusevastaste ravimite raviarsenalist väljajätmiseks. ! Ravimiresistentsuse juhtumeid on kirjeldatud isegi naistel, kes võtsid nevirapiini üks kord sünnituse ajal, et vältida HIV-i ülekandumist lapsele. Ja see pole haruldane. Kahe suure uuringu kohaselt on NNRTI-resistentsuse mutatsioonide esinemissagedus pärast perinataalset profülaktikat nevirapiiniga 14–32%. NNRTI-sid sisaldavad raviskeemid on väga haavatavad ja kui viiruskoormust piisavalt alla ei suruta, põhjustab ravimimuudatuste edasilükkamine peaaegu kindlasti resistentsuse kõigi NNRTI-de suhtes. NNRTI-de tühistamisega ei kaasne immunoloogilisi ega viroloogilisi muutusi. Seda seetõttu, et NNRTI-resistentsuse mutatsioonid ei vähenda HIV-i paljunemisvõimet nii palju kui PI- või NRTI-resistentsuse mutatsioonid. NNRTI kombineerituna kahe NRTI-ga on äärmiselt tõhus. NNRTI-d on immuunsüsteemi taastamise ja ravimata patsientide viiruskoormust pärssiva võime poolest vähemalt sama head kui proteaasi inhibiitorid. Lihtne annustamisskeem ja üldiselt hea talutavus on aga võimaldanud nevirapiinil ja efavirensil võtta HAART-raviskeemis silmapaistva koha – neid kasutatakse isegi sagedamini kui PI-sid. Viimastel aastatel on paljud randomiseeritud uuringud suutnud näidata, et juba saavutatud hea viroloogilise toime korral saab HAART-režiimis PI-d valutult asendada NNRTI-dega. Veelgi enam, viiruskoormuse ohjeldamine NNRTI-dele üleminekuga oli mõnikord isegi parem kui eelmise PI-režiimiga ravi jätkamisel. NNRTI-de kõrvaltoimed on seotud ravimite koostoimetega ja sageli tekivad lööbed.
Nevirapiin on esimene heakskiidetud NNRTI. Seda on edukalt kasutatud HIV-i emalt lapsele edasikandumise ärahoidmiseks. Nagu ka teiste NNRTI-de puhul, piisab olulise ravimiresistentsuse tekkeks ühest mutatsioonist. Nevirapiin võimaldab HAART raviskeeme lihtsustada, kaotamata nende efektiivsust. Allergiliste reaktsioonide vältimiseks alustage ravi kindlasti sissejuhatava skeemiga.
See on pikka aega hästi talutav ja ei põhjusta väljendunud lipiidide profiili häireid. Peamine puudus, lisaks resistentsuse tekkele, on hepatotoksilisus esimestel ravikuudel. Nevirapiin kombinatsioonis zidovudiini + didanosiini kombinatsiooniga on võib-olla vanim HAART raviskeem, kui see osutus raske immuunpuudulikkusega patsientidel monoteraapiast ja kahekordsest retroviirusevastasest raviskeemist paremaks. Need eelised ilmnesid nii HIV-nakkuse ellujäämise kui ka kliinilise progresseerumise osas. Nevirapiin põhjustab maksaensüümide aktiivsuse tõusu 16% patsientidest; mõnikord on maksafunktsiooni häired rasked. Sellega seoses tuleks ravimi annuse valimine alati läbi viia maksafunktsiooni biokeemiliste parameetrite kontrolli all. 15–20% patsientidest põhjustab nevirapiin löövet. Nevirapiinil on positiivne mõju lipiidide metabolismile. Nevirapiini võib manustada üks kord ööpäevas annuses 400 mg.
Proteaasi inhibiitorid (PI)
(Amprenaviir, Atasanaviir, Fosamprenaviir, Indinaviir, Lopinaviir/ritonaviir (Kaletra), Nelfinaviir (Viracept), Ritonaviir (Norvir), Saquinavir (Invirase, Fortovaza)).
HIV proteaas lõikab Gag-Pol polüproteiini üksikuteks valkudeks. Selle allasurumisel katkeb viiruse mRNA splaissimine ja küpsemine, mille tulemusena moodustuvad viirusosakesed, mis ei ole võimelised uusi rakke nakatama. Esimesed IP-d ilmusid 1990. aastate alguses, kui HIV proteaasi struktuur sai teatavaks. Teadlased on välja töötanud ravimi, mille struktuur võimaldab sellel täpselt sobituda HIV proteaasi aktiivsesse kohta.
Viimastel aastatel on PI-sid sageli kritiseeritud nende pillide rohkuse ja kõrvaltoimete pärast, kuid sellegipoolest on neil HAART-is jätkuvalt oluline roll, eriti patsientidel, kes juba saavad retroviirusevastast ravi.
Erinevused erinevate vahendite vahel ei ole nii suured, et selle rühma ühtki vahendit täielikult diskrediteerida. Kaks tähelepanu väärivat erandit on sakvinaviir TFA (kõvad želatiinkapslid) ja puhas ritonaviir. Tugevdatud PI-d on ilmselt tõhusamad.
Lisaks asjaolule, et kõigil PI-del on kõrvaltoime seedetraktile ja need nõuavad suure hulga tablettide võtmist, võivad need pikaajalisel kasutamisel põhjustada lipodüstroofiat ja düslipoproteineemiat. Ritonaviir põhjustab rohkem väljendunud hüperlipoproteineemiat kui sakvinaviir või nelfinaviir.Lisaks tekivad ritonaviir ja võimendatud proteaasi inhibiitorid sageli tugevate ravimite koostoimeteks. Samuti on teatatud, et PI-d põhjustavad seksuaalfunktsiooni häireid. Suureneb risk ristuva ravimiresistentsuse, osteoporoosi, osteodüstroofia ja urolitiaasi suhtes. Hüperlipideemia on retroviirusevastase ravi sagedane kõrvalnäht, eriti kui seda ravitakse proteaasi inhibiitoreid sisaldavate raviskeemidega.
Sakvinaviir on esimene proteaasi inhibiitor, mis on litsentseeritud HIV-nakkuse raviks 1995. aastal. See on üldiselt hästi talutav, välja arvatud seedetrakti häired, ega põhjusta tõsiseid varajasi kõrvaltoimeid. Seda kasutatakse peaaegu alati koos ritonaviiri väikeste annustega. 2005. aastal kiideti heaks 500 mg kaetud tabletid, tänu millele vähenes tablettide arv 10 tabletilt 2 korda päevas koos 100 mg ritonaviiriga Kõrvaltoimed: ülekaalus on seedetrakti häired: kõhulahtisus, iiveldus, ebamugavustunne kõhus. kõht, düspepsia; laboratoorsed häired: CPK aktiivsuse isoleeritud tõus, glükoositaseme langus või tõus, aminotransferaaside aktiivsuse tõus, neutropeenia. Sarnaselt teiste proteaasi inhibiitoritega võib pikaajaline ravi sakvinaviiriga põhjustada lipodüstroofiat, düslipideemiat ja glükoositaluvuse häireid.
Läbitungimise inhibiitorid(enfuvirtiid)
HIV-i sisenemise protsess sihtrakku, st CD4 lümfotsüüti, koosneb kolmest peamisest etapist:
1. HIV kinnitumine membraaniretseptorile – CD4 molekulile (kinnitumisinhibiitorite sihtmärk),
2. HIV koostoime kaasretseptoritega (sihtmärk kaasretseptori blokaatoritele),
3. HIV sulandumine lümfotsüüdiga (fusiooni inhibiitorite sihtmärk).
Teoreetiliselt saab iga läbitungimisetappi mõjutada ja blokeerida. Kolm tänapäeval eksisteerivat ravimite klassi – kinnitumise inhibiitorid, koretsepto-
kraavi ja fusiooni inhibiitorid on rühmitatud läbitungimise inhibiitorite alla.
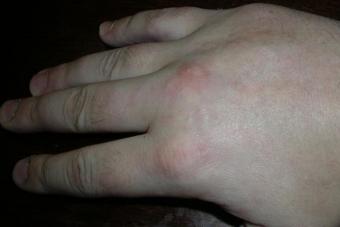
Enfuvirtiid on fusiooni inhibiitorite eelkäija. See on suhteliselt suur 36 aminohappest koosnev peptiid ja seetõttu tuleb seda süstida subkutaanselt nagu insuliini. See seondub HIV välise ümbrise valgu gp41 vahestruktuuriga, mis ilmub viiruse pinnale, kui see sulandub sihtraku membraaniga. Enfuvirtiidi toime jälgimine on vajalik selle kasutamise algusest peale – seda nõuab eelkõige selle kõrge hind. Kui viiruskoormus ei vähene pärast 8-12-nädalast ravi selle ainega vähemalt 1 log10 (10 korda), ei tohiks sellest suuremat kasu oodata ja patsient võib säästa nahaaluse süstimise vajadusest kaks korda päevas. . Seda kasutatakse HIV-infektsiooni kombineeritud retroviirusevastase ravi osana juhtudel, kui teised retroviirusevastased ravimid ei suuda HIV replikatsiooni pärssida. Üldiselt hästi talutav. Peaaegu kõigil patsientidel tekib aga reaktsioon süstekohas: erüteem, põletik, induratsioon, lööve (süstekohta tuleks vahetada). Põletik võib tekkida erinevates kohtades. Litsentsiga uuringutes vajas ligikaudu 10% patsientidest vahelduvat valuvaigistite kasutamist või mõnikord ei saanud nad igapäevaste tegevustega tegeleda. Kuid ainult 3% patsientidest katkestas ravi. Mõnede teadete kohaselt suureneb enfuvirtiidiga bakteriaalse kopsupõletiku risk. See on eriti oluline patsientidel, kellel on risk haigestuda kopsupõletikku (madal CD4 arv, suur viiruskoormus, uimastite süstimine, suitsetamine, anamneesis kopsuhaigus). Ülitundlikkusreaktsioonid, lööve, palavik, iiveldus, külmavärinad, arteriaalne hüpotensioon, maksa aminotransferaaside aktiivsuse suurenemine on haruldased.
Integraasi inhibiitorid (II)- see on uus retroviirusevastaste ravimite rühm, millest enamik on praegu läbimas prekliinilisi ja kliinilisi uuringuid. Selle rühma ravimid takistavad HIV-i genoomi DNA koopia sisestamist raku genoomi. Praegu on Venemaal registreeritud ainult üks selle rühma ravim, raltegraviir.
Esimese rea HAART-režiimid.
2 NRTI-d + PI.
Eelised:
Palju tõendeid: uuritud kliinilised tulemused, kasutamine raske immuunpuudulikkuse korral;
Pikaajalisi mõjusid on uuritud;
Ravimiresistentsuse kõrge geneetiline barjäär (vajalik on mitu mutatsiooni).
Puudused:
Suur hulk pille (mõnede vanemate PI-de kasutamisel), mõnikord raske raviskeem;
Sagedased ravimite koostoimed;
Ristresistentsuse kujunemisega mõne PI suhtes väheneb ravimite valik;
Enamik PI-sid põhjustab pikaajalisi kõrvaltoimeid, lipodüstroofiat, düslipoproteineemiat.
Kaks NRTI-d + lopinaviir/ritonaviir
See on tänapäeval üks levinumaid skeeme. Paljud soovitused viitavad sellele eelistatud soovituste hulka. Sellel on hea pikaajaline efektiivsus. Vastupidavust sellele pole veel kirjeldatud. Kõige sagedamini kasutatakse stavudiini + lamivudiini baaskombinatsiooni koos lopinaviiri/ritonaviiriga. Häid tulemusi saavutatakse ka tenofoviiri + emtritsitabiini põhikombinatsiooni kasutamisel.
Kaks NRTI-d + sakvinaviir/ritonaviir
Zidovudiini + zaltsitabiini + sakvinaviiri TFA režiim oli esimene kahe NRTI kombinatsioon proteaasi inhibiitoritega, millel on randomiseeritud uuringus näidatud positiivne mõju ellujäämisele.
Praegu kasutatakse sakvinaviiri tavaliselt koos võimendatud ritonaviiriga ja kombinatsioonis teiste NRTI põhikombinatsioonidega. Kui sakvinaviiri ritonaviiriga ei võimendata, peavad patsiendid võtma liiga palju tablette ja ravimi biosaadavus on liiga madal. Sakvinaviir/ritonaviir on paremini talutav kui indinaviir/ritonaviir, mida ei soovitata enam kasutada varases HAART raviskeemis. Sakvinaviiri (1000 mg) kombinatsioon ritonaviiriga (100 mg) on heaks kiidetud kasutamiseks kaks korda päevas. Sakvinaviir on praegu saadaval ka 500 mg tablettidena.
Abakaviir + lamivudiin + fosamprenaviir
Uus kombinatsioonravim abakaviiri ja lamivudiini Kivexa abil saate neid ravimeid võtta üks kord päevas. Abakaviiri + lamivudiini põhikombinatsiooni puhul on kõige parem kasutada fosamprenaviiri. Efavirens toimis hästi ka kombinatsioonis abakaviiri + lamivudiini kombinatsiooniga. Siiski ei tohiks abakaviiri + lamivudiini kombinatsioonis NNRTI-ga lisada esmavaliku HAART-raviskeemidesse, kuna allergilise reaktsiooni korral on põhjust väga raske kindlaks teha (põhjuseks võivad olla nii abakaviiri kui ka NNRTI-d) ja seetõttu väheneb edasise ravi võimaluste valik.
Kaks NRTI-d + nelfinaviir
Nelfinaviiri raviskeemid on pikka aega olnud ühed kõige sagedamini välja kirjutatud raviskeemid. Litsentsiga kliinilistes uuringutes kasutati nelfinaviiri peamiselt koos zidovudiini + lamivudiini baaskombinatsiooniga. Nelfinaviir ei ole oma efektiivsuselt madalam kui ritonaviiri ja on ka palju paremini talutav. Samal ajal ei olnud nelfinaviiri efektiivsus nii kõrge, kui võrrelda seda teiste proteaasi inhibiitoritega, eriti fosamprenaviiriga (võimendatud ja ilma) ja lopinaviiri/ritonaviiriga. . Nelfinaviiri sisaldavatel raviskeemidel on suur pillide arv ja need põhjustavad kõhulahtisust ning neid ei soovitata enam kasutada.
Kõik, kes on viimastel aastatel retroviirusevastase raviga tegelenud, on selle tõuse ja mõõnasid omal nahal kogenud. See artikkel pakub huvi kõigile, kes on oma elus HIV-iga kokku puutunud, olenemata sellest, milline kutsetegevus seob teid HIV-i või kroonilise haigusega, millega teie või teie sugulane on kokku puutunud.
Loodame, et kirjeldatud lugu veenab ka neid, kes veel kahtlevad, et efektiivne HIV-ravi pole hetkel võimalik ilma retroviirusevastase ravita. Artikkel on kirjutatud väga arusaadavas keeles, reetes aktivistide, arstide ja HIV-i nakatunute emotsioone.
Lootus ja esimesed õnnestumised
Retroviirusevastase ravi koidik – 1987-1990. Seda perioodi seostatakse retroviirusevastase monoteraapia suure lubaduse ja esimese tagasihoidliku eduga (Volberding, 1990; Fischl, 1990). Peagi aga jätsid Concorde’i uuringu tulemused (Hamilton, 1992; Concorde, 1994) nii patsiendid kui ka arstid mitmeks aastaks ilma roosilistest illusioonidest. Esimene laialdaselt kasutatav retroviirusevastane ravim oli zidovudiin: 1985. aastal läbis see kliinilised uuringud ja alates 1987. aasta märtsist hakati seda patsientidele välja kirjutama. Usk temasse oli suur, kuid esialgu polnud tema kandideerimise tulemused pehmelt öeldes muljetavaldavad. Sama juhtus ka teiste nukleosiidsete pöördtranskriptaasi inhibiitoritega – zaltsitabiini, didanosiini ja stavudiiniga, mis ilmusid aastatel 1991–1994.
Sel ajal polnud HIV-nakkuse ravimiseks muid tõsiseid võimalusi ja mitu aastat taandusid kõik vaidlused olemasolevate ravimite ja nende raviskeemi tõhususe aruteluks. Eelkõige ei suutnud eksperdid väga pikka aega kokku leppida, kas patsiendid peaksid öösel ärkama, et võtta kuues zidovudiini annus. Paljud 1980. aastate alguses või keskel HIV-ga nakatunud patsiendid hakkasid surema. Avati hospiitsid, tekkis järjest rohkem haigete tugirühmi ja ambulatoorseid õendusteenuseid. AIDS ja sellega kaasnev kõrge suremus on muutunud igapäevaseks. Samal ajal on oportunistlike infektsioonide vastases võitluses tehtud selgeid edusamme: trimetoprim/sulfametoksasool, pentamidiin, gantsükloviir, foskarnet ja flukonasool on pikendanud palju eluigasid, kui vaid korraks. Mõned arstid hakkasid tõsiselt lootma "terviklikule ennetamisele". Kuid üldiselt valitses HIV-positiivsete ümber lootusetus. Paljud mäletavad, kui sünge ja masendunud õhkkond valitses 1993. aasta juunis Berliinis toimunud IX ülemaailmsel AIDSi konverentsil. Aastatel 1989–1994 kasvas HIV-i haigestumine ja suremus tohutult.
Uus klass - proteaasi inhibiitorid
Kuid peagi, 1995. aasta septembris, äratasid meditsiiniringkondade tähelepanu Euroopa-Austraalia uuringu DELTA (Delta, 1995) ja Ameerika uuringu ACTG 175 (Hammer, 1996) tulemused. Nendest järeldub, et kahe nukleosiid-pöördtranskriptaasi inhibiitori kombinatsioon on efektiivsem kui monoteraapia. Tõepoolest, kahe kahjuliku kliinilise tulemuse (AIDS ja surm) esinemissagedus kahekordse ravi ajal oli oluliselt väiksem. Mõlemad uuringud näitasid, et äärmiselt oluline tundus olevat kahe ravimi samaaegne väljakirjutamine, mitte nende kordamööda kasutamine. Kahtlemata on retroviirusevastases ravis toimunud läbimurre. Selleks ajaks olid esimesed täiesti uue ravimiklassi, proteaasi inhibiitorite uuringud kestnud juba mitu kuud. Need loodi teaduslaborites HIV-i ja selle proteaasi molekulaarstruktuuri andmete põhjal. Nende kliiniline tähtsus oli ebaselge.
Vahepeal said teatavaks proteaasi inhibiitorite kliiniliste uuringute esialgsed tulemused ja järk-järgult levisid kuulujutud nende tõhususe kohta. 1995. aasta sügisel puhkes kolme ravimifirma (Abbott, Roche ja MSD) vahel kibe võitlus. Püüdes tuua turule esimest proteaasi inhibiitorit, viisid igaüks neist läbi oma ravimi – ritonaviiri, sakvinaviiri ja indinaviiri – intensiivsed kliinilised uuringud. Teadlased ei lahkunud kliinilistest baasidest nädalateks, töödeldes öösiti vaatlusandmeid ja tuhandeid küsimustikke. Selle raske töö tulemusena kiideti 1995. aasta detsembrist 1996. aasta märtsini HIV-nakkuse raviks heaks kõik kolm ravimit: esiteks sakvinaviir, seejärel ritonaviir ja lõpuks indinaviir.
Paljud arstid ei teadnud, mis nende kuude jooksul täpselt juhtus. AIDS pole kuhugi kadunud. Patsiente suri jätkuvalt: vähesed neist osalesid proteaasi inhibiitorite uuringutes ja veelgi vähem neid, kes said meie kaasaegsete ideede kohaselt tõeliselt tõhusat ravi. Kahtlused jäid. Viimastel aastatel on liiga palju kordi lootused imerohtudele luhtunud. 1996. aasta jaanuari alguses valmistasid kõigile muret muud probleemid: palliatiivne ravi, tsütomegaloviiruse infektsiooni ravi, Mycobacterium avium-intracellulare nakkus, HIV kahheksia ja valud, ambulatoorse vedelikuravi korraldamine ja isegi eutanaasia.
AIDS-i surmajuhtumite vähendamine
1996. aasta veebruaris Washingtonis toimunud 3. retroviiruste ja oportunistlike infektsioonide konverentsil jäid õhtusel istungil osalejad hingetuks, kui Bill Cameron esitles ABT-247 uuringu esimesi tulemusi. Publik tardus. Šokeeritud kuulajad said teada, et lihtsalt ritonaviiri suukaudse lahuse lisamine ravile vähendas AIDS-i patsientide suremust 38%-lt 22%-le (Cameron, 1998). Retroviirustevastane ravi pole kunagi varem tundnud nii sensatsioonilisi tulemusi!
Kahjuks ilmnes paljude patsientide kombineeritud retroviirusevastane ravi liiga hilja: seda on laialdaselt kasutatud alates 1996. aastast. Mõned raskelt haiged suutsid AIDS-ile vastu seista, kuid isegi 1996. aastal tappis see paljusid. Kui AIDSiga seotud surmajuhtumite arv suurtes HIV-ravikeskustes vähenes 1996. aastal poole võrra võrreldes 1992. aastaga (Brodt, 1997), siis iga viies patsient suri sellesse siiski väiksemates keskustes.
Olgu kuidas on, aga uute ravimite võimalused muutusid järk-järgult üha ilmsemaks ja 1996. aasta juunis Vancouveris toimunud AIDSi maailmakonverents muutus tõeliseks pidupäevaks proteaasi inhibiitorite hiilguses. Isegi peamised uudistesaated käsitlesid AIDSi kokteilide kohta väga üksikasjalikult. Üllatavalt ebateaduslik termin "kõrgelt aktiivne retroviirusevastane ravi" (HAART) on levinud. Arstid seevastu olid liiga õnnelikud, et üldisest entusiasmist mitte nakatuda.
"Hivist varem ja tugevamalt võita!"
Selleks ajaks oli ajakiri Time 1996. aastal aasta inimeseks tunnistatud dr David Ho lõpetanud uuringu, mis heitis valgust HIV-i elutsüklile, mida varem oli väga valesti esitatud (Ho, 1995; Perelson, 1996). Dr Ho aasta varem välja kuulutatud loosung “Võida HIV-ist kiiremini ja kõvemini!” on nüüdseks omaks võtnud peaaegu kõik arstid. Saanud teada, et HIV paljuneb inimkehas pidevalt ja aktiivsemalt, halastamatult, päevast päeva hävitades CD4 lümfotsüüte, ei mõelnud keegi enam “HIV-nakkuse varjatud faasist” ega kujutanud ette elu ilma retroviirusevastase ravita. Paljudes HIV-ravikeskustes said peaaegu kõik patsiendid HAART-i. Vaid kolme aastaga, aastatel 1994–1997, langes Euroopas retroviirusevastast ravi mittesaavate patsientide osakaal 37%-lt ligikaudu 9%-le ja HAART-i saanud patsientide osakaal kasvas 2%-lt 64%-le (Kirk, 1998).
Olukord oli soodne. 1996. aasta juuniks registreeriti esimene mittenukleosiidne pöördtranskriptaasi inhibiitor nevirapiin ja praktikasse tuli uus retroviirusevastaste ravimite klass. Ilmunud on veel üks proteaasi inhibiitor, nelfinaviir. Enamikul juhtudel olid ravimid hästi talutavad. Kas ma peaksin võtma 30 tabletti päevas? Palun, lihtsalt aidake! AIDS-i juhtumite arv on dramaatiliselt vähenenud. Aastatel 1994–1998, see tähendab vaid 4 aastaga, vähenes AIDS-i esinemissagedus Euroopas enam kui 10 korda – 30,7%-lt 2,5%-le. Mõnede kohutavate oportunistlike infektsioonide, eriti tsütomegaloviiruse ja Mycobacterium avium-intracellulare põhjustatud infektsioonide esinemissagedus on veelgi märgatavamalt langenud. Silmaarstid, kes tegelesid HIV-nakkuse silmahaigustega, pidid end ümber koolitama. Vaid paar kuud varem alanud suured kliinilised uuringud oportunistlike infektsioonide ravi kohta komistasid patsientide vähesuse pärast. Varem hea varustusega hospiitsid on olnud sunnitud sulgema või tegevust muutma. Esimesed patsiendid hakkasid tööle naasma. Ambulatoorsed õendusabi teenused kaotasid kliente. AIDS-i palatid täitusid nüüd teiste patsientidega.
1996. ja 1997. aastal kõlasid esimesed patsientide kaebused pidurdamatu söögiisu ja kaalutõusu kohta. Kuid kas see on halb pärast nii palju aastaid kestnud kurnatust ja parenteraalset toitumist? Jah, ja proteaasi inhibiitorite koostis sisaldab laktoosi želatiiniga ja madala vireemia tagajärjel energiakulud langevad. Lisaks leidsid eksperdid, et söögiisu suurenemine patsientidel on üsna loomulik, kuna paranenud on nii immuunsuse seisund kui ka üldine heaolu. Võib-olla ainuke asi, mis spetsialiste mõnevõrra häbistas, olid lihavate patsientide kõhnad näod. Samal ajal kasvas patsientide rahulolematus vajadusega võtta peotäie tablette.
Lipodüstroofia
1997. aasta juunis teatas Food and Drug Administration (FDA) esmakordselt proteaasi inhibiitorite kasutamisel suurenenud diabeediriskist (Ault, 1997). 1998. aasta veebruaris veenis Chicagos toimunud retroviiruste ja oportunistlike infektsioonide konverents lõpuks arste, et proteaasi inhibiitorid ei ole nii selektiivsed, kui kaua arvati. Plakat järgnes plakatile ja nüüd oli kogu sein täidetud fotodega patsientidest, kellel olid suured kõhud, "pulli küürud", peenikesed käed ja jalad, kõhn nägu. Ja 1998. aasta alguses ilmus uus mõiste - lipodüstroofia. Nüüdsest on sellel tohutu mõju retroviirusevastasele ravile. Iidne meditsiinitarkus sai taas kinnitust - nüüd HAART-iga - kõigil headel ravimitel on kõrvalmõjud. Vahepeal jäi lipodüstroofia tegelik põhjus täiesti ebaselgeks. Kuid juba 1999. aasta alguses tekkis Hollandis oletus, et lipodüstroofia põhjuseks on ravimite toksiline toime mitokondritele. Täna teavad seda kõik HIV-nakkuse raviga seotud inimesed.
Kolm aastat retroviirusevastast ravi ja paranemist
Sarnaselt paljudele teistele lootustele on luhtunud ka algul nii teostatavana tundunud lootus HIV-nakkuse täielikust likvideerimisest (ja väljaravimisest). Muidugi ei suuda matemaatilised mudelid täpseid ennustusi anda. Kuid 1997. aastal loodeti neile: siis arvati, et HIV-i täielikuks ja püsivaks elimineerimiseks organismist kulub maksimaalselt kolm aastat ravi retroviirusevastaste ravimitega terapeutilistes annustes.
Hävitamine on nende aegade võlusõna. Algselt sellele eraldatud periood pikenes aga iga järgneva konverentsiga. Loodusnähtuste ennustamine polegi nii lihtne ja uued uuringud on muutnud kõik kainenema: selgub, et HIV jääb ka pärast pikaajalist allasurumist rakkudesse latentseks. Seni ei tea keegi, kui kaua need nakatunud rakud võivad elada ja kas paarist neist rakkudest piisab, et infektsioon ilma ravita uuesti ägeneks. Lõpuks leppisid eksperdid Barcelonas ülemaailmsel AIDSi konverentsil kokku sünge tõsiasjaga, et HIV-i kehast on võimatu vabaneda. Viimastel andmetel eeldaks see HIV-positiivselt inimeselt retroviirusevastaste ravimite võtmist 50-70 aastat. Seni saab kindlalt väita vaid üht: järgmise 10 aasta jooksul ei muutu HIV-nakkus ravitavaks.
HIV-nakkuse eluaegne ravi
Tänapäeval tundub mõistlikum mõelda mitte HIV-i hävitamisele, vaid võimalusele saada HIV-nakkuse vastu pikaajalist, elukestvat ravi – samamoodi nagu iga kroonilise haiguse, näiteks suhkurtõve puhul. See aga tähendab, et patsiendid peavad ravimeid võtma aastaid, järgides kõige rangemat distsipliini. Igaüks, kes on kursis diabeedi raviga, mõistab väljakutseid, millega arstid ja patsiendid silmitsi seisavad, ning seda, kui oluline on lähiaastatel täiustada retroviirusevastaste ravimite kombinatsioone. Mitte igal HIV-positiivsel ei ole sellist enesedistsipliini ning vaimset ja füüsilist jõudu, et kümme, kakskümmend või isegi kolmkümmend aastat järjest ei kalduks ta sammugi ravirežiimist kõrvale ja võtaks mitu korda päevas ravimeid. sama aeg. Õnneks ei tundu see vajalik. Retroviirustevastaseid raviskeeme täiustatakse ja ajakohastatakse. Skeemi lähenemisel, mille kohaselt tuleb ravimeid võtta üks kord päevas ja võib-olla isegi kaks korda nädalas.
Kuna teave retroviirusevastase ravi kahjulike mõjude kohta on viimase kolme aasta jooksul suurenenud, on paljud praktikud oluliselt muutnud lähenemist sellele. 2000. aastaks olid paljud varasemate aastate karmid soovitused üle vaadatud. Enamasti on tänapäeval levinum sõna „Hirmustage HIV-i varem ja kõvemini!” kui „Lööge HIV-i nii tugevalt kui võimalik, kuid ainult vajaduse korral” (Harrington ja Carpenter, 2000). Nüüd oli pikkade arutelude põhiteemaks lihtne küsimus: "Millal alustada ravi?" Vastus sellele nõuab sageli äärmist ettevaatust.
Mida iganes skeptikud ka ei ütleks, HAARTi võimalusi ei tohi unustada. Ta on võimeline imedeks! Tänu HAART-ile paraneb krüptosporidioos ja Kaposi sarkoom täielikult, ravitakse isegi progresseeruvat multifokaalset leukoentsefalopaatiat ning kaob vajadus tsütomegaloviiruse infektsiooni ennetamiseks. Kuid HAARTi peamine eelis on patsientide heaolu märkimisväärne paranemine, kuigi mõned avaliku elu tegelased ja AIDS-i konsultandid ei taha seda tunnistada.
Skepsist HAART-i suhtes on osalt tingitud asjaolust, et paljud Lääne noored arstid, kes alustasid HIV-nakkuse raviga alles 1990. aastate lõpus, lihtsalt ei tea, mis on AIDS. Nende jaoks on AIDS haruldus, raske haigusjuht, mille arengut saab peatada. Nad ei tabanud AIDSi-vastase võitluse "kiviaega".
Tõenduspõhise meditsiini põhimõte
HIV-nakkuse raviga tegelevad arstid peaksid ehk rohkem kui keegi teine, jäädes uutele meetoditele avatuks, meeles pidama oma eriala "kiviaega". Igaüks, kes on kategooriliselt teraapia katkestamise vastu ja peab kangekaelselt kinni jäikadest skeemidest, mitte ainult ei jää kaasaegsest reaalsusest eemale, vaid kaotab ka oma elegantsi. Kes ei viitsi uusi teadmisi omandada ega käi mitu korda aastas spetsiaalsetel konverentsidel, ei saa ka oma patsiente korralikult ravida, sest lähenemised HIV-nakkuse ravile muutuvad vähemalt iga kahe-kolme aasta tagant.
Igaüks, kes järgib rangelt tõenduspõhise meditsiini põhimõtteid ja ei kaldu oma praktikas ametlikest soovitustest sammugi kõrvale, jääb kiiresti elust maha. HIV-meditsiin areneb pidevalt. Soovitused on lihtsalt soovitused. Paljud neist on avaldamise ajal juba aegunud. Selles valdkonnas ei ole rangeid reegleid. Samas eksivad ka need, kes aktsepteerivad valiku juhuslikkust vabadusena või usuvad, et fundamentaaluuringute andmeid võib ignoreerida. Individuaalne lähenemine ravile ei tähenda, et saate ravida nii, nagu peate. Lisaks tuleks lõplikult meeles pidada: vastutust raviskeemi halva järgimise eest patsiendiga jagab arst. Ja edasi. Isegi paljud kogenud arstid jätavad tähelepanuta olulise reegli: igal patsiendil on õigus teada, miks talle seda või teist ravi on ette nähtud või mitte.
MIS ON ANTIRETROVIIRUSNE RAVI (KUNST)?
. MIS ON KUNST?
. HIV ELUtsükkel?
. REGISTREERITUD ARV-d
. KUIDAS ARVOTEID KASUTATAKSE?
. KAS NEED RAVIMID SAAVAD RAVIDA AIDSI?
. MILLAL ALUSTADA RAVI?
. MILLISEID ARVI KASUTADA?
. MIS JÄRGMISEKS?
MIS ON ARV-RAVI?
ARV-ravi tähendab viirusnakkuste, nagu HIV, ravi ravimitega. Ravimid ei tapa viirust, vaid aeglustavad selle arengut. Kui viiruse areng aeglustub, aeglustub ka HIV-haiguse areng. Retroviirusevastaseid ravimeid nimetatakse ka ARV-deks ja ARV-ravi nimetatakse ka ART-ks.
HIV ELUtsükkel?
HIV elutsüklis on mitu etappi. Lisateabe saamiseks vaadake br. 400.
1. Vereringes ringleb iseseisev viirus.
2. HIV liitub rakuga.
3. HIV nakatab rakku.
4. HIV geneetiline kood (RNA) muudetakse ensüümi toimel DNA-ks
pöördtranskriptaas.
5. HIV DNA kinnitub raku DNA-le integraasi ensüümi abil.
6. Kui nakatunud rakk paljuneb, aktiveerib see HIV DNA, luues
seega materjale uute HIV-viiruste tekkeks.
7. Ainerühmi uute viiruste loomiseks tuleb pidevalt juurde. 8. Ebaküps viirus lahkub nakatunud rakust (see protsess
mida nimetatakse "loobumiseks").
9. Ebaküps viirus vabaneb nakatunud rakust.
10. Areneb uus viirus; selle arendamiseks vajalikud materjalid ekstraheeritakse proteaasi ensüümi abil ja monteeritakse aktiivse viiruse keskele.
HEAKSKIIDETUD ARV-RAHVID
Iga ARV-ravimite tüüp või "klass" ründab HIV-i teatud viisil. Esimene HIV-vastaste ravimite klass oli nukleosiid-pöördtranskriptaasi inhibiitorid, mida nimetatakse ka nukleoteraapia ravimiteks. Need ravimid toimivad blokeerides 4. etapi, mil HIV-i geneetiline materjal muundatakse RNA-st DNA-ks. Sellesse klassi kuuluvad ravimid hõlmavad:
. AZT (ZDV, zidovudiin, Retrovir®)
. ddI (didanosiin, Videx®)
D4T (Stavudine, Zerit®)
. 3TC (Lamivudine Epivir®)
. Abakaviir (Ziagen®)
. Tenofoviir (Viread®)
. Combivir® (AZT/3TS kombinatsioon)
. Trivisir® (AZT/3TC/Abaquir kombinatsioon)
. Emtritsitabiin (FTC, Emtriva®)
. Kivexa™ (3TC/abakaviiri kombinatsioon)
. Truvada™ (tenofoviiri/emtritsitabiini kombinatsioon)
Järgmine ravimite klass blokeerib sama elutsükli etapi, kuid erineval viisil. Seda klassi nimetatakse mittenukleosiidseteks pöördtranskriptaasi inhibiitoriteks ehk NNRTI-deks.
Kolm sellist ravimit on registreeritud:
. Nevirapiin (NVP, Viramune®)
. Delavirdiin (DVL, Rescriptor®)
. Efavirens (EFV, Stokrin®)
Kolmas viirusevastaste ravimite klass blokeerib 10. etapi, mil uute HIV-rakkude loomiseks vajalikud materjalid jaotatakse teatud osadeks.
Kasutatakse kümmet proteaasi inhibiitorit:
. Sakvinaviir (SQV, Invirase®)
. Indinaviir (IDV, Crixivan®)
. Ritonaviir (RTV, Norvir®)
. Nelfinaviir (NFV, Viracept®)
. Amprenaviir (APV, Ageneraz®)
. Lopinaviir (LPV/r, Kaletra®)
. Atasanaviir (ATZ, Reyataz®)
. Fosamprenaviir (908, Telzir®)
. Tipranaviir (PNU140690, Aptivus®)
. Darunaviir (TMC114, Prezista®)
Uusim ARV-ravimite klass sisaldab fusiooni inhibiitoreid. Nad takistavad HIV-i kinnitumist rakule, blokeerides tsükli 2. etapi. Seni on registreeritud ainult üks fusiooni inhibiitor:
. Enfuvirtiid (T-20, Fuzeon®)
KUIDAS ARVOTEID KASUTATAKSE?
Kui HIV paljuneb, on enamik selle uutest koopiatest mutatsioonid: need erinevad pisut algsest viirusest. Mõned jätkavad muteerumist isegi ARV-ravimite võtmise ajal. Kui see juhtub, lakkab ravim toimimast. Seda nimetatakse "resistentsuseks" ravimi suhtes.
Kui kasutada ainult ühte ARV-ravimit, on viirusel kergem. Kui kasutatakse kahte ravimit, peab mutatsioon toime tulema mõlema ravimiga korraga. Aga
kui kasutatakse kolme ravimit, eriti kui need ründavad HI-viirust selle elutsükli erinevatel etappidel, on mutatsiooni tõenäosus, mis suudab samaaegselt vastu panna kõigile neile ravimitele, väga väike.
Kolmekordse kombineeritud ravi kasutamine tähendab, et resistentsuse kujunemine võtab palju kauem aega. Seetõttu ei ole ühe ARV-ravimi (monoteraapia) kasutamine soovitatav.
KAS NENDEGA ARVIKUTEGA VÕIB RAVIDA AIDSI?
Vereanalüüs, mida nimetatakse "viiruskoormuseks", mõõdab HIV-viiruse kogust veres. Madalama viiruskoormusega inimesed püsivad kauem terved. Lisateavet viiruskoormustestide kohta leiate infolehest 125.
Mõnel inimesel on viiruskoormus nii väike, et seda ei saa selle testiga määrata. Kuid see ei tähenda, et viirust poleks olemas. Varem uskusid teadlased, et ARV-ravi tapab lõpuks kogu HIV-i inimkehas. Nüüd teame, et see pole nii. Ravimid ei "ravi" AIDS-i. Kuid need võimaldavad HIV-nakkusega inimestel kauem elada.
MILLAL RAVI ALUSTADA?
Sellele küsimusele pole kindlat vastust. Enamik arste võtab arvesse kolme tegurit: 1) teie viiruskoormustest; 2) Teie CD4 rakkude arv; ja 3) kõik sümptomid, mis teil on.
ART alustatakse tavaliselt siis, kui teie viiruskoormus on üle 100 000, kui teie CD4 arv on alla 350 ja kui teil on HIV-i sümptomeid.
Ravijuhiste kohta lisateabe saamiseks vaadake brošüüri 404.
Ravi alustamise otsus on väga oluline ja see tuleb arstiga kokku leppida.
MILLISEID ARVI KASUTADA?
Igal ARV-ravimil on oma kõrvaltoimed. Mõned neist on väga tõsised. Iga ravimi kohta lisateabe saamiseks vaadake eraldi infolehte. Mõned ravimite kombinatsioonid on vastuvõetavamad ja töötavad paremini kui teised. Iga inimene on ainulaadne, seega otsustate ravimite kohta ainult teie ja teie arst.
Nüüd kasutatakse "viiruskoormuse" testi, et kontrollida, kas ARV-ravim töötab. Kui viiruskoormus ei vähene või väheneb, kuid siis uuesti suureneb, on tõenäoliselt aeg ARV-ravimit või kombinatsiooni vahetada.
Seda ei saa välja kirjutada ilma selle rakendamise kõiki aspekte arsti ja patsiendi vahel kooskõlastamata. Enne ravi määramist peab patsient läbima mitmeid uuringuid: kliinilisi, laboratoorseid ja katseid. Saadud andmete põhjal teeb arst järelduse, valib järgnevaks raviks optimaalse skeemi.
Hoolimata positiivsetest tulemustest on sellisel ravil mõned vastunäidustused, seega mängivad kõige olulisemat rolli võetud testide tulemused.
Näidustused retroviirusevastaseks raviks
Nagu juba mainitud, on ravi aluseks patsiendi eelnevalt läbi viidud uuring. Olulised on laboris saadud näidustused, CD4 + E rakkude arv vere perifeerias, aga ka organismi viiruskoormuse taseme arvestamine, st. Just neid kahte testi peetakse põhiliseks viiruse replikatsiooni, patsiendi immuunsüsteemi seisundi ja võimalike riskide hindamisel haiguse edasiseks progresseerumiseks ühel või teisel määral.
Kui varem oskasid arstid viiruskoormuse tõttu vaid haiguse lõpptulemust ennustada, siis tänapäeval on tegu tõhusa uuringuga, mis võimaldab koos eelmisel päeval saadud tulemustega anda adekvaatse hinnangu haiguse ravile. Ainult viiruskoormust oluliselt alandades on võimalik saavutada suremuse vähenemist ja parandada patsientide kliinilisi tulemusi.
ART on näidatud:
- HIV-nakkusega patsiendid ägedas staadiumis ja nr A-B, C
- patsientidel, kelle CD4 lümfotsüütide tase on alla 0,3x109
- patsientidel, kellel on suurenenud HIV RNA kontsentratsioon veres, üle 60 000 kopika ml.
Nende näitajate esmakordsel avastamisel ei saa ravi määrata, need loetakse vahepealseteks ja on vajalik korduskontroll, kuid mitte varem kui 1 kuu pärast. Kui haigus on läbinud 3 A või 2B staadiumi, siis on võimalik määrata mono- või diteraapia. Samuti on ravi näidustatud patsientidele, kelle veres on CD40,2x107 ml tase. Vastavalt 4. ja 5. etapi klassifikatsioonile ravi enam ei teostata. Mõõtke HIV RNA taset vereplasmas, rakkude arvu, eelistatavalt retroviirusevastase ravi eelõhtul või 1-2 kuud pärast seda. See võimaldab hinnata ravi efektiivsust, viiruskoormuse vähendamise kiirust. Selle aja jooksul väheneb patsientide koormus reeglina kiiresti, umbes 0,5-0,7 loq ehk peaaegu 5 korda. Lähemal 16. nädalale pärast seda ravi on koormustase tavaliselt madalam kui tuvastamise tase peaaegu 500 plasma RNA koopia võrra 1 ml vere kohta.
Iga patsiendi puhul on koormuse vähendamise kiirus erinev, palju sõltub:
- eelmise ravi kestus
- viiruskoormuse tase algstaadiumis,
- SW4GGG rakkude arv,
- patsiendi ja tema jaoks valitud raviskeemi ühilduvusaste,
- teraapia aeg eelmisel päeval.
Viiruskoormuse indikaatoreid, kasutades kõiki ülaltoodud meetodeid, tuleks perioodiliselt uuesti kontrollida, kuid mitte sagedamini kui iga 4 kuu järel. Poole aasta jooksul tuleks mõõta patsiendil koormust 2 korda ja kui plasma RNA tase 1 ml kohta ei ole langenud alla 500 koopia, tuleks muuta viirusevastast ravi.
Sõltumata mööduva haiguse sümptomitest, nakkuskollete eliminatsiooni määrast ravi lõppfaasis, immuunsuse seisundist, viiruskoormust ei tohiks mõõta esimese 4 nädala jooksul alates selle rakendamise algusest.
VIDEO
Retroviirusevastane ravi asümptomaatilise HIV-infektsiooniga patsientidel
Alles hiljuti on arstid jõudnud järeldusele, et retroviirusevastast ravi saab edukalt määrata kõigile ning CD4 + T-rakkude arv ja koormus võib olla erinev. Kui aga patsient on HIV-nakkusega asümptomaatiline ja T-rakkude arv on alla 500 ühiku 1 ml vere kohta, siis võib pärast retroviirusevastaste ravimite kasutamist edukust vaid oletada, kuna seni pole vaatlused olnud pikaajalised. lihtsalt pole piisavalt andmeid viiruskoormuse käitumise kohta. Tänapäeval on hakatud kombineerima retroviirusevastaseid aineid, mis võimaldab viirustega tõhusamalt võidelda. Kuid sellel meetodil on palju kõrvaltoimeid, koostoimega patsientidel on võimalikud tüsistused, teiste ravimite lisamine põhirühma. Just asümptomaatilise kroonilise vormiga FICH-nakkuse ravi tuleks määrata ainult manustatavate komponentide võrdlemisel ja kõiki tegureid, võimalikke riske ja kasulikkust arvesse võttes.


Retroviirusvastase ravi käitumisele tuleb suhtuda äärmise ettevaatusega. Kas tasub üksikasjalikult selgitada, mis HIV-nakkus tegelikult on. See on tõsine haigus, mille puhul võib vähimgi ravimite väärkasutamine põhjustada verepildi järsu muutuse ja veelgi hullemaks. Selle teraapia läbiviimise otsustamisel on oluline säilitada patsiendi immuunfunktsioonid, parandada ja pikendada tema eluiga maksimaalselt, pärssida võimalikult tõhusalt viiruse replikatsiooni veres, minimeerida võimalikke riske, olukorra tüsistusi pärast uute ravimite kasutuselevõttu. ravimid, vähendavad nende toksilist mõju organismile, nende ja teiste ravimite negatiivset koostoimet. Retroviirusevastast ravi saavatele patsientidele ei ole võimalik spontaanselt, varajases staadiumis ravi määrata ilma leukotsüütide käitumist veres jälgimata, kuna kasutusele võetud uute ravimite toime võib olla ettearvamatu. Mõju hakkavad avaldama ravimid ja resistentsus ning terapeutilise ravi valik tulevikus on oluliselt piiratud.
Kui HIV-nakkus patsiendil on asümptomaatiline, võib seda ravi määrata:
- agressiivne, st tõhustatud ravi haiguse arengu algstaadiumis ja see on tõhus, kuna HIV-nakkus areneb algstaadiumis kiiresti;
- Ettevaatlikult, kui retroviirusevastast ravi alustatakse hilisemal kuupäeval, võetakse selle rakendamisega kaasnevaid eeliseid ja kõiki võimalikke riske juba arvesse.
Esimesel raviviisil algab ravi varajases staadiumis, kui immuunsupressioon ei ole veel avaldunud, viiruskoormuse taset ei määrata. Ainult patsiendid, kelle bDN koopiate arv on üle 10 000, RT-PCR koopia on üle 20 000 1 ml vereplasma kohta, kellel on ka minimaalne CO4 + T-rakkude arv, st vähem kui 500 ühikut, või CD4 rakk vähem kui 500 ühikut. näidustatud ja soovitatav on retroviirusevastane ravi. Varajase ravi läbiviimine säilitab immuunkompetentsed rakud, arendab vastuse immuunsust õigel tasemel. Kui infektsioon on esmane, siis on see ravi patsientidele soovitatav ja kõik peaksid sellest teadma.
Teraapia on vastunäidustatud, patsientide jälgimine ja CD-rakkude käitumise jälgimine veres jätkub, kui koormustase on madal, CD4 + T-rakkude arv ei ole jõudnud 500 piirini 1 ml vere kohta.
Tänapäeval pakuvad arstid sellist ravi uutes variatsioonides, hõlmates ravimeid: kombiviir, zidovudiin, lamivudiin, efavirens, 3TS, d4T.
Antiretroviirusravi ja vaheajad
Iga HIV-patsiendi organism on individuaalne, mõned ravimikomponendid, eriti 2-3 koostoimel, võivad muutuda lihtsalt talumatuks või mõnest ravimist puududa, mistõttu võib arst katkestada retroviirusevastase ravi, kõrvaltoimed on sagedased ja on sellistele patsientidele äärmiselt ohtlikud. Raske on öelda, kuidas paus mõjutab patsiendi heaolu, kuid oluline on edaspidi negatiivseid tagajärgi ennetada. Samuti on raske hinnata ühe või mitme ravimi ärajätmist, see mõjutab vere koostist. Loomulikult saab keha reaktsiooni jälgida, kui katkestate ravi mitmel põhjusel mitmeks päevaks. Kui teil on vaja see pikemaks ajaks katkestada, on targem kõik ravimid korraga ära jätta, ühe või kahe ravimiga ravi jätkamine tõenäoliselt positiivseid tulemusi ei anna. Samuti ei too ravimite täielik kaotamine kaasa viirustüvede resistentsust, nende ühes või teises suunas muutumise riskid vähenevad praktiliselt nullini.
Sellist ravi on soovitatav läbi viia perioodiliselt, kuid siiski on vaja teha CD4 viiruskoormuse kontrollmõõtmisi kord kuus, eelistatavalt 2 nädalat pärast retroviirusevastase ravi katkestamist.
Retroviirusvastase ravi kõrvaltoimed
Pärast ravi on kahte tüüpi kõrvaltoimeid:
- klassispetsiifiline, sõltuvalt ravimite klassist endast,
- olenevalt sama klassi konkreetsetest ravimitest.
Klassispetsiifiliste kõrvaltoimete ilmnemisel võivad patsiendil tekkida:
- lipodüstroofia,
- hüperlaktaemia,
- lipodüstroofia,
- hüperlipideemia,
- seedetrakti häired,
- kudede tundlikkuse kaotus perifeerias süstitud insuliini suhtes.
Südame-veresoonkonna haigused võivad areneda lipiidide metabolismi rikkudes, ainevahetus võib olla häiritud pärast üksiku ravimi manustamist, ka pärast selle pikaajalist kasutamist.
Kõrvaltoimed on retroviirusevastase ravi ajal võimalikud ja sagedased, kuid oluline on neid vähendada, mis tähendab:
- vali ravimid ja kombineeri need minimaalsete kõrvalmõjudega;
- jälgige pidevalt patsiendi seisundit pärast teatud ravimite annuste kasutuselevõttu;
- võimalusel katkestage ravi, kuna see leiti isegi tõhusalt;
- alustada ravi hiljem;
- määrata vaheldumisi erinevaid ravimite manustamise skeeme;
- võtta kasutusele uusi, kuid mittetoksilisi ravimeid või nende ravimvorme.


Kasutatud ravimite integreerimine
- Ravi järgimine on ebatõenäoline. Sellest lähtuvalt tasub edaspidi kaaluda raviskeemi muutmist ning sellest ka patsienti teavitada.
- Oluline on kuulata patsiendi arvamust ja heaolutunnet, eelkõige peab meditsiinipersonal olema pidevalt patsientide läheduses, määrama iga patsiendi asukohta individuaalselt. Arst peab olema teadlik ka kõigist patsiendi soovidest, taotlustest, eesmärkidest, tema arusaamast haigusest, tema suhtes rakendatavatest ravimeetoditest.
- Arsti ja patsiendi vahelise partnerluse arendamine on eduka ja järjepideva ravi võti. Arst peab patsiendile selgelt ja arusaadavalt, infot moonutamata, liialdamata selgitama kogu planeeritud ravitoimingute kulgu. Seega on teraapia määramise otsus adekvaatsem.
- Kogu ravi tuleks läbi mõelda patsiendi positsioonist ja olla mitte temale orienteeritud, sest peamine on rahuldada kõik patsiendi soovid ja vajadused, kuulata tema tundeid, kogemusi, soove. Kõik see peaks olema lähtepunkt enne retroviirusevastase ravi alustamist. Kui on ebakõla, küsimusi, siis on vaja need koos ära sätestada ja lahendada.
- Oluline on muuta ravi individuaalne, arutades patsiendiga läbi kõik punktid, ravi etapid, teatud vahendite kasutamine, võimalik talumatus mõne ettenähtud ravimite komponendi suhtes. Ühtsed lahendused ei ole vastuvõetavad.
- Sama oluline on ühise keele leidmine patsiendi lähedastega, pere ja lähedased on need, kes saavad raviprotsessis tõeliseks toeks mitte ainult patsiendile, vaid ka arstile. Sellise vaevusega patsiendid ei pea ühiskonnas häbenema ja teiste abist keelduma.
- Teraapia peaks olema ligipääsetav, arusaadav ja pikaajaline, milles patsient peab lihtsalt kindel olema.
- Ärge keelduge teiste meditsiiniasutuste spetsialistide abist. Professionaalne abi pole kunagi üleliigne, kaasata tuleks isegi teisi spetsialiste. Ainult üheskoos saame sellisest salakavalast haigusest jagu.
- Sõbralikud suhted tuleks säilitada kõikidel ravietappidel.
- Sa ei pea kunagi alla andma. Need sõnad peaksid üleskutsena olema igaühe alateadvuses, kes ühel või teisel moel AIDS-i haigetega kokku puutub. Selle haigusega on elu ja surma teema terav, eriti kui elu sõltub otseselt ainult patsiendist ja arstist. Ainult tihe koostöö viib eduni. Mida peaksid mõistma nii arstid kui haiged inimesed.
Mängib suurt rolli. Seda määrab ainult kvalifitseeritud arst, võttes aluseks analüüsid, muud kliinilised ja laboratoorsed uuringud, samuti patsiendi üldine seisund. Loomulikult on selle abiga haigust võimatu täielikult ravida. Kuid patsiendi seisundi leevendamiseks ja tema eluea oluliseks pikendamiseks - täielikult. HIV-nakkuse korral kasutatakse kõige sagedamini retroviirusevastast ravi. See tähendab mõju mitmele probleemile korraga, mida immuunpuudulikkuse viirus kannab. Millal sellist ravi kasutatakse ja millistest tüüpidest see koosneb?
HIV-nakkus, ART-ravi: üldteave
AIDS-i ravi on välja töötatud mitu aastakümmet. Praeguseks on kõige tõhusamaks tunnistatud kõrge retroviirusevastane toime. Enne selle efektiivsuse ja suuna kirjeldamist tuleb välja selgitada, millal sellist ravi alustatakse ja kellele seda vaja on. On teada, et HIV-nakkuse retroviirusevastast ravi ei rakendata kohe pärast diagnoosimist. Näib, et nakatunud inimest tuleks kohe ravida. Aga ei ole. Sellise diagnoosi korral on väga oluline mitte kahjustada keha tugevate ravimitega. Väärib märkimist, et ligikaudu kolmkümmend protsenti kõigist nakatunutest on viirusekandjad. Neil puudub haiguse äge staadium ja inkubatsiooniperiood muutub kohe latentseks, mis kestab aastakümneid. Sellistel inimestel diagnoositakse kohutav haigus reeglina juhuslikult, näiteks plaaniliseks operatsiooniks, tervisekontrolliks jne valmistudes.
HIV-ravi võtmist peetakse sel juhul sobimatuks. Kuna keha ei reageeri nakkustekitaja esinemisele selles. Tugevate ravimite kasutamine võib põhjustada immuunsüsteemi nõrgenemist. Mõnel juhul võib see tagasilöök anda. Siis muutub viirusekandjast inimene nakatunud inimeseks koos kõigi kaasnevate sümptomitega. AIDS-i ravi ei kasutata isegi asümptomaatilises staadiumis. Samuti räägime patsientidest, kellel äge staadium ilmub "kogu oma hiilguses". Nende puhul sõltub ravi otseselt sellest, kuidas nakatunud organism käitub.
Kogu varjatud staadiumis külastavad sellised patsiendid regulaarselt arsti ja võtavad teste. Otsuse selle kohta, kas HIV-i retroviirusevastane ravi on igal üksikjuhul vajalik, teeb spetsialist teatud uuringute põhjal. Mida sellise otsuse tegemisel arvesse võetakse? viiruskoormus. Nakatunud patsiendi analüüside regulaarsel proovide võtmisel määratakse viiruskoormus vere milliliitri kohta. Kuigi see on normi piires, jätkub asümptomaatiline staadium. Tugeva immuunsusega organism suudab toota õiges koguses antikehi, mis viirusele vastu peavad. Sel juhul ei ole HIV-nakkuse ravi vajalik.
Lisaks viiruskoormusele võetakse arvesse ka immuunseisundit. Me räägime CD-4 rakkude kvantitatiivsest koostisest. See määratakse ka vereproovide võtmisega. On juhtumeid, kus immuunseisund ja viiruskoormus on normaalsed, kuid patsiendil hakkavad järk-järgult ilmnema sekundaarsete ilmingute tunnused. See hõlmab nii kaasuvaid haigusi kui ka oportunistlikke infektsioone. Nendel juhtudel on vajalik HIV-i viirusevastane ja retroviirusevastane ravi. Ja mida varem ravi algab, seda parem on prognoos. Oluline on arvestada, et teatud ravimite määramise otsustamisel võtab arst tingimata arvesse immuunseisundi ja viiruskoormuse dünaamikat. Spetsialist peab analüüsima, kuidas patsiendi seisund mitme kuu jooksul muutub.
Immuunsüsteemi seisundi jälgimise põhjal otsustatakse, milline HIV-nakatunud inimeste ravi on haiguse praeguses staadiumis vajalik. Ravi peaks määrama ainult arst. Lõppude lõpuks valitakse see iga patsiendi jaoks sõltuvalt keha omadustest ja testide tulemustest.
HIV - ravirežiimid: viirusevastane, immuunne ja kliiniline orientatsioon
 Tuleb märkida, et HIV-i puhul kasutataval HAART-teraapial on korraga mitu eesmärki. Sellel on viroloogiline, immuunsüsteemi üldist tugevdav ja kliiniline fookus. Igaüht neist tuleks üksikasjalikumalt käsitleda. HIV-i retroviirusevastaseid ravimeid võetakse kombinatsioonis. Arst määrab patsiendile korraga mitu ravimit. Tavaliselt räägime kolmest või neljast ravimist. HIV ja AIDSi viroloogilised ained on ette nähtud teraapiana, mille eesmärk ei ole ainult immuunpuudulikkuse viiruse enda allasurumine.
Tuleb märkida, et HIV-i puhul kasutataval HAART-teraapial on korraga mitu eesmärki. Sellel on viroloogiline, immuunsüsteemi üldist tugevdav ja kliiniline fookus. Igaüht neist tuleks üksikasjalikumalt käsitleda. HIV-i retroviirusevastaseid ravimeid võetakse kombinatsioonis. Arst määrab patsiendile korraga mitu ravimit. Tavaliselt räägime kolmest või neljast ravimist. HIV ja AIDSi viroloogilised ained on ette nähtud teraapiana, mille eesmärk ei ole ainult immuunpuudulikkuse viiruse enda allasurumine.
Viirusevastaseid ravimeid on reeglina vaja ka selleks, et vähendada kaasuvate haiguste mõju organismile, kui need on juba avaldunud. Kui arst otsustab selliseid ravimeid kasutada isegi asümptomaatilises staadiumis, vajab patsient võimsat ravikuuri, mis pärsivad nakatunud rakke. Kõige sagedamini tekib selline vajadus siis, kui viiruskoormus ületab oluliselt normi. Sel juhul ei saa ilma ravita hakkama, mis tähendab sellist AIDS-i ravi.
Niisiis on nakatunud inimese kehale avalduva viirusevastase toime peamine ülesanne vähendada nakatunud rakkude tootmist ja vähendada nende levikut. Sellise HIV-i viirusevastase ravi kulg kestab reeglina kuusteist kuni kakskümmend neli nädalat. Sellisel juhul võib supressiooni mõju täheldada juba kuuendal nädalal.
Immuunsüsteemi taastamiseks on vajalik HIV-i immunoloogiline initsiatiivravi. Ta kannatab suuresti viiruskoormuse suurenemise tõttu. Immuunsuse seisund samal ajal ei vasta normile. Immuunsüsteemi taastavate ravimite võtmine võimaldab suurendada CD-4 rakkude arvu normaalseks.
HIV-i kliiniline ART-teraapia hõlmab ravimeid, mis võivad nakatunud patsientide eluiga pikendada mitte aasta või kahe, vaid aastakümnete võrra. Mõnikord väheneb risk haigestuda AIDS-i, mis, nagu teate, lõpeb kiiresti surmaga. Selle HIV-ravi abil võimaldab HAART nakatunud partneritel suhteliselt ohutult last eostada. Samuti väheneb viiruse edasikandumise oht vere või seksuaalse kontakti kaudu.
HIV-ravi algus ja kõrvaltoimed on omavahel tihedalt seotud

Spetsialist on see, kes otsustab, millal alustada HIV-ravi, seetõttu peate kohe pärast diagnoosimist minema spetsialiseeritud haiglasse. Ravi efektiivsus sõltub aga paljuski inimese elustiilist ja arstiretseptide järgimisest ning loomulikult sellest, millist teraapiat HIV-i vastu määratakse. Siin on mõned kasulikud näpunäited, mis aitavad nakatunud inimestel alustada arsti määratud ravi.

Tuleb veel kord meeles pidada, et HIV-nakkuse HAART-i järgimine on eduka ravi üks olulisi komponente.
HIV-ravi kõrvaltoimed ja tagajärjed
HAART on ülitõhus ravi, mille abil immuunpuudulikkuse viiruse varjatud periood võib kesta aastakümneid ning AIDS ei arene üldse. Kuid selline lähenemine nakatunud organismi säilitamisele ja taastamisele ei ole kahjuks ideaalne. Kõik ravimid, mille kasutamisele ta vihjab, on mürgised. Loomulikult mõjutab see inimkeha siseorganeid ja elutähtsaid süsteeme. Seetõttu peab patsient enne AIDSi ennetava retroviirusevastase ravi määramist läbima palju uuringuid ja läbima vajalikud testid. See on vajalik selleks, et raviarst saaks valida kõige sobivama skeemi. Regulaarsed visiidid eriarsti juurde ja selge kliiniline pilt aitavad patsiendil edukalt tasakaalustada piiri viiruse mahasurumise ja ravimite tekitatava kahju vahel.
HIV-ravi määramisel hoiatavad arstid patsienti alati võimalike kõrvaltoimete eest. See on äärmiselt oluline, kasvõi selleks, et patsient saaks eristada ohtlike sümptomitega ravimite võtmise tagajärgi, mis võivad tekkida, kui ravi efektiivsus väheneb. Siinkohal on oluline märkida, et HIV-nakkusega patsientide retroviirusevastane ravi on ravi, mida enamik patsiente hästi talub. Kuigi seda võrreldakse sageli keemiaraviga, on selle kasutamise kõrvaltoimed palju harvemad ja palju lihtsamad.
Iiveldus ja oksendamine on kõige sagedasemad HAART-i reaktsiooni tunnused. Nad võivad patsienti pidevalt kummitada või ilmuda ainult aeg-ajalt. Reeglina ilmnevad esimestel ravinädalatel iiveldus ja oksendamine. Arst peab patsienti sellest hoiatama, kui on vaja alustada HIV-ravi.
Teine levinud kõrvaltoime on kõhulahtisus. See on tingitud asjaolust, et immuunpuudulikkuse viiruse raviks kasutatavad ravimid häirivad soolestiku floorat. Seetõttu tuleks HIV-ravis prebiootikumide võtmisega kõrvaldada mõju sooltele. Seedetrakti poolt selliste ravimite kasutamise ajal võib esineda ka anoreksiat, valu epigastimaalses piirkonnas. Kui patsiendil oli diagnoosimata haavand, võib selline ravi põhjustada maoverejooksu.
HIV-ravi kõrvaltoimeid võib täheldada ka kesknärvisüsteemis. See on üsna haruldane nähtus, mida esineb vaid viiel protsendil nakatunutest.
HAART-i jaoks on mitmeid vastunäidustusi. Seega ei tohiks näiteks alkoholi võtta vähemalt paar päeva enne selle algust. Seda ei kasutata ägeda neerupuudulikkuse või maoverejooksu korral. HIV-i ART-ravi tohib alustada ainult palavikuga, kui see on mõne kaasuva haiguse tagajärg. Kui see sümptom ilmnes haiguse tõttu, mis ei ole seotud immuunpuudulikkuse viirusega, tuleb see enne ravi alustamist kõrvaldada.
HIV 2016 geeniteraapia: tõhus või mitte?
Immuunpuudulikkuse viiruse geeniteraapia on välja töötatud suhteliselt hiljuti. 2016. aastal võtsid selle kasutusele mõned meie riigi kliinikud. Selline HIV-ravi on Venemaal kallis, samas kui mõned immuunpuudulikkuse viiruse ravis kvalifitseeritud spetsialistid ei usalda selle tõhusust. Võib-olla on põhjus selles, et uut meetodit pole liiga palju uuritud. Kas geeniteraapia aitab HIV-i puhul, on küsimus, millele on siiani raske vastata.
See põhineb ensüümide kasutamisel, mis eemaldavad nakatunud koe kehast. Mõned teadlased usuvad, et selline ravimeetod võib põhjustada pöördumatuid tagajärgi. Organismi sekkumine geenitasandil on ju alati ettearvamatu. Milline on parim HIV-nakkuse HAART-ravi, peaks otsustama kvalifitseeritud spetsialist.
HIV-nakkuse füsioteraapia ja muud alternatiivsed ravimeetodid

Füsiomeetodeid immuunpuudulikkuse viiruse raviks ei kasutata. Seda tüüpi teraapiat saab kasutada kesknärvisüsteemi kahjustusest põhjustatud haiguste sümptomite leevendamiseks.
HIV-nakkuse psühhoteraapia annab käegakatsutavaid tulemusi. Mõned patsiendid vajavad seda, sest sellise diagnoosiga on äärmiselt raske elada. Palju sõltub patsiendi psühholoogilisest seisundist, sealhulgas sellest, kuidas HAART tema keha mõjutab.
Mõned erakliinikud pakuvad tänapäeval sellist teenust nagu HIV-nakkuse osoonteraapia. Kvalifitseeritud spetsialistid peavad seda ebapiisavalt tõhusaks.