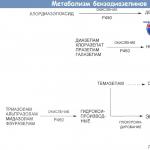
4. Kopsupõletik: laboratoorne ja instrumentaalne diagnostika.
Kopsupõletik- alumiste hingamisteede äge infektsioosne kahjustus, mis on kinnitatud röntgenuuringuga, domineerib haiguspildis ja ei ole seotud muude teadaolevate põhjustega.
Laboratoorsed diagnostikad:
Täielik vereanalüüs: leukotsütoos, leukotsüütide valemi nihkumine vasakule, kiirendatud ESR.
Biokeemiline vereanalüüs: alfa-2- ja gammaglobuliinide, seromukoidi, siaalhapete, fibrinogeeni, C-reaktiivse valgu koguse tõus.
Rögaanalüüs - suur hulk leukotsüüte, alveolaarne epiteel, võib esineda vähe punaliblesid.
Röga (või bronhide pesemise) bakterioloogiline uuring enne antibiootikumide määramist aitab tuvastada patogeeni ja määrata selle tundlikkust antibiootikumide suhtes;
Bakterioskoopia (Gram-värvitud röga määrde mikroskoopia) - gramnegatiivsete või grampositiivsete mikroorganismide tuvastamine (oluline on arvestada antibiootikumide valimisel haiglaravi ajal);
Viirusliku ja viirus-bakteriaalse kopsupõletiku diagnoosimisel on olulised viroloogilised ja seroloogilised uuringud.
Instrumentaalne diagnostika:
Röntgenuuringud, kopsude CT-uuring – kopsukoe infiltratsioon, pleura reaktsioon.
Vajadusel tehakse tuberkuloosi ja kopsuvähiga kopsupõletiku diferentsiaaldiagnostika bronhoskoopiaga, samuti pleuroskoopiaga;
Ultraheli - pleuraõõne efusiooni diagnoosimine;
Välise hingamise funktsiooni näitajad - bronhide läbilaskvuse seisundi hindamine.
Eksamipilet number 6
Hüpertensiivsed kriisid: kliinik, diagnoos, kiirabi
Cor pulmonale: etioloogia, patogenees, kliinik, diagnoos, ravi.
Vastuste näidised:
Hüpertensiivsed kriisid: kliinik, diagnostika, kiirabi.
Hüpertensiivne kriis on äge, väljendunud vererõhu (BP) tõus, millega kaasnevad kliinilised sümptomid ja mis nõuab kohest kontrollitud langust, et vältida või piirata sihtorganite kahjustusi.
Enamasti areneb hüpertensiivne kriis, kui süstoolne vererõhk on >180 mm Hg. Art. ja/või diastoolne vererõhk >120 mm Hg. Art. Siiski on võimalik välja töötada kriis ja vähem väljendunud vererõhu tõus.
Äge märkimisväärne vererõhu tõus, millega kaasnevad rasked kliinilised ilmingud ajus (entsefalopaatia), südames (stenokardia, arütmiad, vasaku vatsakese puudulikkus) ja neerudes (proteinuuria, hematuuria, asoteemia).
Kliinik.
Hüpertensiivsed kriisid jagunevad kahte suurde rühma – keerulised (eluohtlikud) ja tüsistusteta (eluohtlikud).
Komplitseeritud hüpertensiivse kriisiga kaasnevad eluohtlikud tüsistused, sihtorgani kahjustuse ilmnemine või süvenemine ning see eeldab vererõhu langust, alates esimestest minutitest, mitme minuti või tunni jooksul parenteraalselt manustatavate ravimite abil.
Hüpertensiivset kriisi peetakse keeruliseks järgmistel juhtudel:
Äge hüpertensiivne entsefalopaatia;
Insult;
äge koronaarsündroom;
Äge vasaku vatsakese puudulikkus;
Aordi aneurüsmi lahkamine;
Kriis feokromotsütoomiga;
Preeklampsia raseduse ajal;
Raske arteriaalne hüpertensioon, mis on seotud subarahnoidse hemorraagia või ajukahjustusega;
Arteriaalne hüpertensioon operatsioonijärgsetel patsientidel ja verejooksu oht;
Kriis amfetamiini, kokaiini jms tarvitamise taustal.
2. Tüsistusteta hüpertensiivse kriisiga, hoolimata tõsistest kliinilistest sümptomitest, ei kaasne sihtorganite akuutset kliiniliselt olulist düsfunktsiooni.
Ravi.
Kõik hüpertensiivse kriisiga patsiendid vajavad kiiret vererõhu langust, kuid selle languse kiiruse määrab konkreetne kliiniline olukord.
Komplitseeritud hüpertensiivne kriis- Haiglaravi on vajalik niipea kui võimalik. Vererõhku ei tohi esimese 1-2 tunni jooksul alandada rohkem kui 25% Kõige kiirem vererõhu langus on vajalik aordi aneurüsmi ja raske ägeda vasaku vatsakese puudulikkuse (kopsuturse) lahkamiseks – 25% algsest 5-10 minutit, optimaalne aeg süstoolse vererõhu sihttaseme saavutamiseks 100-110 mm Hg. Art. ei ole pikem kui 20 minutit.
Insuldi, hüpertensiivse entsefalopaatiaga patsiendid vajavad erilist lähenemist, kuna vererõhu liigne ja / või kiire langus põhjustab ajuisheemia suurenemist. Insuldi ägedal perioodil otsustatakse vererõhu alandamise vajaduse ja selle optimaalse väärtuse küsimus koos neuroloogiga iga patsiendi jaoks individuaalselt.
Teraapia jaoks keeruline hüpertensiivne kriis rakendada:
1) Vasodilataatorid:
Enalaprilaat: IV boolus 5 minuti jooksul annuses 0,625–1,25 mg. Toime algab 15 minuti pärast, maksimaalne toime on 30 minuti pärast, toime kestus on 6 tundi. Enalaprilaadi kasutuselevõtt on eelistatav ACS-i (kombinatsioonis nitraatidega), kopsuturse, tserebrovaskulaarse avarii korral (mõju aju verevoolule on minimaalne);
Nitroglütseriin: 10 mg 100 ml 0,9% naatriumkloriidi lahuse kohta (või perlinganiit 10 mg, isoket 10 mg 150-200 ml 0,9% naatriumkloriidi lahuse kohta) intravenoosselt. Eelistatud ACS ja ägeda vasaku vatsakese puudulikkuse korral;
Naatriumnitroprussiid: lahus valmistatakse ex tempore, manustamiskiirus on 1-4 mg / kg / min, sõltuvalt säilinud vererõhu tasemest. See on hüpertensiivse entsefalopaatia valikravim, kuid tuleb meeles pidada, et see võib suurendada koljusisest rõhku.
Kriisi taustal arenenud ACS-is on võimalik kasutada metoprolooli: iv 5 mg (5 ml) ravimit, võite manustamist korrata 2-minutilise intervalliga, maksimaalne annus on 15 mg (15 ml). .
Esmolool on ülilühiajalise toimega selektiivne β 1 -adrenergiline blokaator: algannus on 250-500 mcg / kg boolusena 1-3 minuti jooksul, võimalik on korduv boolusmanustamine. On võimalik sisestada infusioonina 50-100 mcg / kg / min kuni efekti saavutamiseni. Toiming algab 60 sekundi pärast. Tegevuse kestus - 20 minutit. Valikravim ACS-i, tahhüarütmiate, aju tüsistuste, dissekteeriva aordi aneurüsmi korral.
Antiadrenergilised ained:
Urapidiil (Ebrantil) - keskne α1-blokaator,
millel on nõrk β-blokeeriv toime: manustatakse intravenoosselt joana või pikaajalise infusioonina. Intravenoosne boolus: 10-50 mg ravimit süstitakse aeglaselt vererõhu kontrolli all, mis eeldatavasti väheneb 5 minuti jooksul pärast manustamist. Sõltuvalt toimest on võimalik ravimi korduv manustamine.
Intravenoosne tilk- või pidevinfusioon viiakse läbi perfusioonipumba abil. Säilitusannus: keskmiselt 9 mg/h, s.o. 250 mg ravimit (10 ampulli 5 ml või 5 ampulli 10 ml) 500 ml infusioonilahuses (1 mg = 44 tilka ~ 2,2 ml). Soovitatav maksimaalne käivituskiirus: 2 mg/min. Tilguti manustamise kiirus sõltub patsiendi vererõhust.
Proksodolool (Albetor) - β 1-2, α 1 -blokaator: manustatakse intravenoosselt joa või infusioonina.
In / in jet - 10-20 mg (1-2 ml 1% lahust (10 mg / ml) 1 minuti jooksul. Vajadusel korrake sisseviimist 5-minutilise intervalliga, kuni toime ilmneb. Maksimaalne annus on 50-100 mg (5-10 ml 1% lahust (10 mg/ml).
IV tilgutamine - 50 mg (5 ml 1% lahust (10 mg / ml) 200 ml 0,9% naatriumkloriidi lahuses või 5% glükoosilahuses, kiirusega 0,5 mg / min (2 ml infusioonilahust), kuni saab positiivse vastuse.
4). Diureetikumid:
Furosemiid: 40-80 mg IV. Seda kasutatakse ägeda vasaku vatsakese puudulikkuse ravimeetmete kompleksi osana.
5). Muud ravimid:
Antipsühhootikumid (droperidool): 0,25% lahus 1-2 ml IV aeglaselt 20 ml 5% glükoosilahuses;
Ganglioblokaatorid (pentamiin): 5% lahus 0,3-1 ml IV aeglaselt 20 ml 5% glükoosilahuses.
B. Tüsistusteta hüpertensiivne kriis
Tüsistusteta hüpertensiivse kriisi ravi on võimalik ambulatoorselt, kasutades nii intravenoosseid kui ka suukaudseid või sublingvaalseid antihüpertensiivseid ravimeid (olenevalt vererõhu tõusu raskusastmest ja kliinilistest sümptomitest). Ravi tuleb alustada kohe, vererõhu languse kiirus ei tohi esimese 2 tunni jooksul ületada 25%, millele järgneb soovitud vererõhu saavutamine mõne tunni jooksul (mitte rohkem kui 24-48 tunni jooksul) alates ravi algusest.
1) Kaptopriil: 12,5-25 mg keele alla või suu kaudu. Taaspääs on võimalik 90-120 minuti pärast.
2) β-blokaatorid: propranolool 5-20 mg sublingvaalselt või metoprolool 25-50 mg sublingvaalselt. Valikravimid noortele patsientidele, hüpersümpatikotooniaga patsientidele, alkoholitarbimisega seotud kriisi korral, kaasuva koronaararterite haigusega patsientidele.
3) Klonidiin: 0,01% - 0,5 (1,0) ml 10-20 ml 0,9% naatriumkloriidi lahuses, süstitakse intravenoosselt 5-7 minuti jooksul või - 0,75 (1,5) ml i/m; sees 0,1–0,2 mg, millele järgneb 0,05–0,1 mg iga 4 tunni järel. Maksimaalne koguannus on 0,7 mg.
Anafülaktiline šokk: kliinik, kiirabi.
Anafülaktiline šokk - ägedalt arenev eluohtlik protsess, mis ilmneb anafülaksia väljendunud ilminguna ja mida iseloomustavad tõsised häired kesknärvisüsteemi aktiivsuses, vereringes, hingamises ja ainevahetuses.
Kliinik
Šokk väljendub hirmutundes, ärevuses, pearingluses, tinnituses, kuumatundes, õhupuuduses, pigistustunne rinnus, iiveldus ja oksendamine. Võib-olla urtikaaria ilmnemine, pehmete kudede turse. Äge vaskulaarne puudulikkus väljendub kleepuva külma higi, nähtavate limaskestade ja naha terava kahvatuse, niitja pulsi ja järsu vererõhu langusena. Teadvus on depressioonis, hingamine on häiritud. Kliinilise pildi edasine halvenemine on iseloomulik aju hüpoksiast tingitud kooma tekkele.
Kiireloomuline abi:
1. Lõpetage allergeeni toomine.
2. Tagada hingamisteede läbilaskvus; kui hingetoru intubeerimine on võimatu - konikotoomia.
3. Andke jalgadele kõrgendatud asend.
4. 100% hapniku sissehingamine (mitte rohkem kui 30 minutit); pakkuda juurdepääsu veenile.
5. Süstige intravenoosselt epinefriini - 0,1% 0,3-0,5 ml 20 ml 0,9% naatriumkloriidi lahuses või 5% glükoosilahuses (vajadusel korrake).
6. Alustage vedeliku intravenoosset süstimist (polüglütsiin, reopoliglükiin, 0,9% naatriumkloriidi lahus, 5% glükoosilahus).
7. Kui turse levib kõri, süstige adrenaliini endotrahheaalselt 2-3 ml 20 ml 0,9% naatriumkloriidi lahuses.
8. Sisestage intravenoosselt glükokortikoidhormoone (prednisoloon 90-150 mg või hüdrokortisoonhemisuktsinaat 300-600 mg (tilguti või joa abil) - kui see ei ole efektiivne - korrake.
9. Süstige intramuskulaarselt 2 ml 1% dimedrooli lahust või 1-2 ml suprastini lahust.
10. Süstige aeglaselt intravenoosselt 10 ml 2,4% aminofülliini lahust.
11. Brohospasmiga - Salbutamol 2,5 mg või Berodual 1 ml sissehingamine läbi nebulisaatori.
12. Pärast seisundi stabiliseerumist - transportimine haiglasse.
Neerude amüloidoos: etiopatogenees, kliinik, diagnoos, ravi.
Amüloidoos on süsteemne haigus, mida iseloomustab erineva päritoluga spetsiifilise eosinofiilse valgu ekstratsellulaarne ladestumine. Üldiselt on neerude amüloidoosi esinemissagedus 75% kõigist amüloidoosi juhtudest. Veelgi enam, neerupuudulikkus on selliste patsientide surmapõhjuste hulgas esikohal, ei alistu isegi südamepuudulikkusele.
Küsimus, millistest haigustest amüloidoos areneb, pole täielikult välja selgitatud, kuigi tuberkuloosi nimetatakse endiselt peamiselt reumatoidartriidiks. Tuleb meeles pidada, et amüloidoosi võimalus krooniliste mädaste korral - osteomüeliit, bronhiektaasia, muud kroonilised kopsupõletikud, süüfilis, aga ka lümfogranulomatoos, neerude parenhüümi kasvajad, kopsud, UC, Crohni ja Whipple'i haigused, protraktsed septiline endokardiit ja teised, haruldasemad haigused (näiteks medullaarne kilpnäärmevähk Viimasel ajal pööratakse üha enam tähelepanu amüloidoosi tekkele vanemas eas (eriti üle 70-80-aastastel).
Valgu biokeemiliste omaduste uurimine 70-80ndatel võimaldas kindlaks teha, et see on päritolult heterogeenne ning on normaalsete ja patoloogiliste seerumivalkude derivaat ning koosneb nende polüpeptiidi fragmentidest. Sellised amüloidi prekursorid võivad olla: prealbumiin, immunoglobuliinide kerged ahelad, mõned endokriinsete näärmete hormoonid jne.
Patogenees.
Siiani ei ole selle patogeneesi kohta ühtset kontseptsiooni kõigi amüloidoosi vormide jaoks. Praegu arutatakse nelja peamist amüloidoosi patogeneesi teooriat.
Vastavalt lokaalse rakugeneesi teooriale saab amüloidi moodustumisel eristada kahte faasi: preamüloidi ja amüloidi. Amüloidieelses faasis täheldatakse plasmatsüütilist infiltratsiooni ja proliferatsiooni fagotsüütiliste makrofaagide süsteemis.
Düsproteinoosi (või organoproteinoosi) teoorias peetakse amüloidi väärastunud valkude metabolismi tooteks. Selle teooria seisukohast on amüloidoosi patogeneesi peamiseks lüliks düsproteineemia koos jämedate valgufraktsioonide ja ebanormaalsete valkude - paraproteiinide - kuhjumisega plasmas.
Mutatsiooniteooria kohaselt arenevad amüloidoosi erinevad variandid välja amüloidoblastide eriplaani mutatsioonilise moodustumise tulemusena.
Amüloidoosi immuunteooria; eriti olulist rolli mängivad immuunhäired amüloidi staadiumis - rakulise immuunsuse funktsiooni pärssimine, fagotsütoos.
Kliinik.
Sekundaarne amüloidoos on haigus, mis esineb peamiselt üle 40-aastastel inimestel. Neerukahjustuste protsent on suur. 60% patsientidest on massiline proteinuuria; nefrootiline sündroom tekib üsna varakult; pooltel patsientidest juba esimese 3 aasta jooksul. Võime rääkida protsessi teatud etapist:
Kui inimene kannatab pikka aega kroonilise köha all, suudab ta harva iseseisvalt ära tunda kopsupõletikku (kopsupõletikku), bronhiiti või muud alumiste hingamisteede ägedat põletikulist protsessi. Bronhiit ja kopsupõletik tekivad sageli pärast külmetushaigust. Mõlemad patoloogiad võivad olla nii viiruslikud kui ka bakteriaalsed.
Ägeda kopsupõletiku ja ägeda bronhiidi tunnused ja sümptomid on paljuski sarnased, mistõttu on võimatu enesekindlalt määrata kopsupõletikku kodus ilma spetsialistide osaluseta ja ilma diagnoosimise "kuldstandardeid" kasutamata.
Diferentsiaaldiagnoos
Kopsupõletiku diferentsiaaldiagnostika on äärmiselt oluline, sest erinevalt bronhiidist tuleb seda ravida hoopis teistmoodi. Kopsupõletiku diferentsiaaldiagnoos peaks põhinema patsiendi sümptomitel ning laboratoorsetel ja instrumentaalsetel kriteeriumidel:
- Haigus algab reeglina ägedalt ja sellega kaasneb palavik (kehatemperatuur ületab 38 ° C).
- Röga ilmub koos mäda ja vere lisanditega.
- Auskultatsioon paljastab löökpillide ajal varem puudunud lokaalse kopsuheli lühenemise.
- Leukotsüütide valem on nihkega vasakule.
- Uuringu käigus näitavad kiiritusdiagnostika spetsialistid peamise radioloogilise tunnuse - vere ja rakkude kogunemist teatud kopsupiirkonda, mis tekitab teatud voolukatkestuse mustri.

Kopsupõletiku diagnoosimine ei ole lihtne ülesanne. Lisaks sellele, et seda haigust on lihtne segi ajada teiste patoloogiliste protsessidega, võib see haigus olla mitut tüüpi ja sellel on erinev kliiniline pilt. Täiskasvanute ja laste kopsupõletiku klassifikatsioon sõltub vormist, etioloogiast, esinemistingimustest, iseloomulikest tunnustest, lokaliseerimisest ja võimalikest tüsistustest.
Vormi järgi jaguneb see patoloogia järgmisteks rühmadeks:
- kogukonna omandatud (kodus) - esineb kõige sagedamini;
- haiglas viibimise ajal omandatud põletikuline ja nakkusprotsess;
- pneumocystis - täheldatud immuunpuudulikkusega patsientidel.
Ravi taktikas on suur tähtsus patogeeni tuvastamisel, mis võib olla üks järgmistest patogeenidest:
- Pneumokokk;
- mükoplasma mikroorganismid;
- klamüüdia kopsupõletik;
- legionella;
- Pfeifferi kepp;
- kuldne staphylococcus aureus;
- võlukepp Friedlander;
- mitterakulised nakkusetekitajad;
- patogeensed seened.
- fokaalne (bronhopneumoonia) tekib väikese lokaliseerimise või äravooluga;
- lobar (alumine lobar);
- kahepoolne (mõlemad kopsud on kahjustatud).
Tõsist tähelepanu tuleb pöörata kopsupõletiku diagnoosimisele ja ravile, kuna see haigus võib õigeaegse ravi puudumisel lõppeda surmaga. Keskealiste patsientide suremus, kes ei põe raskeid somaatilisi haigusi, ei ületa 3%. Kuid eakate kopsupõletik, mida raskendavad kroonilised haigused, on igal kolmandal patsiendil halva prognoosiga.
Põhilised diagnostikameetodid
Patsiendid, kes hindavad oma elu, ei taipa kodus pikka aega kopsupõletikku kindlaks teha ning esimese kopsupõletiku kahtluse korral lähevad nad diagnoosimiseks ja ravimiseks meditsiinikliinikusse või kutsuvad vähemalt parameediku.
Kogenud kopsuarst teab väga hästi, kuidas kopsupõletikku ära tunda ja kuidas bronhiiti kopsupõletikust eristada.
Kopsupõletiku diagnoosimine hõlmab selliseid laboratoorseid ja instrumentaalseid uuringuid:
- fluoroskoopia;
- kliiniline vereanalüüs;
- vere keemia;
- Uriini analüüs;
- röga ja määrdumiste uurimine;
- vere gaasilise koostise hindamine.
Lisaks võib isiku uurimise tehnika hõlmata järgmisi diagnostilisi protseduure:
- kopsu biopsia;
- bronhoskoopia.
Kuid enne ülalkirjeldatud meetodite kasutamist alustab pulmonoloog uuringut, hinnates patsiendi auskultatiivset pilti.
Auskultatsioon
Kui pulmonoloogid diagnoosivad patoloogiat auskultatsiooni abil, võib äge kopsupõletik anda selliseid haigusnähte:
- Mõjutatud piirkonna küljel on tugevdatud bronhiaalfoonia tunnuseid.
- Fokaalse kahjustuse korral on kuulda segahingamist. Sissehingamisel iseloomustatakse seda vesikulaarsena ja väljahingamisel täheldatakse bronhide hingamise nõrgenemist.
- Haiguse lobar-vormis on algfaasis ja eraldumise staadiumis kuulda praksuvat heli.
- Pleuropneumooniat iseloomustab pleura lehtede hõõrdumisel tekkiv tugev müra. Ja kui moodustub efusioon, on hingamine terav lõdvestunud.
- Põletikulise protsessi raske käigu korral tuvastatakse südame kuulamisel südamelöökide väljendunud kiirendus.
Eriti eakatel patsientidel võib ägeda vaskulaarse puudulikkuse tekkega tekkida järsk vererõhu langus.
Haiguse krupoosse vormi diagnoosimine algab alati kuulamisest. Sellel patoloogial on 2 informatiivset tunnust:
- Alveolaarne pragunemine inspiratsioonil, mis ei kao pärast patsiendi kulli.
- Niisked räiged inspiratsioonil. Neid seletatakse asjaoluga, et õhuvoolu möödumisel lõhkeb bronhides olev mulliline viskoosne eksudaat.
Fokaalse kopsupõletiku korral ilmneb esimeses ja kolmandas staadiumis spetsiifiline praksumine. Ja vilistav hingamine koos vedela sekretsiooni kogunemisega liigitatakse peeneks mullitavaks helinaks. Lobarpatoloogiaga auskultatsioon aitab pulmonoloogil määrata põletiku staadiumi.
Video
Video – mis on kopsupõletik?
Röntgendiagnostika
Täpse diagnoosi seadmisel mängib võtmerolli haiguse röntgendiagnostika. Kuid peaaegu kõik patsiendid teavad, et kopsupõletikuga röntgenuuringu tegemisel ei saa keha kiirgusega kokkupuudet vältida, mistõttu nad on huvitatud sellest, kas fluorograafia näitab kopsupõletikku.
Tegelikult on fluorograafilise uuringu ülesanne alumiste hingamisteede tõsiste haiguste ennetamine. Ja see võtab radioloogias väärilise koha. Kui aga võrrelda kopsupilti fluorograafial ja kopsuröntgenil, selgub, et tumenemine või patoloogia on röntgenpildil paremini näha.
Kas haigust on võimalik näha fluorograafial ja kui hästi see sõltub suuresti sellest, mis tüüpi infektsioon mõjutab kopsu struktuure. Kopsuröntgeniülesvõte kopsupõletiku korral ei ole omakorda mitte ainult viis haiguse tuvastamiseks, vaid seda saab kasutada ka ravi jälgimiseks ning positiivse või negatiivse dünaamika märkamiseks.
Röntgenülesvõttel võib kruuposne kopsupõletik välja näha järgmine:
- ulatuslik elektrikatkestus;
- ühepoolne täielik või osaline elektrikatkestus;
- piiratud hämardamine (muudatused ei ulatu segmendist kaugemale).

Röntgenikiirgus ei näita alati fokaalset kopsupõletikku, kuna algstaadiumis iseloomustab haigust väikeste bioloogiliste struktuuridega tihendite ilmumine. Ja veel, kogenud radioloog teab, kuidas põletikulisi protsesse tuvastada isegi tihendite puudumisel, kuna röntgenikiirguse fookusvorm võib näidata kaudseid märke:
- kohalikud patoloogilised varjud;
- pleura põletik koos kiulise naastu moodustumisega selle pinnal või efusiooniga selle sees;
- kopsujuurte suurenemine;
- kopsumustri moonutamine teatud piirkonnas.
Kui haigus on röntgenpildil selgelt nähtav, kuid on vaja tuvastada patoloogilise protsessi peenemaid üksikasju, kasutatakse CT-d. Kompuutertomograafia võimaldab avastada kopsupõletikku kõige varasemates staadiumides, kuna juba siis näitab see selgelt patoloogilisi muutusi kudedes.
Vereanalüüsi
Kui patsiendid kahtlevad ennetava läbivaatuse ajal, kas fluorograafia näitab kopsupõletikku, aitavad ESR-i (erütrotsüütide settimise kiiruse) indikaatorid mitte jätta tähelepanuta tekkivat haigust. Tavalise läbivaatuse korral võivad nad normi oluliselt ületada. Ja veelgi enam, kui kopsupõletiku suhtes tehakse üldine vereanalüüs.
Reeglina on ägeda kopsupõletiku ESR väärtused 20-25 mm/h. Rasketel juhtudel võib see ulatuda 40-50 mm/h. Ja kui on ESR-i näitajad - 80 mm / h ja rohkem, siis võib kahtlustada onkoloogiat või autoimmuunhaigust. Siiski tuleb meeles pidada, et ESR ei ole absoluutne näitaja, eriti patsientidel, kes saavad ravi, mis pärsib keha soovimatuid immuunvastuseid.
Lobar-kopsupõletiku korral ei ole diagnoos täielik ilma vereanalüüsita. Hemogrammil on sel juhul standardkirjeldus - ESR-i kiirendus ja leukotsüütide valemi nihkumine vasakule. Kui leukotsüütide tase veres jõuab üle 10-12x109 / liitrit, näitab see bakteriaalse infektsiooni suurt tõenäosust ja kui nende tase langeb alla 3x109 / liitrit või üle 25x109 / liitrit, näitavad sellised näitajad ebasoodsat prognoosi. .

Nad teevad ka biokeemiat, kuid selline kopsupõletiku vereanalüüs ei anna konkreetset teavet.
Uriini ja väljaheidete uurimine
Patogeeni tuvastamisel väljaheites ja uriinis valitakse spetsiifiline ravi. See kehtib eriti selle Klebsiella vormi puhul. Kui bakteriaalset protsessi ei tuvastata õigeaegselt ja piisavat ravi ei alustata, hakkab patoloogia levima seedetrakti, maksa ja sapiteede piirkonda, kuseteede süsteemi ja võib isegi mõjutada aju.
Kui uriinis ilmub Klebsiella kopsupõletik, näitab see, et protsess on mõjutanud urogenitaalsüsteemi. Mis tahes muu ägeda kopsupõletiku korral on uriinis väike kogus punaseid vereliblesid (mikrohematuuria) ja valku (proteinuuria), mis ei ole normaalne. Kopsupõletiku analüüs, mis uurib uriini, ei kuulu kõige informatiivsemate uuringute hulka.
Kui väljaheites leitakse Klebsiella kopsupõletik, peetakse kahjustuseks seedesüsteemi. Kuid tuleb meeles pidada, et see normaalsete näitajatega bakter on tavaline jämesoole ja seedetrakti üldise mikrofloora elanik. Väljaheidete laboratoorne uurimine võimaldab teil selgelt ära tunda kõrvalekallet imikutel normist. Ja kui selgub, et täiskasvanu väljaheites tuvastatakse Klebsiella kopsupõletik, pole see teave nii oluline.
Röga uuring
Kopsupõletikku täpselt tuvastada oskava raviarsti äranägemisel võib määrata kopsupõletiku rögaanalüüsi. Hingamisteedest saadud saladuse uurimine viiakse läbi selleks, et tuvastada arenenud haiguse patogeeni perekond ja tüüp. Otsustavad on rögamääri bakterioskoopia vastused, mis värvitakse Grami järgi ja viiakse läbi mikrobioloogiline uuring.
Klamüüdiapatoloogia kinnitamiseks on kõige spetsiifilisem ja tundlikum meetod patogeeni eraldamise kultiveerimismeetodiks, kuid see erineb protsessi kestuse ja töömahukuse poolest ning piirdub praktikas enamasti serotüpiseerimisega. Mükoplasma röga määrdumise standardse bakterioskoopia läbiviimisel ei saa seda patogeeni tuvastada, seetõttu kasutatakse immunofluorestsentsi või ensüümi immuunanalüüsi meetodit.
Lisaks on olemas terve skeem, kuidas diagnoosida haruldast Frindländeri võlukepi põhjustatud kopsupõletikku. Bakterite nakatamiseks tehakse mikrobioloogilisi uuringuid. Haigustekitajat saab tuvastada emakakaelakanalist võetud määrdumisel, neelust võetud tampoonil, mõnikord leitakse Klebsiella kopsupõletik ka kurgu lima määrdumisel. Viimane juhtum on reeglina iseloomulik haiglanakkusele.
Diagnoosi formuleerimine
Pärast kõigi kopsupõletiku spetsiifiliste testide läbiviimist ja selle hindamist, kuidas kopsupõletik pildil välja näeb, tehakse diagnoos. See näitab, millist patoloogiat see on - bronhiit või kopsupõletik, samuti muid üksikasju:
- põhjustaja, mis kutsus esile patoloogia alguse;
- protsessi asukoht ja selle ulatus (kahjustus mõjutab segmenti, osa, ühte või kahte külge korraga);
- kopsupõletiku raskusastme kriteeriumid;
- tüsistuste kirjeldus, kui neid on;
- millises faasis haigus on (algus, haripunkt, normaalse struktuuri taastamine, lahenemine, lõppstaadium, pikaleveninud protsess);
- üldine pilt somaatilistest haigustest, mis võivad mõjutada taastumist.

Diagnoosi sõnastuse näide: „Pneumokoki põhjustatud lokaalne äge kopsupõletik. Esineb alumise sagara parempoolne kahjustus. Haigus on haripunktis ja kulgeb raskelt. Esineb äge osaliselt kompenseeritud hingamispuudulikkus.
Patsiendid, kellel on olnud alumiste hingamisteede haiguse raske vorm, peaksid edaspidi hoolikalt jälgima oma tervist ja läbima regulaarseid ennetavaid uuringuid. Isegi hea tervise korral näidatakse neile kord aastas tingimata röntgenikiirgust või fluorograafiat.
Riiklik sanitaar- ja epidemioloogiline määrus
Venemaa Föderatsioon
MIKROBIOLOOGILISED TEGURID
Laboratoorsed diagnostikad
kogukonnas omandatud kopsupõletik
Juhised
MUK 4.2.3115-13
Ametlik väljaanne
4.2. KONTROLLI MEETODID. BIOLOOGILISED JA
MIKROBIOLOOGILISED TEGURID
Ühiskonnas omandatud kopsupõletiku laboratoorne diagnoos
|
Juhised |
1 kasutusala
1.1. Need juhised põhjendavad ja määratlevad kopsupõletiku laboratoorse diagnoosimise metoodilised alused ja algoritmid epidemioloogilise järelevalve rakendamisel seoses kogukonnas omandatud kopsupõletikuga.
1.2. Juhend on mõeldud föderaalse tarbijaõiguste kaitse ja inimhoolekande järelevalve talituse organite ja asutuste spetsialistidele ning neid saavad kasutada ka meditsiiniorganisatsioonide ja muude huvitatud organisatsioonide spetsialistid.
1.3. Metoodilised juhised on kohustuslikud kogukonnas omandatud kopsupõletiku epidemioloogilise seire rakendamisel, epideemiavastaste meetmete käigus ja võimalike kogukonnas omandatud kopsupõletiku epideemiliste puhangute epidemioloogilisel uurimisel.
2. Terminid ja lühendid
WHO – Maailma Terviseorganisatsioon.
CAP – kogukonnas omandatud kopsupõletik.
LPO on meditsiini- ja ennetusorganisatsioon.
RHK-10 – rahvusvaheline haiguste klassifikatsioon.
SARS on äge hingamisteede viirusinfektsioon.
PCR - polümeraasi ahelreaktsioon.
PCR-RT - polümeraasi ahelreaktsioon reaalajas.
RIF - immunofluorestsentsreaktsioon.
ELISA - ensüümi immuunanalüüs.
ICA - immunokromatograafiline analüüs.
ABT - antibakteriaalne ravi.
ICU – elustamis- ja intensiivraviosakond.
BAL - bronhoalveolaarne loputus.
3. Üldteave kogukonnas omandatud kopsupõletiku kohta
Kopsupõletik on erineva etioloogia, patogeneesi ja morfoloogiliste omadustega ägedate nakkushaiguste rühm, mida iseloomustavad kopsude hingamisteede sektsioonide fokaalsed kahjustused koos intraalveolaarse eksudatsiooni kohustusliku esinemisega. 10. revisjoni rahvusvahelises haiguste, vigastuste ja surmapõhjuste klassifikatsioonis (ICD-10, 1992) on kopsupõletik selgelt eraldatud teistest mitteinfektsioosse päritoluga kopsude fokaalsetest põletikulistest haigustest. Kaasaegne kopsupõletiku klassifikatsioon võtab ennekõike arvesse haiguse arengu epidemioloogilisi tingimusi, kopsukoe infektsiooni tunnuseid ja patsiendi keha immunoloogilise reaktiivsuse seisundit. Omandamise olemuse järgi eristatakse kogukonnast omandatud kopsupõletikku (CAP) ja nosokomiaalset (nosokomiaalset) kopsupõletikku. Viimasel ajal on hakatud lisaks terminile "hospitaalkopsupõletik" kasutama laiemat mõistet - "arstiabi osutamisega kaasnev kopsupõletik" ( tervishoiuga seotud kopsupõletik). Lisaks haiglakopsupõletikule hõlmab see kategooria kopsupõletikku inimestel, kes viibivad hooldekodudes või muudes pikaajalise hoolduse asutustes. Tuleb rõhutada, et selline jaotus ei ole kuidagi seotud haiguse kulgemise raskusastmega, eristamise peamiseks kriteeriumiks on epidemioloogilised tingimused ja keskkond, kus kopsupõletik tekkis. Tavaliselt erinevad nad aga CAP-st patogeenide etioloogilise struktuuri ja antibiootikumiresistentsuse profiili poolest.
CAP-i tuleks mõista kui ägedat haigust, mis tekkis kogukonnas – st väljaspool haiglat või hiljem kui 4 nädalat pärast haiglast väljakirjutamist või mis on diagnoositud esimese 48 tunni jooksul pärast haiglaravi või arenes välja patsiendil, kes ei olnud hooldekodudes/pikaajalise hoolduse osakonnas 14 või enam päeva jälgimisel, - millega kaasnesid alumiste hingamisteede infektsiooni sümptomid (palavik, köha, rögaeritus, võimalik, et mädane, valu rinnus, õhupuudus) ja radioloogilised nähud. värsked" fokaalsed infiltratiivsed muutused kopsudes ilmse diagnostilise alternatiivi puudumisel.
Kaasaegne CAP klassifikatsioon, võttes arvesse patsiendi keha immunoloogilise reaktiivsuse seisundit, võimaldab eristada kahte peamist rühma, mis viitab erinevustele kopsupõletiku etioloogilises struktuuris:
Tüüpiline CAP (raskete immuunhäireteta patsientidel);
CAP raskete immuunhäiretega patsientidel (omandatud immuunpuudulikkuse sündroom; muud haigused või patoloogilised seisundid).
4. Kaasaegsed ideed kogukonnas omandatud kopsupõletiku etioloogilise struktuuri kohta
Konkreetse CAP patogeeni etioloogilise rolli absoluutset tähtsust saab määrata ainult seoses konkreetse piirkonna, epideemia fookuse või epidemioloogilise olukorraga. Laiemad üldistused võimaldavad tuvastada peamise suundumuse, mis määrab selle patogeeni olulisuse inimese nakkuspatoloogias, lähtudes laboratoorsete diagnostikameetodite sobivast standardiseerimise tasemest ja kasutamise sagedusest, samuti peamise põhjusliku põhjustaja poolt põhjustatud EP-de ligikaudsest suhtest. kopsupõletiku tekitaja - pneumokokk ja muud patogeenid.
Kodu- ja välismaiste teadlaste hinnangul S. pneumoniae on kopsupõletiku domineeriv etioloogiline põhjustaja, mis põhjustab 30–80% EP-st kõigis vanuserühmades (Pokrovsky V.I. et al., 1995; Zubkov M.N., 2002, Cuhna V.A., 2003, Chuchalin A.G., 2006).
Raskete immuunsusdefektidega (HIV-nakkus, kaasasündinud immuunpuudulikkus, onkohematoloogilised haigused jne) kontingentide arvu suurenemise taustal on viimastel aastatel ilmnenud selliste oportunistlike CAP patogeenide, nagu näiteks, etioloogiline tähtsus. Pneumocystis juroveci, tsütomegaloviirus. Arvestades nende patogeenide kõrget kandumise taset, tuleks vastava nosoloogia diagnoosimine läbi viia ainult riskirühmades, kasutades kaasaegseid laboriuuringute algoritme.
"Viirusliku kopsupõletiku" mõistet pole CAP diagnoosimisel veel laialdaselt kasutatud, kuid RHK-10 eristab gripiviiruste, paragripi, adenoviiruste ja teiste põhjustatud kopsupõletikku hingamisteede infektsioonide patogeenide rühmast. Samal ajal on CAP viiruslik ja bakteriaalne etioloogia laialt tuntud ja kirjeldatud gripiepideemiate ja ägedate hingamisteede infektsioonide taustal. Raske tüsistustega kopsupõletiku eriarstiabi riiklik standard sisaldab nosoloogiliste üksustena J10.0 "Kopsupõletikuga gripp" (identifitseeritud gripiviirus) ja J11.0 "Kopsupõletikuga gripp" (gripiviirust ei tuvastata).
Hingamisteede viirusnakkused on raskemad alla 5-aastastel lastel ja eakatel (üle 65-aastastel), mis väljendub selles vanuses inimeste kõrges kopsupõletikku haiglaravis ja suremuses. Nendes vanuserühmades registreeritakse sagedamini viiruslikke ja viirus-bakteriaalseid kopsupõletikke.
Gripiepideemiate ajal võib kopsupõletiku tekkerisk suureneda nendes vanuserühmades, kus konkreetsel epideemiahooajal ringleva gripiviiruse antigeense variandi anamnestiliste antikehade tase on madalam kui kaitsev, nagu on täheldatud näiteks pandeemilise gripi A / H1N1pdm2009 juhtum 30–60-aastastele isikutele. Inimesed, kes põevad südame-veresoonkonna süsteemi kroonilisi haigusi, metaboolseid häireid (rasvumine, suhkurtõbi), kroonilisi bronhopulmonaalsüsteemi haigusi, ja rasedad naised peaksid samuti kuuluma gripiga kopsupõletiku tekke riskirühmadesse.
Laste CAP etioloogiline struktuur erineb oluliselt täiskasvanute CAP etioloogiast ja varieerub sõltuvalt lapse vanusest ja haiguse tõsidusest, mida tuleks laste kopsupõletiku diagnoosimise algoritmi koostamisel arvesse võtta. Raske kopsupõletiku riskirühmad on alla 5-aastased lapsed, sageli haiged lapsed ja eriti need, kes on sündinud 24-28 rasedusnädalal.
Kopsupõletiku bakteriaalseid põhjustajaid leidub 2–50% lastest, sagedamini haiglaravil olevatel lastel, võrreldes ambulatoorsel ravil olevate lastega. Vanemate kui üheaastaste laste kogukonnas omandatud kopsupõletiku kõige levinumad bakteriaalsed patogeenid on S. pneumoniae, harvem isoleeritud H. influenzae tüüp b, S. pneumoniae on ühe kolmandiku radioloogiliselt kinnitatud kopsupõletike põhjus alla 2-aastastel lastel. Intensiivravi vajava raske kopsupõletiku korral A-rühma streptokokkide põhjustatud infektsioon või S. aureus, mida leidub 3-7% juhtudest. Moraxella catarrhalis leitud 1,5–3,0% laste kopsupõletiku juhtudest. Segaviirus-bakteriaalset kopsupõletikku diagnoositakse lastel erinevatel allikatel 8,2-33,0% juhtudest ja kui võtta arvesse kõik segatud: bakteriaalne või viirus-bakteriaalne kopsupõletik lastel, jääb nende esinemissagedus vahemikku 8-40%. Laste pneumokokkide pneumooniate hulgas on 62% juhtudest täheldatud kombinatsiooni viirusnakkustega.
Lastel esineva CAP puhul tuleb arvestada bakteri-viirusliku segainfektsiooni võimalusega, tuntud ja hiljuti avastatud hingamisteede viiruste etioloogilise tähtsusega: respiratoorse süntsütiaal-, metapneumoviirus, bocaviirus ja rinoviirused. Erinevaid hingamisteede infektsioonide viiruslikke patogeene leitakse 30 - 67% laste kopsupõletiku juhtudest ja nende osakaal on suurem väikelastel (kuni 80% juhtudest vanuses 3 kuud kuni 2 aastat) ja palju harvem lastel. vanem kui 10 aastat. M. pneumoniae ja C. pneumoniae põhjustavad valdavalt kopsupõletikku kooliealistel lastel ja ei ole tüüpilised 1–5-aastastele lastele. Neid patogeene avastatakse sagedamini nakkuskollete esinemissageduse epideemilise tõusu ajal.
Endeemilistes piirkondades ja epidemioloogiliste näitajate kohaselt tuleb CAP-i etioloogilisel diagnoosimisel arvestada zoonootiliste infektsioonide võimalusega, mida iseloomustavad põletikulised protsessid kopsudes (Q-palavik, psittakoos, tulareemia jne). CAP-ga patsientide uurimise oluline element on tuberkuloosi ja teiste mükobakterite põhjustaja etioloogilise rolli välistamine.
5. Laboratoorsete uuringute logistiline tugi
1. Bioloogilise ohutuse 2. klassi laminaarkast.
2. Binokulaarne mikroskoop illuminaatoriga, objektiivide komplekt ja okulaarid.
3. Elektrilised termostaadid bakterite kasvatamiseks, mis hoiavad kambris temperatuuri vahemikus (37 ± 1) °C.
4. CO 2 -inkubaator, mis hoiab temperatuuri kambris vahemikus (37 ± 1) °C, CO 2 sisaldust 3-7% või anaerostaat.
5. Destiller.
6. Elektriline autoklaav.
7. Külmkapp, mille temperatuur on 4–6 °C kultuuride, bioloogiliste substraatide ja reaktiivide hoidmiseks.
8. Piirituslambid ja gaasipõletid.
9. Kolooniate loendurid automaatsed ja poolautomaatsed kolooniate loendamiseks.
10. Ühekordsed steriilsed anumad röga, pleuravedeliku, hingetoru aspiraadi, stabiilse alusega BAL kogumiseks ja transportimiseks, läbipaistvast materjalist (soovitavalt plastikust, et vältida purunemist, hõlbustada anuma desinfitseerimist ja utiliseerimist); kaas peaks anumad hermeetiliselt sulgema ja olema kergesti avatav; konteiner ei tohiks sisaldada kemikaale, mis kahjustavad rögas leiduvate bakterite elujõulisust.
11. Reaktiivide komplekt mikropreparaatide Gram-värvimiseks.
12. Kultuurikandjad S. pneumoniae(nt vereagar, CNA agar).
13. Toitekeskkond perekonna bakterite kasvatamiseks Hemofiilus(nt šokolaadiagar), gramnegatiivsed bakterid ja S. aureus(Endo agar, MacConkey, munakollase-soola agar).
14. Bakterioloogilised nõud (Petri) mikrobioloogiliste kultuuride kasvatamiseks.
15. Mikropreparaatide standardsuuruses slaidid ja katteklaasid.
16. Katseklaaside ja anumate toed ja kandikud, Petri tasside transportimine, küvetid ja tugisiinid määrdude kinnitamiseks ja värvimiseks.
17. Bakterioloogilised silmused.
18. Muutuva mahuga dosaatorid, poolautomaatsed.
19. Muutuva mahuga pipettide steriilsed otsikud.
20. Drygalski spaatlid on steriilsed.
21. Mõõdetud laboriklaasid.
22. Plastikust pastörpipetid mahu standardimiseks ja vedelike ülekandmiseks.
23. McFarlandi hägususe standard või instrument bakterirakkude kontsentratsiooni määramiseks.
24. Kettad antibiootikumidega (optokiin, oksatsilliin, tsefoksitiin jne).
25. Kaasas ensüümi immunoanalüüsi analüsaator.
26. Kaasas fluorestsentsmikroskoop.
27. Seadmed PCR-labori jaoks, mis on varustatud vastavalt MU 1.3.2569-09
28. Reaktiivide (testimissüsteemide) diagnostilised komplektid kopsupõletiku patogeenide antigeenide ja DNA/RNA, samuti kopsupõletiku patogeenide spetsiifiliste antikehade tuvastamiseks, mis on Vene Föderatsioonis ettenähtud viisil kasutamiseks heaks kiidetud.
6. Ühiskonnas omandatud kopsupõletiku diagnoosimine
6.1. Pneumokoki kopsupõletiku diagnoosimine
Streptococcus pneumoniae (S. pneumoniae) on CAP-i kõige levinum bakteriaalne põhjustaja. Pneumokokk-kopsupõletikke registreeritakse igas vanuses patsientidel, neid esineb nii ambulatoorses praktikas kui ka haiglas (sh intensiivraviosakonnas hospitaliseeritutel). Talvehooajal täheldatakse CAP pneumokoki etioloogia esinemissageduse suurenemist põhjapoolkeral; Pneumokoki kopsupõletikku registreeritakse sagedamini kaasuvate krooniliste haigustega patsientidel - krooniline obstruktiivne kopsuhaigus, suhkurtõbi, alkoholism, asplenia, immuunpuudulikkus, sageli esineb baktereemiaga (kuni 25–30%).
Pneumokokk-CAP-il on tavaliselt äge algus, kõrge palavik ja valu rinnus. Siiski on CAP kliinilised, laboratoorsed ja radioloogilised ilmingud põhjustatud S. pneumoniae, ei ole piisavalt spetsiifilised ja neid ei saa pidada haiguse etioloogia piisavaks ennustajaks.
Pneumokoki CAP diagnoosimiseks kasutatakse kõige sagedamini kultiveerimismeetodeid. Uuringu kliiniliseks materjaliks on röga, venoosne veri, harvem - invasiivsed hingamisteede proovid (BAL, bronhoskoopia käigus saadud materjal, kaitstud harja biopsia jne) ja pleuravedelik.
Röga uurimisel tuleb erilist tähelepanu pöörata tarnitud proovi kvaliteedi hindamise vajadusele. Analüüs peab algama äigepreparaadi valmistamisega, kuna mikroskoopia tulemused ei mõjuta mitte ainult materjali sobivuse hindamist, vaid ka bakterioloogiliste uuringute edasist suunda. Röga bakterioloogiliseks uuringuks sobivuse kriteeriumiks on rohkem kui 25 segmenteeritud leukotsüüdi ja mitte rohkem kui 10 epiteeliraku olemasolu vaatevälja kohta, kui vaadata vähemalt 20 vaatevälja Gramiga värvitud äigepreparaadist (suurendusega × 100) . Gramiga värvitud äigepreparaadi mikroskoopia (suurendusega × 1000, kasutades immersioonläätse) paljastab 0,5–1,25 µm läbimõõduga grampositiivsed kookid (tavaliselt lansolaadised diplokokid), ilma eoste ja vimpudeta; enamikul neist on polüsahhariidkapsel.
Pleuravedeliku uurimine hõlmab Gramiga värvitud äigepreparaadi bakterioskoopiat, millele järgneb kultuuriuuring. Seda tehakse pleuraefusiooni juuresolekul ja ohutu punktsiooni tingimustes (vabalt nihkuva vedeliku, mille kihi paksus on > 1,0 cm, visualiseerimine laterogrammil). Invasiivsete respiratoorsete proovide kultiveerimine CAP-is on soovitatav immuunpuudulikkusega patsientidele; seda meetodit saab kasutada raske CAP-i valitud juhtudel, samuti ebaefektiivse esialgse antibiootikumravi (ABT) korral.
Ägeda põletikulise protsessi korral on kliiniliselt olulised BAL-ist eraldatud mikroorganismid koguses ≥ 10 4 CFU / ml, kaitstud harjade abil saadud biopsiast - ≥ 10 3 CFU / ml, röga - ≥ 10 5 CFU / ml.
Esiletõstmiseks S. pneumoniae kliinilisest materjalist on vaja kasutada toitekeskkonda, mis on rikastatud loomade (lamba, hobuse või kitse) defibrineeritud verega kontsentratsioonis 5%. Mõnevõrra halvemad tulemused saadakse defibrineeritud inimverd kasutades. Seoses defibrineeritud vere vähesusega praktilistes laborites ja selle lühikese säilivusajaga, tuleb meeles pidada, et pneumokokkide isoleerimiseks saab kasutada kaubanduslikult valmistatud šokolaadiagarit, mida kasutatakse paralleelselt ka hemofiilia isoleerimiseks. Teine kasvatamise tingimus S. pneumoniae- inkubeerimine CO 2 sisaldusega atmosfääris tõusis kuni 3–7%, kuna tegemist on fakultatiivse anaeroobiga. Valiku tõenäosus S. pneumoniae hingamisteede proovidest suureneb, kui kasutatakse selektiivset söödet, mis sisaldab saprofüütiliste ja gramnegatiivsete mikroorganismide (kolistiin, nalidiksiinhape, gentamütsiin) kasvu pärssivaid lisandeid.
Peamine test pneumokokkide eristamiseks teistest α-hemolüütilistest streptokokkidest on optokiini tundlikkus (test põhineb optokiini võimel selektiivselt pärssida pneumokokkide kasvu, erinevalt teistest viridesentsetest streptokokkidest). Siiski hulgas S. pneumoniae kasvab optokiiniresistentsete tüvede arv, mis nõuab patogeeni tuvastamiseks alternatiivsete meetodite kasutamist (lüüs sapisoolade juuresolekul, Neufeldi test, aglutinatsioon diagnostiliste pneumokoki seerumitega).
Hingamisproovide ja vere kultuurilise uurimise informatiivsus sõltub suuresti nende kogumise, säilitamise ja transportimise üldtunnustatud reeglite järgimisest (vt lisa). Lisaks leidmise tõenäosus St. pneumoniae väheneb oluliselt kliiniliste proovide saamisel süsteemse ABT taustal. Verekultuuri jaoks on eelistatav kasutada müügil olevaid toitekeskkonnaga viaale.
Pneumokoki kopsupõletiku diagnoosimise mittekultuurilistest meetoditest on viimastel aastatel enim kasutatud immunokromatograafilist testi, mis hõlmab pneumokokirakkude polüsahhariidantigeeni tuvastamist uriinist. Selle peamine eelis on kasutamise lihtsuse ja kiirete tulemuste tõttu "voodi kõrval" kasutamise võimalus. Pneumokoki kiirtest näitab täiskasvanutel vastuvõetavat tundlikkust (50-80%) ja üsna kõrget spetsiifilisust (> 90%) CAP suhtes võrreldes traditsiooniliste meetoditega. Testi puudused hõlmavad valepositiivsete tulemuste võimalust pneumokoki kandjatel (testi ei soovitata teha alla 6-aastastel lastel) ja hiljuti KAP-iga inimestel.
Tuvastamismeetodid St. pneumoniae kliinilises materjalis, kasutades PCR-i. Amplifitseerimise sihtmärkidena on autolüsiini geenid ( lytA), pneumokoki pinnaantigeen ( psaA) ja pneumolüsiin ( kiht) ja muud sihtgeenid. Neid meetodeid aga kliinilises praktikas laialdaselt ei kasutata ning nende koht CAP etioloogilises diagnoosis vajab selgitamist.
6.2. Teiste bakteriaalsete kopsupõletike diagnoosimine
Oluline kliiniliselt oluline CAP bakteriaalne põhjustaja on hemophilus influenzae (H. influenzae). Kogukonnas omandatud kopsupõletikku põhjustavad tavaliselt tüpiseerimata tüved H. influenzae. Mitmete uuringute kohaselt, H. influenzae sagedamini samaaegse KOK-iga patsientidel ja aktiivsetel suitsetajatel, on selle patogeeniga nakatumise esinemissagedus suurem mitte-raske KAP-ga patsientidel.
Perekonna esindajad Enterobakterid (Klebsiella pneumoniae, Escherichia coli jne) ja Pseudomonas aeruginosa (P. aeruginosa) tuvastatakse vähem kui 5% CAP-ga patsientidest ja need on klassifitseeritud haruldaste patogeenide hulka. Siiski võib nende mikroorganismide tähtsus raske CAP-ga patsientidel suureneda ja infektsioon suurendab mitu korda halva prognoosi tõenäosust.
Epidemioloogilised uuringud näitavad, et enterobakterite esinemissagedus on kõrgem krooniliste kaasuvate haigustega patsientidel, alkoholi kuritarvitajatel, aspiratsiooniga, hiljutise haiglaravi ja eelneva antibiootikumravi korral. Täiendavad nakkuse riskifaktorid P. aeruginosa on kroonilised bronhopulmonaarsed haigused (raske KOK, bronhektaasia), süsteemsete steroidide, tsütostaatikumide pikaajaline kasutamine.
Teine bakteriaalne patogeen Staphylococcus aureus (S. aureus) - on CAP-ga ambulatoorsete patsientide seas haruldane, samal ajal võib selle osatähtsus tõusta 10% -ni või rohkemgi raske haigusega inimestel. infektsioonile S. aureus Eelsooduvad paljud tegurid – vanadus, hooldekodus elamine, narkomaania, alkoholi kuritarvitamine. On teada, et asjakohasus S. aureus VP kui põhjustaja suureneb oluliselt gripiepideemiate ajal.
Puuduvad spetsiifilised kliinilised, laboratoorsed või radioloogilised tunnused, mis oleksid tüüpilised CAP-le, mida need patogeenid põhjustavad ja mis eristaksid seda muu etioloogiaga kopsupõletikust. Mõnel juhul, peamiselt immuunsupressiooni või alkoholi kuritarvitamise korral, K. pneumoniae võib põhjustada lobar-kopsupõletikku koos kahjustuse lokaliseerimisega kopsu ülaosasse, haiguse sümptomite kiire progresseerumise ja kõrge suremusega.
Nende patogeenide põhjustatud CAP etioloogiliseks diagnoosimiseks on kultuuriline uurimismeetod esmatähtis. H. influenzae, nagu pneumokokk, kuulub "kapriissete" mikroorganismide kategooriasse, mille kasvatamiseks on vaja faktorite X, V ja 5-7% CO 2 olemasolu inkubatsiooniatmosfääris toitekeskkonnas. Esiletõstmiseks H. influenzae kliinilisest materjalist kasutatakse perekonna bakterite isoleerimiseks tavaliselt šokolaadiagarit või selektiivagarit Hemofiilus. Kliinilise materjali külvamine pereliikmete tuvastamiseks Enterobakterid ja P. aeruginosa viiakse läbi selektiivsöötmel gramnegatiivsete bakterite isoleerimiseks (Endo agar, McConkey jne), S. aureus- munakollase-soolagaril, mannitooli-soolagaril jne.
Kliinilised proovid võivad hõlmata röga, venoosset verd, invasiivseid hingamisteede proove ja pleura vedelikku. Röga uurimisel, aga ka pneumokokkide tuvastamisel on oluline hinnata kogutud proovi kvaliteeti. Pleuravedeliku uuring viiakse läbi pleuraefusiooni olemasolul ja tingimused ohutuks pleura punktsiooniks, invasiivsed hingamisteede proovid - ainult teatud näidustuste korral.
Tuleb märkida, et tüpiseerimata tüved H. influenzae ja S. aureus on osa ülemiste hingamisteede (URT) normaalsest mikrofloorast ja asümptomaatilise kandmise sagedus võib olla üsna kõrge. Vanusega, krooniliste kaasuvate haiguste ja hiljutise süsteemse antibiootikumravi korral suureneb suuõõne ja ülemiste hingamisteede koloniseerimise sagedus enterobakterite poolt. Seda asjaolu tuleb arvesse võtta hingamisteede proovide, eriti röga, bakterioloogilise uuringu tulemuste kliinilisel tõlgendamisel.
Hingamisteede proovide ja vere kultuuriuuringu informatiivsus sõltub suuresti nende kogumise, ladustamise ja transportimise üldtunnustatud reeglite järgimisest. Identifitseerimine põhineb patogeenide toitumisvajaduse määramisel ja biokeemiliste analüüside tulemustel. Kõigi nende mikroorganismide tuvastamiseks on välja töötatud kaubanduslikud biokeemilised paneelid ja reaktiivide komplektid, kasutada saab automatiseeritud mikrobioloogilisi analüsaatoreid, mis vähendavad kultuuriuuringute töömahukust.
Kui kahtlustate EP põhjustatud S. aureus, on oluline mitte ainult patogeeni eraldamine ja tuvastamine, vaid ka selle tundlikkuse määramine oksatsilliini suhtes. Vaatamata dokumenteeritud tõendite puudumisele metitsilliiniresistentsuse tuvastamise kohta S. aureus Vene Föderatsiooni CAP-ga patsientidel on nende esinemise ja leviku oht üsna reaalne. Metitsilliiniresistentsuse tuvastamise fenotüüpsetest meetoditest on enim kasutatav testimine ketaste difusioonimeetodil kettaga, mis sisaldab 30 μg tsefoksitiini või 1 mg oksatsilliini, või sõelumist Mueller-Hintoni agaril, millele on lisatud 4% NaCl ja oksatsilliini. kontsentratsioonil 6 mg/l. Metitsilliiniresistentse nakatumise kinnitamiseks S. aureus on välja töötatud kaubanduslikud testisüsteemid, mis põhinevad geeni tuvastamisel kliinilises materjalis mecA PCR meetod.
6.3. Mycoplasma pneumoniae põhjustatud kopsupõletiku diagnoosimine
Hingamisteede mükoplasmoosi tekitaja on Mycoplasma pneumoniae- klassi esindaja Mollicutes, mis ühendab iseseisvaks eksisteerimiseks võimelisi seinata baktereid, mis paiknevad struktuurse organiseerituse tasemel bakterite ja viiruste vahel vahepealsel positsioonil.
Hingamisteede mükoplasmoos on tavaline inimtekkeline haigus. Hingamisteede mükoplasmoosi tunnuseks on epideemiate sagedus erinevatel allikatel, mis varieeruvad vahemikus 3 kuni 7 aastat. Nakkuse levikut soodustab kontaktide sagedus ja kestus suletud ja poolsuletud rühmades (sõjaväelased, internaatkoolid) viibivate isikute vahel, eriti nende moodustamise ajal.
3-10% mükoplasmainfektsiooni juhtudest diagnoositakse kopsupõletik radioloogiliselt. Põhjustatud kopsupõletikuga M. pneumoniae, muid bakteriaalseid või viiruslikke patogeene tavaliselt ei tuvastata, kuid harvadel juhtudel on see ka isoleeritud S. pneumoniae. 1-5% hingamisteede mükoplasmoosi juhtudest on vajalik haiglaravi.
Mükoplasma kopsupõletikuga kaasneb sagedane valulik ja pikaajaline köha vähese viskoosse rögaga, mis on halvasti eemaldatud, täheldatakse valusid rinnus, võib tekkida bronhide obstruktsioon. Joobeseisund on ebateravalt väljendunud. Füüsilised muutused kopsudes puuduvad või on kerged. Radioloogiline pilt on väga muutlik. Enamikul juhtudel tuvastatakse interstitsiumi kahjustused, mõnel patsiendil kopsupõletik kulgeb fokaalse või segmentaalsena, mõnikord on põletikulised muutused segunenud. Kopsupuudulikkuse nähtused ei ole mükoplasmaalsele kopsupõletikule iseloomulikud. Mükoplasma kopsupõletik kulgeb tavaliselt soodsalt, harvadel juhtudel on kulg väga raske.
Mükoplasmaalse kopsupõletiku diagnoosimine ainult kliiniliste või radioloogiliste andmete põhjal on võimatu, kuna sellel puuduvad patognoomilised tunnused. Peamine roll kopsupõletiku mükoplasmaalse etioloogia kinnitamisel on laboratoorsel etioloogilisel diagnoosimisel. Mükoplasmaalse kopsupõletiku etioloogiliseks diagnoosimiseks kasutatakse järgmist:
DNA tuvastamine M. pneumoniae polümeraasi ahelreaktsioon (PCR), mis on peamine meetod DNA otseseks tuvastamiseks M. pneumoniae on praegu standardne polümeraasi ahelreaktsioon (PCR) tuvastamisega elektroforeetilise DNA eraldamise teel, kuid reaalajas tuvastamisega PCR (RT-PCR) on kõrgeima spetsiifilisuse ja tundlikkusega;
Mükoplasma antigeeni tuvastamine otseses immunofluorestsentsreaktsioonis (RIF);
Seroloogilised uuringud spetsiifiliste IgM ja IgG klassi antikehade tuvastamiseks M. pneumoniae vereseerumis ensüümi immuunanalüüsi (ELISA) abil.
Mycoplasma pneumoniae viitab raskesti kasvatatavatele mikroorganismidele; isoleerimisprotsess võtab aega 3–5 nädalat, seega ei saa külvimeetodit diagnostikalaborites kasutada.
Kopsupõletiku kiireks etioloogiliseks diagnoosimiseks on soovitatav kasutada PCR-i alumistest hingamisteedest saadud bioloogilise materjali (sügava köhaga röga, hingetorust aspiraadid, hüpertoonilise inhalatsiooni induktsiooni tulemusena saadud röga) uurimisel. naatriumkloriidi lahus, bronhoalveolaarne loputusvedelik (BAL), mis on saadud fiiberoptilise bronhoskoopia abil).
Positiivse PCR-tulemuse saamisel alumistest hingamisteedest saadud bioloogilise materjali uurimisel loetakse kopsupõletiku etioloogia kindlaks tehtud. Kui alumiste hingamisteede bioloogilist materjali PCR-i jaoks ei ole võimalik saada, on vastuvõetav kasutada ülemiste hingamisteede tampooniproove (kombineeritud tampoon ninaneelu ja neelu tagumisest seinast) ning positiivse tulemuse saamisel on võimalik kindlaks teha kahjustuse etioloogia. kopsupõletikku tuleks pidada eeldatavasti väljakujunenud. Negatiivse PCR-tulemuse saamine ülemiste hingamisteede määrdumise uurimisel ei saa aga viidata mükoplasma infektsiooni puudumisele. Sel juhul on soovitatav teha seroloogiline diagnostika, võttes arvesse IgM- ja IgG-klassi spetsiifiliste antikehade tuvastamise tulemusi samaaegselt testitud paarisseerumites.
Retrospektiivse diagnoosimise eesmärgil, kui patsient on juba taastumisjärgus, on vaja kasutada seroloogilisi uuringuid.
Primaarset immuunvastust iseloomustab IgM antikehade süntees 1–3 nädalat pärast nakatumist, mille tuvastamine viitab infektsiooni ägedale faasile. G-klassi immunoglobuliinid ilmuvad 3-4 nädala lõpuks. Mükoplasmaalse hingamisteede infektsiooni diagnoosi kinnitab spetsiifiliste antikehade 4-kordne serokonversioon paaris vereseerumites.
Antigeenide otsene tuvastamine M. pneumoniae hingamisteede patoloogiaga patsientidelt saadud erinevates biosubstraatides (ninaneelu määrded, loputusvedelik, biopsiaproovid), seni on need tehtud eraldi diagnostikalaborites RIF-i abil. See meetod koos mükoplasma spetsiifiliste antikehade tuvastamisega ELISA abil võimaldab kinnitada haiguse põhjustatud haigust. Mycoplasma pneumoniae. Tuleb meeles pidada, et humoraalsed antikehad püsivad mitu aastat.
Mükoplasmaalse kopsupõletiku usaldusväärseks ja lõplikuks etioloogiliseks diagnoosimiseks, võttes arvesse selle patogeeni püsimise võimalust inimkehas ilma väljendunud kliiniliste ilminguteta, on soovitatav kindlaksmääratud diagnoosi täiendav kinnitamine mis tahes ülaltoodud meetodiga.
6.4. Chlamydophila pneumoniae põhjustatud kopsupõletiku diagnoosimine
C. pneumoniae põhjustab erineva raskusastmega kopsupõletikku, pikaajalist bronhiiti, farüngiiti, sinusiiti. põhjustatud kopsupõletik C. pneumoniae kulgeb tavaliselt soodsalt, harvadel juhtudel on kulg väga raske.
Segainfektsioon, näiteks kombinatsioon pneumokokkidega või raskete kaasuvate haiguste esinemine, eriti eakatel, raskendab haiguse kulgu ja suurendab surmaohtu. Sageli on infektsioon asümptomaatiline.
Riskirühma kuuluvad kõik vanused, kuid kooliealiste laste seas on klamüüdiaalsesse kopsupõletikku haigestumus suurem. Meeste seas on esinemissagedus kõrgem kui naiste seas. Epideemiapuhangud esinevad iga 4–10 aasta järel. Kirjeldatakse epidemioloogilisi puhanguid isoleeritud ja poolisoleeritud rühmades, klamüüdiainfektsiooni perekonnasisese ülekandumise juhtumeid.
Ükski praegu teadaolevatest klamüüdia kopsupõletiku diagnoosimise meetoditest ei taga patogeeni tuvastamise 100% usaldusväärsust, mis tingib vajaduse vähemalt kahe meetodi kombinatsiooni järele.
Mikrobioloogiline isolatsioon C. pneumoniae on piiratud kasutusega, kuna see on pikk ja töömahukas protsess, mida iseloomustab madal tundlikkus ja see on saadaval ainult spetsialiseeritud laboritele. Kui aga isoleeritakse elujõuline patogeen, saab diagnoosi panna suurima kindlusega ilma kinnitavate testideta. Kultuuriline isolatsioon viitab aktiivsele nakkusprotsessile, kuna püsiva infektsiooni korral läheb patogeen kultiveerimata olekusse.
Kõige spetsiifilisem ja tundlikum meetod patogeeni tuvastamiseks on PCR diagnostika. Kõrge tundlikkuse ja valepositiivsete tulemuste puudumise saab tagada, kui kasutatakse ainult litsentsitud komplekte tõhusaks DNA ekstraheerimiseks kliinilisest materjalist ja kaasaegse põlvkonna PCR komplekte, mis põhinevad reaalajas PCR-il (RT-PCR). Meetod ei võimalda eristada ägedat ja kroonilist infektsiooni.
Kopsupõletiku kiireks etioloogiliseks diagnoosimiseks on soovitatav kasutada PCR-i alumistest hingamisteedest saadud bioloogilise materjali (sügava köhaga röga, hingetorust aspiraadid, hüpertoonilise inhalatsiooni induktsiooni tulemusena saadud röga) uurimisel. naatriumkloriidi lahus, bronhoalveolaarne loputusvedelik (BAL), mis on saadud fiiberoptilise bronhoskoopia abil). Seroloogilisi teste kasutatakse retrospektiivseks diagnoosimiseks ja epideemiapuhangute olemuse retrospektiivseks analüüsiks.
Positiivse PCR-tulemuse saamisel alumistest hingamisteedest saadud bioloogilise materjali uurimisel loetakse kopsupõletiku etioloogia kindlaks tehtud. Kuid kopsupõletiku korral, mis on põhjustatud Klamüdofiil (Klamüüdia) pneumoniae, köha on sageli mitteproduktiivne, sellistel juhtudel on PCR-is soovitatav kasutada ülemiste hingamisteede tampooniproove (kombineeritud tampoon ninaneelu ja neelu tagumisest osast) ning positiivse tulemuse saamise korral tuleks eeldada kopsupõletiku etioloogiat. asutatud.
Negatiivse PCR tulemuse saamisel uuritakse ülemiste hingamisteede tampooniproove, kui kahtlustatakse infektsiooni põhjustatud C. pneumoniae, on epidemioloogiliste või kliiniliste andmete põhjal soovitatav seroloogiline diagnoos, võttes arvesse IgM- ja IgG-klassi spetsiifiliste antikehade tuvastamise tulemusi samaaegselt testitud paarisseerumites.
Retrospektiivse diagnoosimise eesmärgil, kui patsient on taastumisjärgus, on vaja kasutada seroloogilisi uuringuid.
Praegu tuvastatakse spetsiifilised IgM ja IgG antikehad C. pneumoniae kasutage ensüümi immuunanalüüsi (ELISA) või immunofluorestsentsreaktsiooni (RIF) meetodit. Ägeda seroloogilised kriteeriumid C. pneumoniae- infektsioonid: IgG antikehade tiitrite 4-kordne tõus paarisseerumites või IgM antikehade ühekordne tuvastamine tiitris ≥ 1:16.
Klamüüdia kopsupõletiku usaldusväärseks ja lõplikuks etioloogiliseks diagnoosimiseks, võttes arvesse selle patogeeni püsimise võimalust inimkehas ilma väljendunud kliiniliste ilminguteta, on soovitatav kindlaksmääratud diagnoosi täiendav kinnitamine mis tahes ülaltoodud meetodiga.
6.5. Legionella kopsupõletiku põhjustatud kopsupõletiku diagnoos
Legionella ja pneumokokk-kopsupõletiku kliiniliste ilmingute ja sümptomite sarnasuse tõttu on patsientide etiotroopse ravi taktika valikul määrava tähtsusega kiire ja tõhus laboridiagnostika. 1999. aastal võtsid WHO ja 2002. aastal Euroopa legionelloosi töörühm diagnostiliste kriteeriumidena vastu standardid, mille kohaselt loetakse legionelloosi diagnoos alumiste hingamisteede ägeda infektsiooni korral (kliiniliselt ja radiograafiliselt kinnitatud) kindlaks tehtud:
1) eraldatud hingamisteedest või kopsukoest legionellakultuuri eraldamisel;
2) spetsiifiliste antikehade tiitri 4-kordse või enama tõusuga Legionella pneumophila serorühm 1 kaudses immunofluorestsentsreaktsioonis;
3) lahustuva antigeeni määramisel Legionella pneumophila serorühm 1 uriinis ensüümi immuunanalüüsi (ELISA) või immunokromatograafilise meetodi (IHA) abil.
Kui haiguse varases staadiumis võetav vereseerum puudub, tuvastatakse oluliselt kõrge antikehade tase. Legionella pneumophila serogrupp 1 (1:128 ja üle selle) ühes seerumis kaudse immunofluorestsentsi abil võimaldab pidada legionelloosi diagnoosi arvatavasti tuvastatuks. Sarnaselt tõlgendatakse tulemusi, mis on saadud otsest immunofluorestsentsi või PCR-i kasutades respiratoorse sekretsiooni või kopsukoes patogeeni või selle DNA tuvastamise põhjal.
Laboratoorsete diagnostikastandardite lõiked 2 ja 3 kehtivad praegu ainult selliste antikehade ja antigeenide suhtes, mis on määratud Legionella pneumophila serorühm 1. Teiste serorühmade jaoks Legionella pneumophila tulemused, mis on saadud antikehade määramisel või antigeeni tuvastamisel uriinis, võimaldavad ainult oletatavat diagnoosi. Patogeeni kultuuri isoleerimine jääb ainsaks standardimeetodiks, mis paneb paika lõpliku diagnoosi teiste serorühmade poolt põhjustatud infektsiooni korral. Legionella pneumophila või tüübid Legionella spp.. Samas tuleb märkida, et enam kui 80% sporaadilistest ja grupilistest legionelloosi juhtudest on põhjustatud tüvedest. Legionella pneumophila serorühm 1 ja kogukonnast omandatud kopsupõletiku epideemiliste puhangute korral tüvede etioloogiline tähtsus L. pneumophila serogrupp 1 kinnitati 96% juhtudest.
Peamine standardmeetod, mis praegu võimaldab legionella nakkuse õigeaegset diagnoosimist ja jälgimist, on legionella antigeeni määramine uriinis immunokromatograafilise või ensüümimmuunanalüüsiga. Meetod võimaldab diagnoosi lõplikult kinnitada 1-2 tunni jooksul.Selle meetodi paremus teiste standardis sisalduvate meetodite ees seisneb eelkõige uuringu ajastuses ja kliinilise materjali kättesaadavuses.
Bakterioloogiline meetod võtab aega vähemalt 4-5 päeva ning bronhoskoopia ja biopsia materjali saamiseks on vaja invasiivseid protseduure, kuna patogeeni ei ole alati võimalik rögast eraldada, eriti pärast etiotroopse ravi algust. Antikehade tiitrite diagnostilise tõusu tuvastamine kaudse immunofluorestsentsi reaktsioonis on võimalik alles haiguse 3. nädalal, kui tehakse antibiootikumravi kuur ja haiguse tulemus on tavaliselt selge. Vajadus uurida paarisseerumit määrab selle meetodi abil legionelloosi diagnoosimise retrospektiivse iseloomu.
PCR-meetodit võib soovitada eelkõige BAL-i või biopsia uurimiseks legionella kopsupõletiku kahtluse korral immuunpuudulikkusega patsientidel. Kui selle kategooria patsientide infektsioon on põhjustatud tüvedest L. pneumophila mis ei kuulu serorühma 1, siis on see meetod ainus, mis võimaldab teil kiiresti diagnoosi panna.
6.6. Pneumocystis jiroveci põhjustatud kopsupõletiku diagnoosimine
Pneumotsüstoos esineb reeglina ägedate hingamisteede haiguste, krooniliste bronhopulmonaalsete haiguste ägenemiste, obstruktiivse bronhiidi, larüngiidi ja ka gaasivahetuse häiretega kopsupõletikuna (interstitsiaalne kopsupõletik).
Pneumotsüstilise kopsupõletiku tüüpilist radioloogilist pilti esindab kopsukoe kahepoolne hilar-interstitsiaalne infiltratsioon, mille intensiivsus ja suur kahjustus on otseses proportsioonis haiguse progresseerumisega. Vähem levinud on üksikud ja mitmekordsed kopsukoe tihendid, ülemise sagara infiltraadid ja pneumotooraks. Pleuriit ja suurenenud rindkere lümfisõlmed on haruldased. Patoloogia puudumisel röntgenülesvõtetel võib kõrge eraldusvõimega CT tuvastada lihvklaasi muutusi või kopsumustri rakulist deformatsiooni.
Täiskasvanutel areneb pneumotsüstilise kopsupõletik tavaliselt sekundaarse immuunpuudulikkuse taustal. Inkubatsiooniperiood on lühike - 2 kuni 5 päeva, algus on äge. Immunosupressiivset ravi (kortikosteroide) saavatel patsientidel võib tekkida pneumoonia pneumoonia. Meditsiinilise immunosupressiooni korral ilmneb see haigus kortikosteroidide annuse vähenemise taustal. Prodromaalne periood kestab tavaliselt 1 kuni 2 nädalat; AIDS-iga patsientidel - 10 päeva.
Pneumocystis kopsupõletikku AIDS-i korral iseloomustab tavaliselt aeglane krooniline protsess. Esialgu auskultatiivseid sümptomeid ei tuvastata. Kopsude ventilatsiooni ja gaasivahetuse järsu rikkumisega seotud hingamispuudulikkus põhjustab surmava tulemuse. Võimalikud on ka abstsessid, spontaanne pneumotooraks ja eksudatiivne pleuriit.
Pneumotsütoos areneb lastel tavaliselt 4.-6. elukuul, kui vastsündinu immuunsüsteem ei ole veel täielikult välja kujunenud. Selle haiguse suhtes on kõige vastuvõtlikumad enneaegsed, rahhiidi, alatoitumise ja kesknärvisüsteemi kahjustused.
Väikelastel kulgeb pneumotsüstoos klassikalise interstitsiaalse kopsupõletikuna, millel on selged patoloogiliste protsesside etapid.
Haiguse ilmse kulgemise morfoloogiliste muutuste põhjal eristatakse kahjustatud kopsu kolme etappi:
turse (7-10 päeva);
Atelektaatiline (kuni 4 nädalat);
Emfüsematoosne (selle kestus on muutuv).
nakatumise riskirühmad Pneumocystis jiroveci on:
Enneaegsed lapsed, nõrgestatud vastsündinud ja väikelapsed, kellel on hüpogammaglobulineemia, alatoitumus ja rahhiit;
Leukeemiaga patsiendid, vähihaiged, immunosupressante saavate organite retsipiendid;
Tuberkuloosi, tsütomegaalia ja muude infektsioonidega patsiendid;
HIV-nakkusega.
Kõige universaalsem tsüstide, trofosoiitide ja sporosoiitide tuvastamiseks on Romanovsky-Giemsa meetod. Elutähtis värvimine neutraalse punasega võimaldab tuvastada ka patogeeni aktiivses faasis.
Kõik ülaltoodud värvimismeetodid nõuavad täpseks tuvastamiseks kõrgelt kvalifitseeritud teadlast. Pneumocystis jiroveci; Lisaks on need meetodid ainult näidustuseks ja on suunatud tsüsti ümbrise tavalistele seente polüsahhariididele.
Immunofluorestsentsmeetodil (IF) tsüstide ja trofosoiitide tuvastamiseks, kasutades loputusvedelikus monoklonaalseid või polüklonaalseid antikehi, on suurem spetsiifilisus ja tundlikkus kui preparaatide histokeemiline värvimine.
Pneumotsüstoosi diagnoosimisel mängib olulist rolli ka immunoloogiline meetod, mis tuvastab IgG ja IgM klassi spetsiifilisi antikehi (ELISA), eriti diagnoosimisel, kui patsiendilt ei ole võimalik loputusvedelikku või röga võtta. Terve elanikkonna hulgas tuvastatakse G-klassi antikehi üsna sageli (60–80%). Seetõttu peaks antikehade uurimine toimuma dünaamiliselt koos seerumi kohustusliku tiitrimisega. IgG 4-kordse suurenemise ja/või IgM antikehade tuvastamine. Pneumocystis jiroveci räägib selle patogeeni põhjustatud ägedast nakkusprotsessist.
Polümeraasi ahelreaktsioon (PCR) on üks ülitundlikke diagnostilisi meetodeid, mis võimaldab tuvastada patogeeni üksikuid rakke või DNA fragmente. Pneumocystis jiroveci röga või bronhoalveolaarse loputuse korral.
6.7. Viirusliku ja viirus-bakteriaalse kopsupõletiku diagnoosimine
Täiskasvanute kopsupõletiku viiruslikku või viirus-bakteriaalset etioloogiat võib kahtlustada gripi ja SARS-i esinemissageduse tõusu ajal, samuti juhul, kui haigusjuhtumite rühmad esinevad kuu jooksul pärast suletud ja poolkinnise meeskonna moodustamist. Raske viirusliku kopsupõletiku riskirühma kuuluvad südamepuudulikkuse ja bronhopulmonaalsüsteemi krooniliste haiguste all kannatavad inimesed. Kaasnevad patoloogiad raske gripi korral on ka rasvumine, diabeet, rasedus, eriti kolmandal trimestril.
Peamised viirusliku ja viirus-bakteriaalse kopsupõletiku tekitajad immuunkompetentsetel täiskasvanutel on A- ja B-gripiviirused, adenoviirused, PC-viirus, paragripiviirused; metapneumoviirust leitakse harvemini. Täiskasvanud gripihaigetel tekivad tüsistused 10-15% juhtudest ja 80% neist on kopsupõletik.
CAP-ga lastel on oluline diagnoosida viirusnakkusi, mille etioloogilises struktuuris on viirusinfektsioonidel oluline roll.
Hingamisteede ägedate viirusnakkuste etioloogilise diagnoosimise kaasaegsed meetodid põhinevad peamiselt: RNA / DNA patogeenide tuvastamisel nukleiinhapete amplifikatsioonimeetoditega, eelkõige kõige laialdasemalt kasutatava PCR abil; antigeenide tuvastamise kohta immunokromatograafia (IHA), ensüümi immuunanalüüsi (ELISA), immunofluorestsentsi (RIF) abil. Jääb oluliseks peamiselt retrospektiivsete diagnoosimeetodite puhul spetsiifiliste antikehade tuvastamiseks vereseerumis (komplemendi fikseerimise reaktsioon (RCC), neutraliseerimisreaktsioon (PH), hemaglutinatsiooni inhibeerimise reaktsioon (RTGA), kaudne hemaglutinatsiooni reaktsioon (RIHA), ensüümi immuunanalüüs (ELISA) ). Kasvatada on võimalik gripiviiruste A ja B, respiratoorse süntsütiaalviiruse, paragripiviiruste tüüpide 1-3, inimese metapneumoviiruse ja adenoviiruste kasvatamine.
Kultuuriuuringud on töömahukad ja aeganõudvad, tavapraktikas kasutatakse neid ainult gripi seireks, samas kui positiivsete proovide esmane tuvastamine toimub PCR-is, seejärel toimub isoleerimine kultuuris.
Immunofluorestsentsreaktsioonid võimaldavad tuvastada gripiviiruste, respiratoorse süntsütiaalviiruse, paragripiviiruste 1-3 ja adenoviiruste antigeene. Immunofluorestsentsi uuringute materjal tuleb koguda hiljemalt kolm päeva pärast hingamisteede infektsiooni tekkimist (haiguse ägedas faasis, kuna meetod on kõige tõhusam, kui viiruse antigeenide rakusisene sisaldus on kõrgeim), mis muudab selle kopsupõletiku etioloogiliseks diagnoosimiseks mitteinformatiivne meetod. Lisaks on meetod analüüsi tulemuste tõlgendamisel subjektiivne.
Seroloogilised testid tuvastavad respiratoorse süntsütiaalviiruse (PH, RSK, RNGA, ELISA), paragripiviiruste 1-4 (RTGA, RSK, ELISA), adenoviiruste (ELISA), rinoviiruste (RSK) antikehi; Uuring on tavaliselt retrospektiivne. Võrreldes CSC-ga on ELISA tundlikum. Tõlgendamise käigus hinnatakse spetsiifiliste antikehade tiitri muutumist aja jooksul paarisseerumites (saadud 2-nädalase intervalliga) ja nende tulemused sõltuvad suuresti patsiendi immuunsüsteemi seisundist.
Rahvusvaheliste kriteeriumide (ESCMID 2011, BTS, 2009–2011) kohaselt on primaarse viirusliku kopsupõletiku (või viiruslik-bakterite segapneumoonia) tunnustatud tõendid gripiviiruse või muu respiratoorse viiruse nukleiinhapete tuvastamine PCR abil. Sagedamini kasutatakse diagnoosimisel ninaneelu ja neelu tagumise seina tampooni, kusjuures suurima tundlikkuse, mis on tingitud suuremast viiruste sisaldusest uuritavas proovis, saab saavutada mõlema lookuse määrde kombinatsiooniga. Selleks võetakse patsiendilt kahe erineva sondiga tampoonid alumise ninakäigu limaskestalt ja seejärel orofarünksi tagumisest seinast, kusjuures mõlema sondi tampoonid murtakse pärast võtmist järjestikku üheks toruks. määrib.
Kopsukoes paljunevate gripiviiruste puhul (A/H5N1, A/H1N1pdm2009) kopsupõletiku teisel nädalal võib aga viiruse kontsentratsioon tampooniproovides olla selle avastamiseks juba ebapiisav, seda eriti ebapiisava materjali proovide võtmise korral. Lisaks on nii viiruslike kui ka bakteriaalsete mõjurite samaaegseks tuvastamiseks soovitatav kasutada alumiste hingamisteede materjale (sügava köhimise röga, hüpertoonilise naatriumkloriidi lahuse inhaleerimisel esilekutsumise tulemusena saadud röga, hingetoru aspiratsiooni). , kiudoptilise bronhoskoopia abil saadud bronhoalveolaarne loputusvedelik (BAL).
Ägedate hingamisteede viirusnakkuste olulisemate patogeenide tuvastamiseks: A- ja B-gripiviirused, PC-viirus, metapneumoviirus, paragripiviirused 1-4, koronaviirused (229E, OS43, NL63, HKUI), rinoviirused, adenoviirused (B, C, E ), Bocaviiruse PCR komplektid on saadaval elektroforeetilise tuvastamise, fluorestsentsi lõpp-punkti tuvastamise ja amplifikatsiooniproduktide akumuleerumise reaalajas tuvastamisega (RT-PCR) vormingutes. Maksimaalne spetsiifilisuse ja tundlikkuse tase saavutatakse reaalajas PCR-il põhinevate testidega, eeliseks on mitme patogeeni samaaegse tuvastamisega testid. Viiruse genoomi spetsiifiliste konservatiivsete piirkondade kasutamine sihtmärkidena toob kaasa PCR kõrge diagnostilise tundlikkuse ja spetsiifilisuse, mis läheneb kultuuriuuringutega võrreldes 100% -le. Gripi diagnoosimisel on võimalik määrata A-gripiviiruste alatüüp, sealhulgas kõrge patogeensusega linnugripiviirus A/H5N1 ja uus pandeemiline variant A/H1N1pdm2009, nn seagripi viirus.
Polümeraasi ahelreaktsioon elektroforeetilise tuvastamise vormingus nõuab erimeetmeid saastumise vältimiseks (valepositiivsed tulemused), mis saavutatakse erimeetmete rakendamisega ja järgides labori korraldamise erireegleid vastavalt MU 1.3.2569-09 "Töö korraldamine" laborid, mis kasutavad nukleiinhapete amplifikatsiooni meetodeid, kui nad töötavad materjaliga, mis sisaldab I-IV patogeensusrühma mikroorganisme.
Gripiviiruse põhjustatud kopsupõletiku etioloogia tuleks lugeda tuvastatuks, kui alumiste hingamisteede materjalist tuvastatakse PCR-ga gripiviiruse RNA (või kombinatsioonis teiste viirustega) bakterioloogilise vereanalüüsi negatiivse tulemusega (või kopsupõletiku bakteriaalsete patogeenide DNA puudumisel veres vastavalt PCR tulemustele või kui kvantitatiivses PCR-is tuvastatakse alumiste hingamisteede materjalis ebaolulised DNA kontsentratsioonid). Kui alumiste hingamisteede materjali ei ole võimalik saada, saab kopsupõletiku gripi etioloogiat suure tõenäosusega tõestada, kui ninaneelu ja orofarünksi tampooniproovides tuvastatakse gripiviiruse RNA.
Teiste hingamisteede viiruste põhjustatud kopsupõletiku etioloogia loetakse tuvastatuks, kui PCR RNA / DNA abil tuvastatakse alumiste hingamisteede materjalis üks hingamisteede viirus (või mitu viirust samaaegselt) bakterioloogilise vereanalüüsi negatiivse tulemusega (või kopsupõletiku bakteriaalsete patogeenide DNA puudumine veres vastavalt PCR tulemustele või kui kvantitatiivses PCR-is tuvastatakse alumiste hingamisteede materjalis ebaolulised DNA kontsentratsioonid).
Kopsupõletiku viiruslikku etioloogiat peetakse eeldatavasti tuvastatuks, kui PCR tuvastab ninaneelu ja orofarünksi tampooniproovides ühe respiratoorse viiruse (või mitu viirust samaaegselt) bakterioloogilise vereanalüüsi negatiivse tulemusega (või kopsupõletiku bakteriaalsete patogeenide DNA puudumisel). veri vastavalt PCR tulemustele või kui kvantitatiivses PCR-is avastatakse alumiste hingamisteede materjalis ebaoluline DNA kontsentratsioon), samuti juhul, kui bakterioloogilisi uuringuid ei ole tehtud.
Kopsupõletiku viiruslikku etioloogiat peetakse eeldatavalt tuvastatuks, kui RIF tuvastab ühe respiratoorse viiruse (või mitme viiruse samaaegselt) antigeenid bakterioloogilise vereanalüüsi negatiivse tulemusega (või kopsupõletiku bakteriaalsete patogeenide DNA puudumisel). veri vastavalt PCR tulemustele või kui kvantitatiivses PCR-is avastatakse alumiste hingamisteede materjalis ebaoluline DNA kontsentratsioon), samuti kui ei ole läbi viidud bakterioloogilisi uuringuid.
Kopsupõletiku viiruslik-bakteriaalne etioloogia loetakse tuvastatuks, kui alumiste hingamisteede materjalist tuvastatakse PCR-ga ühe viiruse (või mitme viiruse samaaegselt) RNA/DNA positiivse bakterioloogilise vereanalüüsiga (või DNA olulised kontsentratsioonid veres või alumiste hingamisteede materjalis kvantitatiivses PCR-is).
Kopsupõletiku viirus-bakteriaalne etioloogia loetakse eeldatavalt tuvastatuks juhul, kui RIF või ICA on tuvastanud ühe respiratoorse viiruse (või mitme viiruse samaaegselt) antigeenid bakterioloogilise vereanalüüsi positiivse tulemusega (või oluliste antigeenide tuvastamisel). DNA kontsentratsioonid veres või alumiste hingamisteede materjalis kvantitatiivses PCR-is).
Seroloogiliste uuringute tulemused võimaldavad hinnata viirusinfektsiooni olemasolu või puudumist, mille vastu tekkis kopsupõletik.
6.8. Kopsukahjustusi ja tuberkuloosi põhjustavate zoonootiliste haiguste diferentsiaaldiagnoos
Kopsukahjustusi põhjustavate zoonootiliste haiguste (ornitoos, Q-palavik, tulareemia jne) diferentsiaaldiagnostika viiakse läbi epidemioloogiliste näitajate järgi ja nende patogeenide endeemilistes piirkondades vastavalt sanitaareeskirjadele "Ornitoosi ennetamine", "Q-palaviku ennetamine" , "Tulareemia ennetamine". Tuberkuloosi diferentsiaaldiagnoos on samuti oluline ja vajalik komponent raske kopsupõletikuga patsientide uurimisel.
7. Algoritm kogukonnas omandatud kopsupõletiku diagnoosimiseks
Tüüpilise CAP laboratoorse diagnoosimise algoritm (raskete immuunhäireteta patsientidel) on raske ja mitteraske kopsupõletiku, raskete immuunhäiretega patsientide ja laste puhul erinev. CAP õigeaegne etioloogiline diagnoosimine on eriti oluline raske kopsupõletiku korral intensiivraviosakonnas hospitaliseeritud patsientidel.
Raske kopsupõletiku korral on kõigepealt vaja läbi viia bakterioloogiline uuring pneumokokkide ja teiste bakteriaalsete etioloogiliste ainete suhtes, võttes arvesse nende tundlikkuse spektrit antibiootikumide suhtes, ning välistada ka legionella etioloogia, kasutades kiirtesti legionella antigeeni määramiseks uriinis. patsiendid. Gripi ja SARS-i esinemissageduse tõusu ajal on viirusliku või viirus-bakteriaalse iseloomuga raske kopsupõletiku tõenäosus üsna kõrge. Sel juhul peaks raske kopsupõletiku diagnoosimise algoritm võtma arvesse bakteriaalse, viirusliku või viirus-bakteriaalse etioloogia võimalust. Ülalnimetatud raske kopsupõletiku etioloogilise variandi alahindamine laboratoorse diagnoosimise staadiumis intensiivraviosakonnas patsientidel võib lõppeda surmaga. Suremus raske EP korral võib olla 25–50%.
Mõistet "mitteraske kopsupõletik" kasutatakse kopsupõletike puhul, mida ravitakse ambulatoorselt või statsionaarselt, kuid mis ei vaja intensiivraviosakonnas haiglaravi. Piisava õigeaegse ravi puudumisel võib kerge kopsupõletik põhjustada tõsiseid tüsistusi ja bronhopulmonaalsüsteemi kroonilisi haigusi. Suremus võib sel juhul olla vahemikus 1 kuni 10%. Koos pneumokoki ja teiste bakteriaalsete etioloogiliste ainete bakterioloogilise uuringuga, võttes arvesse nende tundlikkuse spektrit antibiootikumide suhtes, tuleks mitteraskete kopsupõletike diagnoosimisel arvesse võtta mükoplasma või klamüüdia etioloogia võimalust. Grippi ja SARS-i esinemissageduse tõusu ajal on suur tõenäosus mitteraskeks viiruslikuks kopsupõletikuks, samuti nimetatud viiruste segainfektsiooniks bakterite, klamüüdia või mükoplasmatega.
Nõuab CAP etioloogilise struktuuri laiendatud analüüsi raskete immuunhäiretega patsientidel (omandatud immuunpuudulikkuse sündroom, muud haigused või patoloogilised seisundid). Lisaks pneumokoki, muude bakteriaalsete etioloogiliste ainete bakterioloogilisele testimisele, võttes arvesse nende tundlikkuse spektrit antibiootikumide suhtes ja legionella suhtes, on selle patsientide rühma puhul suur tõenäosus haigestuda peamiselt "oportunistlike etioloogiliste ainete" põhjustatud kopsupõletikku. Pneumocystis jiroveci, samuti tsütomegaloviirus, seened, herpesviirus. Tuberkuloosi ja teiste mükobakteriooside diferentsiaaldiagnostika on samuti oluline ja vajalik komponent raskete immuunhäiretega KAP-ga patsientide uurimisel. Immuunpuudulikkusega patsientide kopsupõletiku legionella etioloogia välistamiseks tehakse bronhoalveolaarne loputus või biopsia, kasutades bakterioloogilist meetodit või PCR-i. L. pneumophila serorühmad 2 - 15 ja Legionella spp..
Lastel esineva CAP-i puhul on polüetioloogia kõige enam väljendunud, mida tuleb laboratoorse diagnoosimise protsessis arvesse võtta. Koos pneumokoki ja teiste bakteriaalsete etioloogiliste ainete bakterioloogilise uuringuga, võttes arvesse nende tundlikkuse spektrit antibiootikumide suhtes, tuleks laste kopsupõletiku diagnoosimisel arvesse võtta mitmesuguseid hingamisteede viiruseid, mitte ainult epideemia esinemissageduse suurenemise ajal. gripi ja SARS-i (gripiviirused, RS-viirus, metapneumoviirus, paragripiviirused, adenoviirused, koronaviirused, bokaviirus, rinoviirused), samuti mükoplasmade ja klamüüdia etioloogiline roll. Lastel esineva CAP korral on suur tõenäosus bakteriaalse-viirusliku segainfektsiooni tekkeks, sealhulgas klamüüdia ja mükoplasma segainfektsiooniks.
8. Laboratoorsete uuringute kvaliteedikontroll
Kaasaegse laboridiagnostika kohustuslik komponent on laboratoorsete uuringute kvaliteedisüsteem ja selle toimimise tagamine. Kvaliteedisüsteem hõlmab sisekontrolli laboriuuringute etappidel ja välist kontrolli.
Mikrobioloogiliste uuringute sisemine kvaliteedikontroll on labori poolt läbiviidavate meetmete ja protseduuride kogum, mille eesmärk on ennetada analüüsi koostamise, tegemise ja tulemuste hindamise käigus tekkivate tegurite negatiivset mõju, mis võib mõjutada tulemuse usaldusväärsust.
Sisemine kvaliteedikontroll hõlmab järgmist:
1. Analüüsitingimuste nõuete täitmise jälgimine: (labori ruumid, õhukeskkond, inkubatsiooni ja ladustamise temperatuurirežiimid, desinfitseerimis- ja steriliseerimisrežiimid jne).
2. Protseduuri läbiviimine referentsbakterikultuuride säilitamiseks.
3. Toitekeskkonna kvaliteedikontroll.
4. Katsesüsteemide ja reaktiivide kvaliteedikontroll.
5. Destilleeritud vee kvaliteedikontroll.
Sisemise kvaliteedikontrolli korralduse struktuur, teostatavate protseduuride sagedus ja sagedus on kehtestatud laboris kehtiva kvaliteedijuhtimissüsteemiga vastavalt standarditele GOST ISO / IEC 17025 ja GOST R ISO 15189.
Läbiviidud kontrolliprotseduuride tulemuste dokumenteerimine toimub kehtiva kvaliteedijuhtimissüsteemiga kinnitatud vormide kohaselt. Kontrollitulemuste registreerimine ja säilitamine võib toimuda elektroonilisel andmekandjal.
Sisemise kvaliteedikontrolli kohustuslik osa on perioodiline, kuid vähemalt 1 kord aastas, läbiviidud kontrolliprotseduuride tulemuste analüüs, millega arvestatakse katselabori kvaliteedijuhendi korrigeerimist.
Molekulaargeneetiliste (PCR) uuringute sisemise kvaliteedikontrolli tagamine toimub täiendavalt vastavalt MU 1.3.2569-09 "Nukleiinhapete amplifikatsioonimeetodeid kasutavate laborite töö korraldamine töötamisel I-IV patogeensusrühmade mikroorganisme sisaldava materjaliga."
Väline kvaliteedikontroll viiakse läbi vastavalt standardite GOST ISO / IEC 17025 ja GOST R ISO 15189 nõuetele laboritevahelistes võrdluskatsetes (ICT) ja / või indikaatorite tasemekontrolli programmides osalemise vormis ning teatud ajavahemike järel vastavalt kehtestatud nõuetele. laborite nõuded ja vajadused.
9. Ohutusnõuded
Bioloogilise (kliinilise) materjali uuringud viiakse läbi vastavalt kehtivatele regulatiivsetele juriidilistele ja metoodilistele dokumentidele, mis käsitlevad tööd III-IV ja I-II patogeensusrühmade mikroorganismidega, sõltuvalt väidetava patogeeni tüübist.
Lisa
Alumiste hingamisteede nakkuse etioloogilise põhjustaja (tekitajate) väljaselgitamiseks KAP kahtluse korral uuritakse röga sügava köhimise ajal, steriilse 5% naatriumkloriidi lahuse inhaleerimisel läbi nebulisaatori indutseerimisel saadud röga, röga. mis saadakse hingetorust aspireerimisel, kasutades kirurgilist vaakumit või elektrilist imemist, fibrobronhoskoopiaga saadud bronhoalveolaarset loputust (BAL) ning verd ja pleuravedelikku.
Kui hingamisteede viiruste, mükoplasma ja klamüüdia uurimisel ei ole võimalik materjali saada alumistest hingamisteedest, on lubatud kasutada ülemiste hingamisteede määrdeid (alumisest ninakäigust ja neelu tagumisest seinast), mis on võetakse patsiendilt võimalikult varakult alates ägedate hingamisteede infektsioonide sümptomite ilmnemisest ühes katseklaasis ja testitakse ühe proovina.
Haiglaravi saavatel patsientidel tuleb uurimismaterjal koguda võimalikult varakult pärast vastuvõtmist (hiljemalt teisel päeval), kuna hilisemal kuupäeval ei ole välistatud superinfektsiooni võimalus kokkupuutel teiste patsientidega. Bioloogilise materjali kogumine bakterioloogiliseks uuringuks tuleks läbi viia enne antibiootikumide määramist.
Surma korral uuritakse surmajärgset (lahkamist) materjali.
Bakterioloogiliste ja PCR-uuringute jaoks vabalt eraldatud röga saamise reeglid
Röga kogumiseks tuleks kasutada steriilseid hermeetiliselt suletud plastmahuteid. Enne röga kogumist paluge patsiendil loputada suud põhjalikult keedetud veega. Röga kogumine toimub tühja kõhuga või mitte varem kui 2 tundi pärast sööki.
Patsiendil palutakse mitu korda sügavalt sisse hingata, hoides hinge kinni paar sekundit, seejärel jõuga välja hingata, mis aitab kaasa produktiivse köha ilmnemisele ja röga eemaldamisele ülemistest hingamisteedest. Seejärel palutakse patsiendil korralikult köhida ja koguda alumiste hingamisteede eritis (mitte sülg!) steriilsesse anumasse. Rögaproovi maht peaks olema vähemalt 3 ml täiskasvanutel ja umbes 1 ml lastel.
Hoida külmkapis temperatuuril 4-8°C. Röga säilitamise kestus toatemperatuuril ei tohiks ületada 2 tundi.
Sest PCR uuringud rögaproovi on lubatud hoida 1 päev temperatuuril 2 kuni 8 ° C, kauem - temperatuuril mitte üle -16 ° C.
Bakterioloogiliseks uuringuks venoosse vere võtmise reeglid
Vere kogumiseks bakterioloogiliseks uuringuks kasutatakse kaubanduslikke hermeetiliselt suletud klaasviaale või kahte tüüpi löögikindlast autoklaavitavast plastikust viaale (sisaldab toitainekeskkonda aeroobide ja anaeroobide isoleerimiseks). Veri võetakse süstlaga, veri kantakse aseptiliselt otse läbi kummikorgi transpordivahendiga viaali.
Erinevatest perifeersetest veenidest, nagu vasak ja parem kubitaalveen, võetakse 20–30-minutilise intervalliga kaks veenivere proovi. Üks proov asetatakse viaali aeroobseks isoleerimiseks, teine anaeroobseks isoleerimiseks. Vere maht iga veenipunktsiooni korral peab olema vähemalt 10 ml täiskasvanutel ja 3 ml lastel.
Vahetult enne veenipunktsiooni desinfitseeritakse veenipunktsioonikoha nahk ringjate liigutustega keskelt perifeeriasse kaks korda 70% alkoholilahuse või 1-2% joodilahusega. On vaja oodata, kuni desinfitseerimisvahend täielikult kuivab, ja teha manipuleerimine naha töötlemiskohta puudutamata.
Pärast veenipunktsiooni tuleb järelejäänud jood eemaldada naha pinnalt, et vältida põletusi.
Kuni transpordini alates bakterioloogiliste uuringute eesmärk proovi koos suunaga hoitakse toatemperatuuril (mitte rohkem kui 2 tundi) või termostaadis.
PCR-uuringute jaoks venoosse vere võtmise reeglid
Vereproovid tuleb võtta tühja kõhuga või 3 tundi pärast sööki kubitaalveenist istuvas asendis. Vereproovid võetakse antikoagulandiga (EDTA) katseklaasides.
Vahetult enne veenipunktsiooni desinfitseeritakse veenipunktsioonikoha nahk ringjate liigutustega keskelt perifeeriasse kaks korda 70% alkoholilahuse või 1-2% joodilahusega. On vaja oodata, kuni desinfitseerimisvahend täielikult kuivab, ja teha manipuleerimine naha töötlemiskohta puudutamata. Pärast veenipunktsiooni tuleb järelejäänud jood eemaldada naha pinnalt, et vältida põletusi.
Pärast verevõtmist tuleb sond mitu korda õrnalt tagurpidi pöörata, et veri tuubis põhjalikult seguneks. Asetage katseklaas statiivile.
Kuni transpordini laborisse PCR-uuringute eesmärgil proovi koos saatekirjaga säilitatakse temperatuuril 20 - 25 °C 6 tundi alates materjali kättesaamise hetkest - nukleiinhapete kvantitatiivseks määramiseks ja 12 tundi - nukleiinhapete kvalitatiivseks määramiseks; temperatuuril 2–8 ° C - mitte rohkem kui üks päev nakkuslike objektide DNA / RNA kvalitatiivseks ja kvantitatiivseks määramiseks. Täisvereproovide külmutamine ei ole vastuvõetav.
Bakterioloogiliste ja PCR-uuringute jaoks pleuravedeliku saamise reeglid
Võtke materjal ühekordselt kasutatavatesse, tihedalt keeratud katseklaasidesse mahuga 10–15 ml.
Enne manipuleerimist nahk desinfitseeritakse 70% etüülalkoholiga, seejärel 1-2% joodilahusega, liigne jood eemaldatakse 70% alkoholiga niisutatud marlilapiga, et vältida patsiendi naha põletamist. Pärast seda tehakse perkutaanne aspiratsioon pleura vedeliku proovi saamiseks, järgides hoolikalt aseptika reegleid. Proovi maht peab olema vähemalt 5 ml. Kõik õhumullid eemaldatakse süstlast, misjärel proov viiakse kohe steriilsesse plastmahutisse. Mahuti on tihedalt kaanega suletud.
Kuni transpordi hetkeni proov koos suunaga bakterioloogiliseks uuringuks hoida külmkapis temperatuuril 4-8 °C. Pleuravedeliku säilitamise kestus toatemperatuuril ei tohiks ületada 2 tundi.
Sest PCR uuringud proovi on lubatud säilitada 1 päev temperatuuril 2 kuni 8 °C, kauem - temperatuuril mitte üle -16 °C.
Bronhoskoopiat tehakse hapnikravi tingimustes (hapniku sissehingamine läbi nasaalsete kateetrite, kasutades Venturi maski või reservuaariga maski). Kui piisavat vere hapnikuga varustamist ei ole võimalik saavutada, tehakse bronhoskoopia mitteinvasiivse ventilatsiooniga. Mehaanilise ventilatsiooniga patsientidel tehakse protseduur üldnarkoosis müopleegia tingimustes läbi bronhoskoopventiiliga varustatud respiraatoriadapteri. Bronhoalveolaarne loputus viiakse läbi vastavalt aktsepteeritud reeglitele. Fibrobronhoskoop viiakse bronhi, kuni see kinnitub, seejärel süstitakse ühekordselt kasutatavate süstalde abil 0,9% naatriumkloriidi lahust, mis on kuumutatud temperatuurini 37 ° C, 8 portsjonit 20 ml (150–160 ml). Alveoolide kokkuvarisemise vältimiseks toimub imemine 50–80 mm Hg juures. Art. See protseduur võimaldab teil saada vajaliku arvu alveolaarseid makrofaage, milles CAP-i põhjustaja paljuneb.
Elus kopsukude saadud transbronhiaalse biopsia abil bronhoskoobi abil, mis võimaldab tuvastada pneumotsüste 66–98%, kuid see materjaliproovi võtmise meetod ei ole näidustatud kõigile patsientidele. Uurimismaterjali saamine on võimalik ka avatud kopsubiopsiaga või kopsunõelaga perkutaanse intratorakaalse aspiratsiooni abil patsientidel, kellel on haiguse progresseeruva kuluga transbronhiaalne biopsia vastunäidustatud. Avatud kopsubiopsia meetod annab parimad (100%) tulemused ja võrdsustatakse tulemusega kirurgilise sekkumisega, samas on uuringuks piisavalt suure materjali saamine ja valenegatiivne tulemus täiesti välistatud.
Praegu on kliinikud asunud aktiivselt uurima bronhoalveolaarne loputus tsüstide ja trofosoitide tuvastamiseks.
Postuumne materjal kogutakse esimese päeva jooksul pärast patsiendi surma, valmistatakse määrded, jäljendid kopsust või määrded alveoolide vahusest sisust.
PCR-uuringute jaoks hingetoru aspiraadi võtmise reeglid
Manipuleerimine toimub tühja kõhuga pärast hammaste harjamist ja suu loputamist veega. Patsiendil palutakse mitu korda sügavalt sisse hingata, paar sekundit hinge kinni hoida, seejärel jõuliselt välja hingata. See aitab kaasa produktiivse köha ilmnemisele ja ülemiste hingamisteede puhastamisele rögast. Pärast limaekstraktori kinnitamist toru-adapteri kaudu imemistoru külge sisestati hingetoru aspiraadi kogumiseks mõeldud kateeter suuõõne kaudu neelu. Limaskesta ärrituse tõttu häälekesta piirkonnas kutsutakse esile köharefleks ja hingetoru sisu ekstraheeritakse imemise teel läbi steriilse kateetri (6. või 7. suurus). Hingetoru aspiraadi maht peab olema vähemalt 3-5 ml.
Bakterioloogiliste ja PCR-uuringute jaoks indutseeritud röga saamise reeglid
Enne protseduuri saavad patsiendid mõõdetud annusega inhalaatori kaudu salbutamooli (lapsed - 200 mikrogrammi), et vältida bronhospasmi. Seejärel juhitakse 15 minuti jooksul hapnikku läbi joapihusti (aerosoolseade) kiirusega 5 l / min 5 ml 5% steriilse NaCl lahusega. Seejärel koputatakse rindkere eesmist ja tagumist seina, et stimuleerida röga väljutamist.
Seejärel palutakse patsiendil korralikult köhida ja koguda alumiste hingamisteede eritis (mitte sülg!) steriilsesse anumasse. Rögaproovi maht peaks olema vähemalt 3 ml täiskasvanutel ja umbes 1 ml lastel.
Kui röga välja ei köhita, on soovitatav protseduur kombineerida järgneva hingetoru aspiratsiooniga, et aspireerida hingetoru sisu standardse imemise teel, kasutades steriilset 6 või 7 kateetrit.
Kuni transpordi hetkeni proov koos suunaga bakterioloogiliseks uuringuks hoida külmkapis temperatuuril 4-8 °C. Röga säilitamise kestus toatemperatuuril ei tohiks ületada 2 tundi.
Sest PCR uuringud Säilitamine on lubatud 1 päev temperatuuril 2 kuni 8 °C, kauem - temperatuuril mitte üle -16 °C.
Reeglid PCR-uuringute jaoks ülemistest hingamisteedest määrdumise võtmise reeglid
Materjal võetakse pärast suu loputamist toatemperatuuril keedetud veega. Kui ninaõõs on täidetud limaga, on soovitatav enne protseduuri nina puhuda. 6 tunni jooksul enne protseduuri ei saa te kasutada ninaneelu või orofarünksi niisutavaid ravimeid ega suus resorptsiooni ravimeid.
Patsiendilt võetakse määrded kahe erineva sondiga, esmalt alumise ninakäigu limaskestalt ja seejärel orofarünksist, kusjuures tampoonidega sondide otsad asetatakse pärast määrde võtmist järjestikku ühte katsutisse mahuga 1,5-2,0 ml koos 0,5 ml transpordisöötmega.
Lastel ninaneelu limaskesta määrded võtke plastikaplikaatorile kuiv steriilne ninaneelu veluurtampoon. Sond sisestatakse kerge liigutusega piki nina välisseina 2-3 cm sügavusele alumisse karpkotti, langetatakse veidi alla, sisestatakse alumisse ninakäiku alumise ninakarbi alla, tehakse pöördliigutus ja eemaldatakse piki nina välisseina. Sondi sisestamise kogusügavus peaks olema ligikaudu pool ninasõõrme ja kõrvaava vahelisest kaugusest (lastel 3–4 cm ja täiskasvanutel 5–6 cm). Pärast materjali võtmist lastakse sondi ots tampooniga steriilsesse ühekordselt kasutatavasse tuubi koos transpordivahendiga kuni purunemispunktini, samal ajal kui sondi painduv osa keeratakse kokku, seejärel kattes sondi ülaosa kaanega, lastakse sondi käepide alla, saavutades sondi ülemise osa täieliku purunemise. Toru on hermeetiliselt suletud.
Nasofarüngeaalsed tampoonid täiskasvanutel seda on lubatud võtta ka polüstüreenist valmistatud kuiva steriilse sondiga viskoosist tampooniga. Sond sisestatakse kerge liigutusega piki nina välisseina 2-3 cm sügavusele alumisse karpkotti, langetatakse veidi alla, sisestatakse alumisse ninakäiku alumise ninakarbi alla, tehakse pöördliigutus ja eemaldatakse piki nina välisseina. Sondi sisestamise kogusügavus peaks olema ligikaudu pool ninasõõrme ja kõrvaava kaugusest (täiskasvanutel 5 cm). Pärast materjali võtmist langetatakse sondi ots tampooniga 1 cm sügavusele transpordivahendiga steriilsesse ühekordselt kasutatavasse katsutisse ja murtakse ära, hoides toru korki. Toru on hermeetiliselt suletud.
Tampoonid orofarünksist võtke mandlite, palatiinsete võlvide ja orofarünksi tagumise seina pinnalt kuiv steriilne polüstüreensond viskoosist tampooniga pöörlevate liigutustega, vajutades õrnalt spaatliga patsiendi keelt. Pärast materjali võtmist asetatakse sondi tööosa tampooniga steriilsesse ühekordselt kasutatavasse tuubi koos transpordivahendiga ja ninaneelust võetud tampooniga sond. Tampooniga (1 cm) sondi ots murtakse ära, hoides katseklaasi kaant nii, et see võimaldab katseklaasi tihedalt sulgeda. Säilitada on lubatud kolm päeva temperatuuril 2 - 8 °C, kauem - temperatuuril mitte üle -16 °C.
Seroloogilise diagnostika materjali saamise reeglid
(Spetsiifiliste antikehade tuvastamine)
Seroloogiliseks testimiseks (antikehade määramiseks) on vaja kahte vereseerumi proovi, 1. proov võetakse esmase diagnoosimise päeval, 2. proov - 2-3 nädalat pärast esimest. Veri võetakse veenist mahuga 3-4 ml või keskmise sõrme kolmandast falangist mahus 0,5-1,0 ml ühekordselt kasutatavasse plasttorusse ilma antikoagulandita. Vereproovid jäetakse 30 minutiks toatemperatuurile või asetatakse 15 minutiks 37 °C termostaadi. Pärast tsentrifuugimist (10 minutit kiirusel 3000 pööret minutis) viiakse seerum steriilsetesse katsutitesse, kasutades iga proovi jaoks eraldi aerosoolibarjääriga otsa. Täisvere säilivusaeg - mitte rohkem kui 6 tundi, külmutamine on vastuvõetamatu. Vereseerumi kõlblikkusaeg toatemperatuuril - 6 tundi, temperatuuril 2–8 ° C - 5 päeva, kauem - temperatuuril mitte üle -16 ° C (mitmekordne külmutamine / sulatamine on vastuvõetamatu) .
PCR-uuringute jaoks lahangumaterjali saamise reeglid
Surmajärgne materjal kogutakse esimese päeva jooksul pärast patsiendi surma steriilse individuaalse instrumendiga (iga elundi kohta eraldi) kahjustatud koe piirkonnast mahuga 1-3 cm 3, mis asetatakse ühekordselt kasutatavasse steriilsesse kaussi. hermeetiliselt keeratava kaanega plastmahutid, mis on külmutatud ja säilitatud temperatuuril mitte üle -16 °C.
Uriini võtmise ja transportimise reeglid legionella või pneumokoki antigeeni määramiseks
Uurimiseks mõeldud uriiniproovid mahuga 5–10 ml asetatakse tavalistesse plastmahutitesse ja hoitakse enne reaktsiooni seadistamist toatemperatuuril (15–30 °C) mitte kauem kui 24 tundi pärast proovi võtmist. Vajadusel võib proove säilitada 2-8°C juures kuni 14 päeva või -20°C juures pikemat aega esmaseks või kordusuuringuks. Boorhapet võib kasutada säilitusainena. Enne reaktsiooni seadistamist uuritakse jahutatud või külmutatud uriiniproove antigeeni olemasolu suhtes pärast toatemperatuurini jõudmist.
Materjali märgistamise nõuded laboratoorseks testimiseks
Katseklaaside (konteinerite) etiketil materjaliga on märgitud: uuritava perekonna- ja eesnimi, materjali võtmise kuupäev, materjali liik.
Laboris uurimistööks kogutud materjali saatedokumendis (saatekirjas) tuleb märkida:
Materjali uurimistööks saatva asutuse nimi ja telefoninumber;
Uuritava patsiendi perekonnanimi ja nimi;
Vanus;
Haigestumise või patsiendiga kokkupuute kuupäev;
Kavandatav diagnoos, haiguse tõsidus või läbivaatuse põhjus;
Haiguse raskusaste;
Andmed gripivastase vaktsineerimise kohta käimasoleval epideemiahooajal (vaktsineeritud / vaktsineerimata / pole saadaval);
Kuupäev ja meditsiinilise isiku allkiri.
Materjali transport toodetud termokonteinerites soovitatud säilitustemperatuuril. Igalt patsiendilt võetud proovid pakitakse täiendavalt eraldi suletud kotti imava materjaliga.
Bioloogilise materjali töötlemine enne laboratoorset testimist
Laboris on enne viskoosse konsistentsiga bioloogilise materjali (röga, hingetorust aspiratsiooni) PCR-uuringute alustamist vaja seda viskoossuse vähendamiseks eeltöödelda, näiteks kasutades sellist ravimit nagu mukolüsiin, vastavalt juhistele. Lahkamise materjal homogeniseeritakse, millele järgneb puhverlahuse (füsioloogiline naatriumkloriidi lahus või fosfaatpuhver) abil 20% suspensiooni valmistamine.
Bibliograafia
1. Kogukonnas omandatud kopsupõletik täiskasvanutel: praktilised soovitused diagnoosimiseks, raviks ja ennetamiseks: juhend arstidele / A.G. Tšuchalin, A.I. Sinopalnikov jt. M., 2010. 106 lk.
2. Kopsupõletik /A.G. Tšuchalin, A.I. Sinopalnikov, L.S. Strachunsky. M., 2006.
3. Raskekujulise tüsistustega kopsupõletiku eriarstiabi standard: Venemaa tervishoiuministeeriumi 29. jaanuari 2013 korralduse nr 741n lisa.
4. Kozlov R.S. Pneumokokid: õppetunnid minevikust – pilk tulevikku. Smolensk, 2010.
5. SP 3.1.2.2626-10 "Legionelloosi ennetamine".
6. SP 3.1.7.2811-10 "Koksielloosi (Q-palaviku) ennetamine".
7. SP 3.1.7.2642-10 "Tulareemia ennetamine".
8. SP 3.1.7.2815-10 "Ornitoosi ennetamine".
10. MU 3.1.2.3047-13 "Kogukonnas omandatud kopsupõletiku epidemioloogiline seire".
11. MU 4.2.2039-05 "Tehnoloogia biomaterjalide kogumiseks ja transportimiseks mikrobioloogilistesse laboritesse" (kinnitatud Vene Föderatsiooni riikliku peasanitaararsti poolt 23. detsembril 2005).
12. Vene Föderatsiooni tervishoiuministeeriumi juhised nr 99/168 "Tuberkuloosihaigete avastamise korraldamine kiiritus-, kliiniliste ja mikrobioloogiliste meetodite abil". 2000.
13. MU 1.3.2569-09 "Nukleiinhapete amplifikatsioonimeetodeid kasutavate laborite töö korraldamine I-IV patogeensusrühma mikroorganisme sisaldava materjaliga töötamisel."
14. MU 2.1.4.1057-01 "Vee sanitaar- ja mikrobioloogiliste uuringute sisemise kvaliteedikontrolli korraldamine".
15. MP nr 01/14633-8-34 “Bakterite antigeeni tuvastamine Legionella pneumophila serorühm 1 kliinilises materjalis immunokromatograafilisel meetodil” (kinnitatud Vene Föderatsiooni riikliku peasanitaararsti poolt 9. detsembril 2008).
16. MUK 4.2.1890-04 "Mikroorganismide tundlikkuse määramine antibakteriaalsete ravimite suhtes" (kinnitatud Vene Föderatsiooni riikliku sanitaarpeaarsti poolt 4.03.2004).
Kopsupõletikku nimetatakse kopsupõletikuks. See on äge nakkushaigus, millel võib olla erinev olemus: bakteriaalne, viiruslik, seenhaigus, aspiratsioon. Kõige sagedasem haiguse põhjustaja on pneumokoki bakter.
Kopsupõletiku peamine sümptom on lämbumine kõrge kehatemperatuuri taustal. Sissehingamisel tunneb inimene valu rinnus, köhib koos mädase rögaeritusega, higistab, väriseb. Eakatel, voodihaigetel, kui kahjustatud on väike osa kopsudest, võib kliiniline pilt kustuda.
Diagnoosi tegemiseks peate konsulteerima üldarsti (lastearsti) või pulmonoloogiga. Kopsupõletiku diagnoosimine hõlmab rindkere röntgeni, rögauuringut, vereanalüüsi. Haiglaeelsel perioodil kogutakse kaebusi ja tehakse auskultatsioon - kopsude kuulamine fonendoskoobiga müra ja vilistava hingamise määramiseks.
Millised on kopsupõletiku sümptomid?
Kõige esimene põhjus kopsupõletikku kahtlustada on haigusele iseloomulik kliiniline pilt. Pneumooniat saab ära tunda järgmiste sümptomite järgi:
- külmavärinad ja suurenenud higistamine;
- palavik, kehatemperatuur 38-40 kraadi;
- lämbuv köha;
- hingamisraskused, eriti sissehingamine;
- valu rinnus;
- kollase, rohelise, roosa, punakaspruuni röga väljaköhimine;
- huulte, küünte, sõrmede blanšeerimine - hapnikunälja sümptom;
- hingeldus;
- keha valutab;
- väsimus, isutus.
Tähelepanu! Kopsupõletikku saab ravida, kui lähete õigeaegselt haiglasse. Kopsupõletiku sümptomite leidmisel peaksite helistama kodus arstile või kutsuma kiirabi. Haigus areneb kiiresti. Statistika kohaselt on enam kui 50% kopsupõletikust põhjustatud surmajuhtumitest need, kes ise ravisid või ei suutnud haigust õigel ajal ära tunda. Sageli määrab "kopsupõletiku" diagnoosi kohtuekspert.

Pilt haigusest täiskasvanutel, eakatel ja lastel
Kopsupõletiku ilmingud võivad olla ebatüüpilised. Mõnikord on haigus peaaegu asümptomaatiline, ilma kõrge palavikuta ja kurnava köhata. Siiski on alati olemas 3 märki:
- motiveerimata nõrkus, unisus;
- kerge palavik - temperatuur 37-37,5;
- tugev higistamine une ajal.
Latentne põletikuline protsess on tüüpiline nõrgenenud immuunsüsteemiga inimestele, voodihaigetele, vastsündinutele ja üle 65-aastastele eakatele. Ka eakas inimene võib kurta segaduse üle. Keskmiselt põevad alla 5-aastased lapsed ja eakad kopsupõletikku 2-3 korda sagedamini kui hiilgeajal täiskasvanud. Nende jaoks on haiguse diagnoosimine keerulisem.
Diagnostika
Kõige sagedamini eelneb kopsupõletikule ülemiste hingamisteede haigus - ägedad hingamisteede infektsioonid, külmetushaigused, gripp, trahheiit jt. Üks haigus voolab sujuvalt teise ja isegi arstil ei õnnestu seda hetke alati "püüda". Seetõttu on oluline pöörduda tagasi konsultatsioonile, kui külmetuse ravi ei aita ja paranemist ei toimu. Kopsupõletiku diagnoosimiseks tehke peamiselt järgmisi tegevusi.
1. Anamneesi kogumine. Patsiendilt küsitakse kaebusi, haiguse kestust, kaasuvate haiguste esinemist, võetud ravi. Arst esitab rea küsimusi. „Kas hakkate puhkades sageli hingama või lämbuma? Millal köha esimest korda ilmnes ja kuidas on see aja jooksul muutunud? Kas köhite välja kollast, roosat või rohelist röga? Kas tunnete sisse- või väljahingamisel valu rindkere piirkonnas või mitte?

2. Kopsude kuulamine. Järgmine samm on auskultatsioon. Arst palub paljastada ülakeha ja hingata korralikult, sügavalt. Stetoskoobi abil kuulab ta, kuidas kopsud avanevad ja millist häält see teeb. Kopsupõletiku kahtluse korral kuulatakse eriti hoolikalt, alati ees ja taga. Arst saab koputada selga, ajastada stopperiga sisse- ja väljahingamist. Kopsupõletikku näitab pindmine bronhide hingamine ja kahjustatud poole mahajäämus. Lisaks on selgelt kuulda väikesed mullitavad ragin, müra ja kõrist. Koputamine võimaldab umbkaudselt määrata kahjustatud ala - otse selle kohal on kaja lühike, kurt.
3. Diagnostiline uuring. Diagnoosi kinnitamiseks ja kopsupõletiku põhjuse väljaselgitamiseks määrab arst rea katseid. Kopsupõletiku avastamine võib hõlmata erinevaid teste.
Põhimeetodid
Kõige kättesaadavam ja usaldusväärsem viis kopsupõletiku diagnoosimiseks on rindkere röntgeni või fluorograafia tegemine, kui patsient on vanem kui 15 aastat. Pilt võimaldab näha põletikukoldeid, mida nimetatakse "blackoutiks". Tegelikult on need valged laigud, sest pilt on negatiivne. Diagnoos viiakse läbi koos laboratoorsete ja instrumentaalsete uuringutega, mis võimaldab eristada kopsupõletikku sümptomitega sarnastest haigustest. Diagnoosimiseks vajalike testide standardkomplekt sisaldab:
- rindkere röntgenuuring (fluorograafia);
- röga laboratoorne analüüs;
- üldine vereanalüüs.
Kopsupõletikku näitab pildil olev fookuskaugus. Samal ajal täheldatakse ka veresoonte-kopsu mustri deformatsiooni ja tugevnemist. Laigud võivad olla erineva läbimõõduga: kuni 3 mm loetakse väikeseks, 4-7 mm - keskmiseks, 8-12 - suureks. Kui lapsel on kopsupõletik, on kaasatud alumised lõigud ja tumenemise suurus on 1-2 mm.
Kopsupõletikuga verel on järgmised kõrvalekalded normist: leukotsüütide, ESR, neutrofiilide arv suureneb, täheldatakse leukotsüütide valemi nihkumist vasakule. Röga on olemuselt põletikuline – selles tekivad leukotsüüdid. Sekretsioonides leidub Kurshmani spiraale, epiteelirakke, vereelemente, Charcot-Leideni kristalle, alveolaarseid makrofaage. Röga külv toitesöötmel võimaldab tuvastada patogeeni ja valida raviks sobiva antibiootikumi.
Tähelepanu! Kopsupõletiku korral tehakse röntgenikiirgus vähemalt kaks korda: haiglasse lubamisel ja väljakirjutamisel.

Täiendavad meetodid
Kui kahtlustatakse kopsupõletiku tüsistusi (abstsess, kopsuturse, pleuriit, obstruktsioon ja teised), määratakse täiendavad testid ja uuringud. Lisaks on need vajalikud, kui peate läbi viima diferentsiaalanalüüsi. Kopsupõletikul on sarnased kliinilised ilmingud paljude teiste hingamisteede haigustega. Oluline on välistada tuberkuloos ja vähkkasvajad.
1. CT, MRI (kompuutertomograafia, magnetresonantstomograafia). Mõlemad uuringud annavad kopsudest ja teistest elunditest kolmemõõtmelise pildi. See võimaldab tuvastada mitmesuguseid tüsistusi, neoplasme, võõrkehi. CT kasutab röntgenikiirgust, mis on tuberkuloosi diferentsiaaldiagnostikas tõhusam. MRT-ga on skaneerimine elektromagnetiline ja see näitab paremini pehmete kudede, veresoonte ja liigeste seisundit. Seda saab määrata kopsupõletiku ja kasvaja eristamiseks.
2. Bronhoskoopia. Endoskoopiline uurimismeetod, mis võimaldab teil välja selgitada kasvajate, põletike, võõrkehade esinemise bronhopulmonaarses süsteemis.
3. Röga määrde mikroskoopia. Ebatüüpilise patogeeni või tuberkuloosi kahtluse korral värvitakse Ziehl-Neelseni järgi määrded. Pneumokokkide, streptokokkide, stafülokokkide eristamiseks viiakse värvimine läbi Grami järgi.
4. Vere biokeemiline analüüs, südame ultraheliuuring. Need on ette nähtud teiste elundite tüsistuste välistamiseks.
Kokkuvõtteks võib öelda, et "kopsupõletiku" diagnoos peaks põhinema röntgeni- ja labori-instrumentaalsete uuringute tulemustel.
Oluline on välja selgitada haiguse etioloogia. Kopsupõletik on pneumokokk-, streptokokk-, stafülokokk-, viirus-, aspiratsiooni- (enamasti võõrkehade allaneelamisel laste poolt, satub okse hingamisteedesse).
Diagnoos võimaldab tuvastada ka kopsukahjustuse astet ja olemust: fokaalne, krupoosne, lobar, segmentaalne kopsupõletik. Ravi määratakse sõltuvalt põletiku tüübist. Patsient vajab sageli haiglaravi. Selle diagnoosi antibiootikume manustatakse intravenoosselt või intramuskulaarselt. Kodune raviskeem on võimalik, kui diagnoositakse põletiku esialgne staadium ja inimene võtab täieliku vastutuse tervise eest.