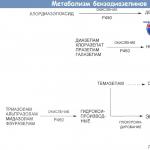
Peamine naftakeemia sünteesi süsivesinike lähteaine on gaasiliste, vedelate ja tahkete süsivesinike segud.
maagaasid koosnevad peamiselt metaanist ja muudest küllastunud süsivesinikest; need sisaldavad ka inertgaase (lämmastik, süsinikdioksiid) ja haruldasi gaase (argoon, ksenoon). Maagaasid tekivad gaasi- ja kondensaadiväljade arendamise käigus.
Seotud naftagaasid saadakse nafta ekstraheerimise kõrvalsaadusena. Need gaasid lahustuvad reservuaariõlis ja vabanevad selle tootmise käigus rõhu vähendamise tõttu. Seotud naftagaas koosneb küllastunud süsivesinikest metaanist pentaanideni ja sisaldab tavaliselt mõningaid inertgaase; Mõne väljaga seotud gaasid sisaldavad ka vaba vesiniksulfiidi. Seotud naftagaasid sisaldavad reeglina märkimisväärses koguses süsivesinikkomponente – etaani, propaani ja butaane, mis on naftakeemia jaoks väärtuslikud toorained.
Rafineerimistehaste gaasidmoodustub krakkimise, koksimise, reformimise protsessides; neid võetakse ka õli stabiliseerimise ja otsedestilleerimise tehastest. Sõltuvalt nende protsesside olemusest on tekkivate gaaside koostis väga erinev. Näiteks katalüütilise reformimise gaasid sisaldavad kuni 60% vesinikku; ülejäänu on küllastunud süsivesinikud. Krakkimis- ja koksimisegaasid koosnevad küllastunud ja küllastumata süsivesinikest.
Nafta stabiliseerivad gaasidiseloomustab kõrge propaani, butaani, pentaani ja isopentaani sisaldus, mistõttu on need väärtuslikud toorained butadieeni ja isopreeni tootmiseks.
Bensiinid keema ära vahemikus 30-120 0 С; need sisaldavad butaani, pentaani, isopentaani, samuti normaalse struktuuriga ja isostruktuuriga C 6 ja C 7 süsivesinikke.
Gaasi kondensaadidkeema ära vahemikus 40-360 0 C. Need sisaldavad 15-30% aromaatsed süsivesinikud; 25-40% nafteene ja 20-60% parafiine (olenevalt valdkonnast).
Vedelad destillaadid ja naftasaadused, mis tekivad erinevate naftatöötlemisprotsesside käigus, kasutatakse ka naftakeemiaprotsesside lähteainena, täpsemalt teatud süsivesinike rühmade eraldamise allikana. Seega eraldatakse aromaatsed süsivesinikud katalüütilise reformimise saadustest, olefiinid termilise ja katalüütilise krakkimise produktidest ning parafiinid diislikütuse vahaeemaldustoodetest.
Süsivesinike toorainest eraldatud süsivesinikel on suur praktiline tähtsus. Näiteks kasutatakse maagaasi metaani kütusena ja toorainena vesiniku, atsetüleeni, ammoniaagi ja metanooli tootmiseks. Etaan on etüleeni tootmise pürolüüsiprotsesside lähteaine; gaasikondensaadid - tooraine butadieeni, isopreeni, aromaatsete süsivesinike tootmiseks.
v Nõuded süsivesinike lähteainele
Naftakeemiaprotsesside süsivesinike lähteainetele kehtivad tavaliselt palju rangemad nõuded kui nafta rafineerimisprotsesside lähteainetele.
Naftakeemia sünteesis kasutatavad reaktsioonid on enamasti katalüütiline või radikaalne ahel ning vajalike saaduste saamiseks on vajalik katalüsaatori kõrge selektiivsus, kõrvalreaktsioonid on täiesti vastuvõetamatud jne. Seetõttu on vajalik tooraine kõrge puhtusaste. Seega on etüülalkoholi tootmiseks etüleeni otsese hüdraatimisega vaja 97–98% etüleeni, mis on praktiliselt vaba vesiniksulfiidist (kuni 0,002% H2S). HDPE tootmiseks on vaja 99,99% etüleeni, mis on täielikult atsetüleenivaba.
Etüleeni põhjalik puhastamine vesiniksulfiidist etüülalkoholi tootmisel on vajalik, kuna destilleerimisseade saadud alkoholi reaktsioonisegust eraldamiseks korrodeerub kiiresti ja läheb rikki. Samal põhjusel ei tohiks etüleen sisaldada atsetüleeni.
Vedelate ja tahkete parafiinide oksüdeerimisel alkoholideks ja hapeteks on vajalik, et lähteaine sisaldaks minimaalses koguses (kuni 0,5%) nafteenseid ja aromaatseid süsivesinikke, mis pärsivad oksüdatsiooni. Mitte vähem oluline pole oksüdatsiooniahelat lõpetavate fenoolide, lämmastiku- ja väävliühendite puudumine. Sellega seoses on aromaatsete süsivesinike väävlisisalduse nõuded ranged (mitte üle 0,02%) ja selle lubatud sisaldus väheneb pidevalt.
Mõnel juhul on vaja süsivesinike lähteainet puhastada sama keemilise olemusega isomeeridest ja homoloogidest. Seega, kui parafiinid sisaldavad isostruktuuriga süsivesinikke, sisaldavad järgneva oksüdatsiooni saadused suuremas koguses madala molekulmassiga happeid, aga ka äärmiselt ebameeldiva lõhnaga isohappeid.
Dieenide segunemine olefiinides põhjustab isomerisatsiooni ja alküülimise käigus vaigu moodustumist.
Süsivesinike toorainete puhul tuleks kehtestada piirangud süsinikoksiidide, ammoniaagi ja niiskuse sisaldusele.
Kõik eelnev viitab süsivesinike tooraine hoolika ettevalmistamise vajadusele.
v Süsivesinike tooraine eeltöötlemise tähtsus
Süsivesinike toorained peavad vastama kõrgetele nõuetele, mis on määratud süsivesinike edasise keemilise muundamise spetsiifikast. Üks peamisi nõudeid süsivesinike lähteainele on teistsuguse keemilise olemusega ainete minimaalne sisaldus või täielik puudumine. Protsessiseadmete korrosiooni vältimiseks on vajalik süsivesinike tooraine hoolikas ettevalmistamine töötlemiseks; katalüsaatorite pikem kasutusiga; välistati torustike ummistumine ja nende läbilaskevõime; kõrvalsaaduste hulk vähenes, sihttoote saagikus tõusis ja selle kvaliteet paranes.
Sissejuhatus
Naftakeemia süntees on keemiatoodete sünteetiline tootmine nafta ja süsivesinikgaaside baasil. Nafta süsivesinikud ja looduslikud põlevgaasid, naftagaasid ja nafta rafineerimisgaasid on peamise toorainena olulisemate masssünteetiliste toodete tootmisel: plastid, kummid ja kiud, lämmastikväetised, pindaktiivsed ained ja pesuained, plastifikaatorid; kütused, määrdeõlid ja nende lisandid, lahustid, ekstrahendid jne Kõiki neid tooteid kasutatakse laialdaselt erinevates nar. x-va ja igapäevaelus on MH areng nendega seotud. uued tehnoloogiavaldkonnad (kosmonautika, tuumaenergia jne). Tööstusriikides on naftakeemia süntees loonud suure ja kiiresti kasvava naftakeemiatööstuse. Nafta ja gaaside süsivesinikud, olles väärikad, tehnoloogiliselt arenenumad ja odavamad toorained, tõrjuvad välja muud tüüpi toorained (süsi, põlevkivi, taimsed, loomsed toorained jne) peaaegu kõigis orgaanilise sünteesi protsessides. Naftakeemia süntees põhineb orgaanilise keemia edul, katalüüsil, füüsikalisel. keemia, keemia. tehnoloogia ja muud teadused ning on seotud õlide koostise ja nende komponentide omaduste põhjaliku uurimisega. Süsivesinike toorainete sihttoodeteks töötlemise protsessid põhinevad arvukatel orgaanilise keemia reaktsioonidel: pürolüüs, oksüdatsioon, alküülimine, dehüdrogeenimine ja hüdrogeenimine, halogeenimine, polümerisatsioon, nitreerimine, sulfoonimine jne; katalüütilised reaktsioonid on nende hulgas kõige olulisemad. toodete valmistamisel. Naftakeemia sünteesil on suur koht süsivesinike toorainete valmistamisel ja esmaste algsete süsivesinike tootmisel: küllastunud (parafiin), küllastumata (olefiin, dieen, atsetüleen), aromaatsed ja nafteensed. Enamik neist muudetakse funktsionaalseteks derivaatideks, mille aktiivsed rühmad sisaldavad hapnikku, lämmastikku, kloori, fluori, väävlit ja muid elemente.
Küllastunud (alkaan) süsivesinikel on nende kasutamisel naftakeemia sünteesis oluline koht.
Peatükk. 1. Üldised ohutusreeglid keemialaboris töötamiseks
1.1. Ohutus
1. Üksi laboris töötamine on rangelt keelatud, kuna õnnetuse korral ei ole kedagi, kes kannatanut aitaks ja õnnetuse tagajärgi likvideerib.
. Laboris töötades tuleb järgida puhtust, vaikust, korda ja ohutusnõudeid, kuna kiirustamine ja hoolimatus põhjustavad sageli raskete tagajärgedega õnnetusi.
. Iga töötaja peaks teadma, kus laboris asuvad tuletõrjevahendid ja esmaabikomplekt, mis sisaldab kõike esmaabiks vajalikku.
. Laboris on rangelt keelatud suitsetada, süüa, juua vett.
. Te ei saa tööd alustada enne, kui õpilased on omandanud kõik selle rakendamise tehnikad.
. Katsed tuleks läbi viia ainult puhastes keemilistes klaasnõudes. Pärast katse lõppu tuleks nõud koheselt pesta.
. Töö käigus tuleb jälgida puhtust ja täpsust, jälgida, et ained ei satuks näo- ja kätenahale, kuna paljud ained põhjustavad naha ja limaskestade ärritust.
. Laboris leiduvaid aineid maitsta ei saa. Aineid saate nuusutada ainult siis, kui suunate aurud või gaasid ettevaatlikult kerge käeliigutusega enda poole, mitte nõjatudes anuma poole ja mitte hingates sügavalt sisse.
. Kõik mahutid, kus reaktiive hoitakse, peavad olema märgistatud ainete nimetusega.
. Ainete või lahustega anumad tuleb võtta ühe käega kaelast ja teise käega altpoolt toetada põhja.
. Orgaaniliste ainete ja nende lahuste suu kaudu pipettidesse imemine on rangelt keelatud.
. Katseklaasides ja kolbides vedelate ja tahkete ainete kuumutamisel ärge suunake nende avasid enda ja naabrite poole. Samuti on võimatu vaadata ülalt lahtiselt kuumutatud anumatesse, et vältida võimalikke kahjustusi kuuma massi väljaviskamisel.
. Peale töö lõpetamist lülita gaas, vesi, elekter välja.
. Valamutesse on rangelt keelatud valada hapete ja leeliste kontsentreeritud lahuseid, samuti erinevaid orgaanilisi lahusteid, tugevalt lõhnavaid ja kergestisüttivaid aineid. Kõik need jäätmed tuleb valada spetsiaalsetesse pudelitesse.
. Igal laboril peavad olema kaitsemaskid ja -prillid.
. Labori igas ruumis peavad olema tuletõrjevahendid: kast sõelutud liivaga ja kulp selle jaoks, tulekustutustekk (asbest või paks vilt), laetud tulekustutid.
. Laboriklassis peaks ligipääsetavas kohas olema “Ohutusnurk”, kuhu on vaja paigutada konkreetsed juhised tööohutusmeetodite ja keemiaruumi käitumisreeglite kohta.
. Laboris töötades on vaja kasutada isikukaitsevahendeid, samuti järgida isikliku hügieeni reegleid.
1.2 Üldsätted tööks naftakeemia sünteesi laboris
Laboris töötavad juhtivatest teaduskeskustest kutsutud teadlased, insenerid ja laborandid. Labori töö põhisuunaks on orgaanilise sünteesi põhiproduktide tootmise tehnoloogiate loomine. Samuti on käimas homogeensete ja heterogeensete katalüütiliste süsteemide väljatöötamine uute ja olemasolevate naftakeemiaprotsesside jaoks.
NHSi labori uurimis- ja arendustöö on pühendatud:
uued polümerisatsioonikatalüsaatorid makromolekulaarsete ühendite tootmiseks;
tööstuslike polümeeride keemiline modifitseerimine;
uute tehnoloogiate arendamine olemasolevate monomeeride saamiseks;
uute paljulubavate monomeeride saamine;
keemiaettevõtete jäätmete kõrvaldamise ja töötlemise meetodite otsimine.
Laboratoorium on varustatud kogu vajaliku tehnikaga määratud ülesannete täitmiseks. Surve all töötamiseks kasutatakse mitmesuguseid kaasaegseid arvutiga juhitavaid reaktoreid. Metallorgaaniliste ühendite ja muude niiskuse ja hapniku suhtes väga tundlike ainetega tehakse tööd kindalaekas. MARS-i keemiline mikrolainesüsteem võimaldab reaktsioone läbi viia temperatuuril kuni 3000C ja rõhul kuni 100atm. Laboratoorium on varustatud maailma juhtivate tootjate üldlabori abiseadmetega.
Töö korraldus laborites
Keemia- ja toiduainetehnoloogia protsesside ja aparatuuri laborid on varustatud pooltööstuslike (piloot)paigaldistega, millel õpilased katseliselt protsesse uurivad. Käitistel saadud katseandmete matemaatiliste meetoditega töötlemine võimaldab analüüsida parameetrite mõju protsessile.
Laborites tehakse laboratoorseid töid järgmistel erialadel: "Keemiatehnoloogia protsessid ja aparaadid", "Toidu tootmise protsessid ja aparaadid", "Üldkeemiatehnoloogia", "Keemilis-tehnoloogiliste protsesside modelleerimine ja arvutiarvutus" jne.
Katseandmete töötlemine ja katse planeerimise meetod
Katse planeerimise põhieesmärk on saavutada maksimaalne mõõtmistäpsus minimaalse katsete arvuga ja tulemuste statistilise usaldusväärsuse säilitamisega. Katse planeerimist kasutatakse optimaalsete tingimuste otsimisel, interpolatsioonivalemite koostamisel, oluliste tegurite valimisel, teoreetiliste mudelite konstantide hindamisel ja täpsustamisel jne. Eksperimentide planeerimine (aktiivne eksperiment) keemias, materjalistatistika osa, mis uurib hulga organiseerimise meetodeid. katsed erinevatel tingimustel, et saada kõige usaldusväärsemat teavet uuritava objekti omaduste kohta kontrollimatute juhuslike häirete korral. Antud katse tingimusi määravaid suurusi nimetatakse tavaliselt teguriteks (näiteks temperatuur, kontsentratsioon), nende kogusummat faktoriruumiks. Faktoriväärtuste kogum iseloomustab teatud punkti faktoriruumis ja kõigi katsete kogusumma moodustab nn faktorikatse. Punktide paiknemine faktoriruumis määrab katse plaani, mis määrab katsete arvu ja tingimused koos nende tulemuste registreerimisega.
Katse kavandamise algatasid P. Fisheri (1935) tööd. Ta näitas, et katse ratsionaalne planeerimine annab hinnangute täpsuses mitte vähem olulist võitu kui mõõtmistulemuste optimaalne töötlemine. Katse planeerimist kasutatakse protsesside ja nähtuste uurimiseks ja matemaatiliseks kirjeldamiseks matemaatiliste mudelite konstrueerimise teel (nn regressioonivõrrandite kujul) - seosed, mis seovad tegurite väärtused ja katse tulemused, kasutades mitmeid parameetreid, nn. . vastuseid. Faktoorkatse plaanide põhinõue, erinevalt passiivsest katsest, on minimeerida katsete arvu, mille käigus saadakse arvutatud parameetrite usaldusväärsed hinnangud, säilitades samal ajal matemaatiliste mudelite vastuvõetava täpsuse antud piirkonnas. teguri ruum. Sel juhul on faktorikatse tulemuste töötlemise ülesanne määrata kindlaks näidatud parameetrite arvväärtused.
Ekstreemprobleemide eesmärk on määrata kindlaks sihtfunktsiooni parim väärtus, mida võetakse uurijat huvitava protsessi väärtuseks. Selliseid probleeme saab lahendada vähemalt kahel viisil: matemaatilise mudeli konstrueerimisega ja ilma. Valitud plaani alusel koostatakse vaadeldavale vastusele vastav mudel, mille abil leitakse tuntud ekstreemumiotsingu meetodeid kasutades tegurite väärtused, mille alusel mudeliga määratud eesmärkfunktsioon saab olla äärmuslik. Kui äärmuspunktile vastavate tegurite leitud väärtused asuvad rakendatava planeeringu piiril, siis planeeringuala kas nihutatakse või laiendatakse ning ehitatakse uus mudel, mille järel korratakse ekstreemumi otsimist. Ülesanne loetakse lahendatuks, kui äärmuspunkti arvutatud koordinaadid jäävad kasutatava plaaniga iseloomustatavasse piirkonda.
Praktikas rakendatakse seda lähenemist sageli nn järsu tõusu meetodil (Box-Wilsoni meetod). Valige lähtepunkt; selle tulemuste järgi arvutatakse 1. järku matemaatilise mudeli parameetrid. Kui mudel on adekvaatne, siis kasutatakse seda eesmärgifunktsiooni äärmuslikule väärtusele liikumisele vastavate tegurite muutumise suuna määramiseks gradiendi või antigradiendi suunas (vastavalt maksimumi või miinimumi otsimisel) . Valitud suunas liikumine toimub järjestikuste katsete abil ja seda seni, kuni reaktsioon muutub soovitud viisil. Ülaltoodud protseduuri korratakse, kuni igas etapis on ehitatud sobiv mudel. Järgmises etapis saadud mudeli ebaadekvaatsus näitab, et võib-olla on saavutatud ekstreemumipiirkond, kus lineaarset mudelit enam kasutada ei saa. Ekstreemumi asukoha selgitamiseks selles piirkonnas saab kasutada vastavate plaanide järgi ehitatud 2. järku mudelit.
Otsene katse objektil (ilma mudelit ehitamata). Katsete läbiviimise strateegia määrab valitud optimeerimismeetod. Sel juhul ei arvutata sihtfunktsiooni väärtust mudeli järgi, vaid leitakse otse vastavates tingimustes tehtud katsest. Kõige sagedamini kasutatakse sihtfunktsiooni parima väärtuse leidmiseks järjestikust simpleksmeetodit, Gaussi-Seideli meetodit jne.(kineetika) neis toimuvate elementaarprotsesside kohta.
Katse planeerimise meetoditega lahendatavate ülesannete hulgast võime eristada:
) mudeli parameetrite määramine (täpsustamine);
) nn. diskrimineerimine, st elementaarprotsesside kontrollitavate mehhanismide tagasilükkamine.
Määravate mudelite parameetrite täpsustamiseks on vaja valida selline katseplaan, mis annab parima hinnangu määratavatele kogustele. Parameetrite täpsustamisel tuleb katse planeerimisel kokku puutuda mitmete raskustega.
Peamised on järgmised:
) vajadus omada eraldi plaani iga mudeliklassi kohta, st igas konkreetses olukorras peab uurija selgitavate katsete seadistamiseks arvutama teguriruumi punktide optimaalse asukoha;
) optimeerimismeetodite abil mudelite määramise parameetrite arvutamise vajadus; see on tavaliselt tingitud nende mudelite mittelineaarsusest määratud parameetrite suhtes.
Diskrimineerimise ülesanne on valida mitme konkureeriva mudeli hulgast selline mudel, mis peegeldab kõige õigemini protsessi mehhanismi ja on parima ennustamisvõimega. Selle ülesande elluviimiseks võrreldakse mudeli vastavuse hindamise tulemusi katseandmetega sama protsessi või nähtuse erinevate kirjelduste kasutamisel. Lihtsaim diskrimineerimismeetod on katseandmete põhjal arvutada iga pakutud mudeli parameetrid ja seejärel võrrelda jääkvariante. Valituks võetakse minimaalse jääkdispersiooniga mudel. Kui ei ole võimalik valida mehhanismi, mis ei lähe vastuollu katseandmetega, siis kas laiendatakse uuritavat ala või nihutatakse punktide asukohta faktoriruumis ja toimingut korratakse. Selle lähenemise eelis seisneb selles, et teadlane lahendab korraga mõlemad ülesanded – parameetrite arvutamise ja mudelite eristamise. Puuduseks on asjaolu, et see nõuab sageli palju aega katseteks ja mudeli parameetrite arvutamiseks.
Praktiline töö naftakeemia sünteesi alal
Praktiline töö põhineb orgaanilise keemia, katalüüsi, füüsikalise keemia, keemiatehnoloogia ja teiste teaduste õnnestumistel ning on seotud õlide koostise ja nende komponentide omaduste sügava uurimisega. Süsivesinike toorainete sihttoodeteks töötlemise protsessid põhinevad arvukatel orgaanilise keemia reaktsioonidel: pürolüüs, oksüdatsioon, alküülimine, dehüdrogeenimine ja hüdrogeenimine, halogeenimine, polümerisatsioon, nitreerimine, sulfoonimine jne; katalüütilised reaktsioonid on nende hulgas kõige olulisemad. Naftakeemia sünteesist saadud toodete valmistamisel on suur koht süsivesinike toorainete valmistamisel ja esmaste algsete süsivesinike tootmisel: küllastunud (parafiin), küllastumata (olefiin, dieen), aromaatsed ja nafteensed. Enamik neist muudetakse funktsionaalseteks derivaatideks, mille aktiivsed rühmad sisaldavad hapnikku, väävlit ja muid elemente. Suure tähtsusega on parafiinsete süsivesinike sünteesgaasiks (süsinikmonooksiidi segu vesinikuga, vt Gas Conversion) muundamise protsessid. Tooraineks võivad olla maagaasid, nendega seotud gaasid, nafta rafineerimine ja mis tahes naftafraktsioonid. Ammoniaak toimib algproduktina väetiste (ammooniumnitraat, uurea), vesiniktsüaniidhappe jne tootmisel. Metaani kaheetapilisel muundamisel tekib ka kontsentreeritud süsinikmonooksiid, mida kasutatakse paljudes protsessides. Metanooli toodetakse süsinikmonooksiidist ja vesinikust – toorainest, millest saadakse formaldehüüdi, mis on kõige olulisem toode plastide, lakkide, liimide ja muude materjalide tootmiseks.
Parafiinide halogeenderivaate toodetakse tööstuslikus mastaabis. Metüülkloriidi, kloroformi, süsiniktetrakloriidi ja muid tooteid saadakse metaanist. Metüleenkloriid ja süsiniktetrakloriid on head lahustid. Kloroformi kasutatakse tetrakloroetüleeni, klorofluoroderivaatide, väärtusliku tetrafluoroetüleenmonomeeri jt sünteesiks. Etaani kloorimisel saadakse heksakloroetaan ja muud kloori derivaadid. Tahkete parafiinide kloorimise produkti klooritud parafiin-40 kasutatakse plastifikaatorina, klooritud parafiin-70 kasutatakse paberi ja suurenenud tulekindlusega kangaste immutamiseks. Petrooleumi ja gaasiõli kitsaste fraktsioonide täieliku fluorimise saadused on väärtuslikud kõrge termilise ja keemilise vastupidavusega määrdeained ja hüdrovedelikud. Nad võivad töötada pikka aega 250-300C juures väga agressiivses keskkonnas. Freoone – metaani ja etaani klorofluoroderivaate – kasutatakse külmikutes külmutusagensitena. Propaani ja üle 160-180C keevate parafiinide nitreerimine lämmastikhappega annab nitroparafiinide segu. Neid kasutatakse lahustite ja vaheühenditena nitroalkoholide, aminoalkoholide ja lõhkeainete sünteesil. Nafteenid. Nendest süsivesinikest on suure tähtsusega saanud vaid tsükloheksaan. Väikestes kogustes vabaneb tsükloheksaan õli (sisaldab 1-7% tsükloheksaani ja 1-5% metüültsüklopentaani) bensiinifraktsioonide selgel destilleerimisel. Metüültsüklopentaan muudetakse alumiiniumkloriidiga isomeriseerimisel tsükloheksaaniks. Tööstuslik vajadus tsükloheksaani järele rahuldatakse peamiselt selle tootmisega benseeni hüdrogeenimisel katalüsaatori juuresolekul.
Tsükloheksaani oksüdeerimisel õhuhapnikuga tekib tsükloheksanoon ja adipiinhape, mida kasutatakse polüamiidsünteetiliste kiudude (kaproon ja nailon) tootmisel. Adipiinhapet ja teisi tsükloheksaani oksüdeerimisel saadud dikarboksüülhappeid kasutatakse määrdeõlide ja plastifikaatoritena kasutatavate estrite sünteesiks. Tsükloheksanooni kasutatakse lahustina ja ka kampri asendajana. Suurt tähelepanu pööratakse nafta toorainel põhineva mikrobioloogilise sünteesi arendamisele. Valgu-vitamiini kontsentraate loomasöödaks saadakse parafiinsetest süsivesinikest.
Peatükk. 2. Protsesside tüübid
1 Hüdrogeenimis- ja dehüdrogeenimisprotsessid
Orgaanilises sünteesis hõlmavad hüdrogeenimisreaktsioonid (H2 lisamine) mis tahes molekule, mis on küllastumata. Hüdrogeenimisreaktsioonideks liigitatakse ka Fischeri-Tropschi süntees CO-st ja H2-st, metanooli süntees CO-st, CO2-st ja H2-st, kuid Fischeri-Tropschi sünteesis süsivesinike sünteesis toimub lisaks H2 lisamisele hävitav hüdrogeenimine CO sideme katkemine. Destruktiivne hüdrogeenimine hõlmab ka C-C sideme hüdrogenolüüsi – hüdrokrakkimisprotsesse, näiteks
ja C-S sideme hüdrogenolüüs (naftafraktsioonide hüdrodesulfureerimise protsessid)
Hüdrogeenimise pöördreaktsioon – dehüdrogeenimisprotsess – omab tähtsat kohta tööstuslikus orgaanilises sünteesis ja nafta rafineerimisprotsessides. Alkaanid ja alküülbenseenid on dehüdreeritud (butadieeni, isopreeni, stüreeni süntees), nafteenid (benseen tsükloheksaanist), alkoholid (formaldehüüdi, atsetooni, isovaleerialdehüüdi, tsükloheksanooni süntees). Metalle ja nende ühendeid kasutatakse hüdrogeenimise katalüsaatoritena:
Metallkatalüsaatorid - Pt, Pd, Ni, Co, Rh, Ru, Cu - puistemetallide, sulamite, kandjaga katalüsaatorite (M/kandja) ja skeletimetallide (Raney nikkel, Raney vask) kujul, mis saadakse Al leostumisel Al-Ni, Al-Cu jne.
Metallsulfiidid - NiS, CoS, Mo2S3, W2S3.
Metalloksiide kasutatakse dehüdrogeenimisprotsessides, kuna kõrgel temperatuuril (> 200°C) on metallid liiga aktiivsed ja põhjustavad hävitavaid protsesse. Dehüdrogeenimiskatalüsaatorid on järgmised oksiidid: ZnO, Cr2O3, Mo2O3, W2O3, MgO. Kõrgetel temperatuuridel (> 450оС) täheldatakse alkoholide dehüdrogeenimist ka -Al2O3-l.
Hüdrogeenimisprotsesside kõige olulisem etapp on vesiniku molekuli aktiveerimine. Lahustes olevate metallikomplekside puhul on vesiniku aktiveerimise mehhanism nüüd selge:
Primaarse kompleksi muundumine sõltub metalli olemusest, selle oksüdatsiooniastmest ja koordinatsioonisfääri ligandidest. Homolüüs ja heterolüüs on võimalikud:
Dissotsieerumata H2 molekuli osalemine homogeense hüdrogeenimise protsessides ei ole veel kindlaks tehtud. M-C sideme hüdrogenolüüs, näiteks olefiinide hüdroformüülimise käigus
loetakse ka Co-aatomi H2 molekuli homolüütilise lõhustamise tulemuseks. Metallide pinnal toimub H2 homolüütiline lõhenemine pinnapealsete vesinikuaatomite ja metallvõres lahustunud vesinikuaatomite moodustumisega. Polaarse lahusti (S) juuresolekul võib H2 adsorptsiooniprotsess metallidel kulgeda heterolüütiliselt ja sellega võib kaasneda isegi täielik ionisatsioon koos 2' üleminekuga metallile.
Sel juhul redutseeritakse hüdrogeenitud ühendi molekul metalliga seotud elektronide poolt. Metallide hüdrogeenimisprotsesside kineetiliste mudelite konstrueerimisel kasutatakse homogeense pinna, ühtlaselt ebahomogeense pinna (Langmuir-Hinshelwoodi mudelid) ja mittehomogeense pinna mõisteid. Näiteks etüleeni hüdrogeenimisel Nisolidi pinnale adsorbeeritud etüleeni ja vesiniku interaktsiooni hüpoteesi raames:
![]() (6);
(6);
Ühtlasel pinnal:
 (7);
(7);
Ühtlaselt ebahomogeensel pinnal:
 (8);
(8);
Reformimisprotsess on suunatud n-parafiinide isomerisatsioonile ja aromatiseerimisele, muutmata transformatsioonide käigus molekulmassi (süsinikuaatomite arvu) algsetes molekulides. Peamised reaktsioonid:
a) maitseaine
b) parafiinide dehüdrotsüklistamine
 (10);
(10);
c) skeleti isomerisatsioon
d) dehüdrogeenimine
Reformimist kasutatakse kõrge oktaanarvuga bensiinide ja aromaatsete ühendite saamiseks tööstusbensiinist (keemistemperatuur 80–160 °C), mis ekstraheeritakse bensiinidest ja kasutatakse hüdrokrakkimise või orgaanilise sünteesi toorainena. Protsess viiakse läbi vahemikus 380-520 °C rõhul 10-40 atm heterogeensetel bifunktsionaalsetel katalüsaatoritel - metallil ja happel - Pt-l produtseeritud Cl- või F-alumiiniumoksiidil (või alumiiniumsilikaadil). Viimasel ajal on kasutatud Pt-Re/Al2O3 või polümetallist katalüsaatoreid Al2O3 peal. Peamine probleem reformimisprotsessis on katalüsaatori deaktiveerimise ja koksimise protsess (vt 1. lisa).
Ristkülikus asuvad ioonid võivad sisaldada delokaliseeritud elektrone. Näited C-S sidemete hüdrogenolüüsist siirdemetallide komplekside osalusel on juba ilmunud. Selliste süsteemide uuringud võimaldavad kindlaks teha protsessi mehhanismi ja võimalike vaheühendite olemuse.
Alküülimisprotsessi kasutatakse laialdaselt naftakeemiatööstuses kõrge oktaanarvuga bensiinikomponentide tootmiseks. Protsessi lähteaineks on isobutaan ja katalüütilise krakkimise käigus saadud butaan-butüleen või propaan-propüleenfraktsioon.
Väävelhappe alküülimise tehas sisaldab mitut sektsiooni. Algselt tuleb alküülitavad materjalid jahutada temperatuurini 4 - 50C (400F) ja viia üle vedelasse faasi.
See protsess viiakse läbi külmutusseadmes kõrgendatud rõhul (3–15 atm). Edasi siseneb aine mitmest eraldiseisvast reaktorist koosnevasse reaktoriplokki. Lisaks lisatakse reaktoris veeldatud reaktsiooniproduktidele protsessi katalüsaatorina väävelhapet.
Sektsioonide arv ja reaktori konstruktsioon peaksid tagama molekulide pikaajalise kohaloleku ja perioodilise segunemise reaktoritsoonis alküülimisreaktsiooni läbiviimiseks. 15-20 minuti pärast juhitakse reaktori saadused happeeraldusseadmesse. Happevann on anum ilma segamiseta. See eraldab happed süsivesinikest. Ainete tiheduse erinevus võimaldab süsivesinikel anumas üles tõusta. Hape omakorda vajub põhja ja naaseb reaktorisse. Ja süsivesinikud lähevad spetsiaalses anumas leeliselisele pesemisele. Leelispesuseadmes töödeldakse alküülimisprodukte seebikiviga, mis neutraliseerib happe. Pärast pesemist siseneb süsivesinike segu järjestikku kolme standardsesse destilleerimiskolonni - debutaaniseerija, deisobutaani eemaldaja, propaani eemaldaja. Nad eraldavad segu alkülaadiks ja küllastunud gaasilisteks süsivesinikeks. Sel juhul saadetakse isobutaan jahutusseadmesse protsessi uuesti läbimiseks.
Alküülimisprotsessi seadmed:
Külmutusseade GOST 11875-88
See standard kehtib üldotstarbelistele pöörlevatele trummeljahutitele, mida kasutatakse keemia- ja muudes tööstustes mitteplahvatusohtlike puistematerjalide jahutamiseks. Standard ei kehti tsemendi- ja paisutatud savitööstuse trummeljahutitele.
Alküülimisreaktorid GOST 20680-2002
See standard kehtib 0,01–100 kuupmeetri nimimahuga mehaaniliste segistitega terasseadmetele. , mis on ette nähtud erinevate tehnoloogiliste protsesside läbiviimiseks vedelas keskkonnas tihedusega kuni 2000 kg / m3. ja dünaamiline viskoossus mitte üle 200 Pa. s töötemperatuuril miinus 40 kuni pluss 350 kraadi. C ja tööülerõhk mitte üle 6,3 MPa, metallkonstruktsioonide valmistamisel mõeldud kummivoodriga seadmetele, samuti rõhu puudumisel ja vaakumis töötavatele seadmetele, mille jääkrõhk on vähemalt 665 Pa. See standard ei kehti emailkattega seadmete ning malmist ja mittemetallist materjalist ning suitsugaaside või lahtise leegiga köetavate seadmete kohta.
Happeeraldusseade ja leelisepesuseade GOST 26159-84
See standard kehtib malmist anumate ja seadmete kohta, mida kasutatakse keemia-, naftarafineerimis- ja sellega seotud tööstusharudes. Kehtestab üldnõuded staatilisel koormusel töötavate anumate ja seadmete konstruktsioonielementide tugevuse arvutamise standarditele ja meetoditele
Destilleerimiskolonnid GOST 21944-76
See standard kehtib lehtterasest valmistatud kolonniseadmetele, mille siseläbimõõt on 400–10 000 mm.
3 Oksüdatsiooniprotsessid
Redoksreaktsiooni käigus loovutab redutseerija elektronid, see tähendab, et see oksüdeerub; Oksüdeeriv aine omandab elektrone, see tähendab, et see redutseerub.
Veelgi enam, mis tahes redoksreaktsioon on kahe vastandliku muundumise - oksüdatsiooni ja redutseerimise - ühtsus, mis toimuvad samaaegselt ja üksteisest eraldamata.
Oksüdatsioon on elektronide loovutamise protsess, mille käigus suureneb oksüdatsiooniaste.
Aine oksüdeerumisel elektronide loovutamise tulemusena suureneb selle oksüdatsiooniaste. Oksüdeeritud aine aatomeid nimetatakse elektronidoonoriteks ja oksüdeeriva aine aatomeid elektronaktseptoriteks. Mõnel juhul võib algse aine molekul oksüdeerumisel muutuda ebastabiilseks ning laguneda stabiilsemateks ja väiksemateks komponentideks (vt Vabad radikaalid). Veelgi enam, mõnedel saadud molekulide aatomitel on kõrgem oksüdatsiooniaste kui samadel aatomitel algses molekulis. Oksüdeeriv aine, võttes vastu elektrone, omandab redutseerivad omadused, muutudes konjugeeritud redutseerijaks: oksüdeeriv aine + e− ↔ konjugeeritud redutseerija.
Taastamine on protsess, mille käigus elektronid seotakse aine aatomiga, samal ajal kui selle oksüdatsiooniaste väheneb. Redutseerimisel saavad aatomid või ioonid elektrone. Sel juhul väheneb elemendi oksüdatsiooniaste.
Igas redoksreaktsioonis osalevad kaks konjugeeritud redokspaari, mille vahel toimub konkurents elektronide pärast, mille tulemusena toimub kaks poolreaktsiooni: üks on seotud elektronide lisandumise ehk redutseerimisega ja teine elektronide vabanemisega. elektronid, st oksüdatsioon. Redoksreaktsioonides kanduvad elektronid ühelt aatomilt, molekulilt või ioonilt teisele. Elektronide loovutamise protsess on oksüdatsioon. Oksüdeerumisel tõuseb oksüdatsiooniaste. Elektronide lisamise protsess on taastumine. Redutseerimisel väheneb oksüdatsiooniaste. Aatomid või ioonid, mis loovutavad selles reaktsioonis elektrone, on oksüdeerivad ained ja need, mis loovutavad elektrone, on redutseerivad ained.
4 Esterdamise, hüdrolüüsi, hüdratatsiooni, dehüdratsiooni protsessid
Hüdrolüüsireaktsioone nimetatakse asendus- või topeltvahetusprotsessideks, mis toimuvad vee või leeliste toimel. Neid saab klassifitseerida hüdrolüüsireaktsioonideks, mis kulgevad C-Cl, CO, CN sidemete jne lõhenemisega. Erinevalt hüdrolüüsist taanduvad hüdratatsioonireaktsioonid vee lisamiseni küllastumata CC sidemetele, nitriilide CN kolmiksidemele jne. Mõned hüdratatsioonireaktsioonid on tasakaalus; vee lõhenemise vastupidist protsessi nimetatakse dehüdratsiooniks, mis võib olla mitte ainult intra-, vaid ka molekulidevaheline. Esterdamisprotsess on alkoholide ja orgaaniliste hapete, nende anhüdriidide või happekloriidide interaktsiooni reaktsioon estrite moodustumisega. Amiidimisprotsess - saadakse ammoniaagi, primaarsete või sekundaarsete amiinide interaktsiooni reaktsioon karboksüülhapetega, happeamiididega. Need reaktsioonid on pöörduvad ja paljuski sarnased esterdamisreaktsioonidele, kuid erinevad viimastest selle poolest, et tasakaal on tugevalt paremale nihkunud.
Tingimused glütseriini saamiseks toiduks mittekasutatavast toorainest:
allüülkloriidi hüpokloorimine diklorohüdriiniks, millele järgneb selle seebistamine epiklorohüdriiniks ja aluseline hüdrolüüs;
allüülkloriidi hüdrolüüs allüülalkoholiks, millele järgneb selle epoksüdeerimine vesinikperoksiidiga glütsiidalkoholiks ja hüdrolüüs glütserooliks;
propüleenoksiidi isomeerimine allüülalkoholiks ja sellele järgnev töötlemine nagu teise meetodi puhul.
Olefiinidest saadud alkohole võib saada otsese hüdratatsiooni teel või kaudselt mitme järjestikuse reaktsiooni kaudu. Olefiinide otsene hüdratsioon põhjustab sekundaarsete või tertsiaarsete alkoholide moodustumist (välja arvatud etüleen, millest saadakse etüülalkohol). Alkoholide saamise kaudsetest meetoditest on tuntuim meetod väävelhappe lisamisel olefiinidele. Kõigepealt tekivad väävelhappe mono- või diestrid, mis seejärel hüdrolüüsitakse vastavateks alkoholideks. Etüülalkoholi tootmismeetodite uurimisel pöörake tähelepanu teguritele, mis määravad etüleeni niisutamise meetodi valiku. Lisaks on etüleeni otseseks hüdraatimiseks kaks tehnoloogilist meetodit, mis erinevad auru tarnimise ja auru-gaasi segu kuumutamise meetodi poolest. Isopropüülalkoholi saamiseks tööstuses kasutatakse propüleeni otsese hüdratatsiooni meetodit. Propüleeni otsese hüdratatsiooni meetodid on mitmekesisemad kui etüleeni puhul, millised on nende meetodite sarnasused ja erinevused. Mis seletab suurenenud tähelepanu alkoholide tootmise ohutusele. Etüülatsetaadi tootmist uurides pöörake tähelepanu eetri kogusaagisele, mis on 95% teoreetilisest, kuidas seda seletada? Amiidimisprotsessid on orgaanilise ja naftakeemilise põhisünteesi tööstuse jaoks väga olulised, kuna need võimaldavad saada väga väärtuslikke tooteid ja vaheühendeid edasiseks sünteesiks. Olulisemate hulgas on: dimetüülformamiidi, dimetüülatseetamiidi, etanoolamiidide, plastifikaatorite, herbitsiidide, sünteetiliste kiudude manmeeride tootmine.
5 Liitmis- ja kondensatsiooniprotsessid karbonüülrühma juures
Karbonüülühendid on ühendid, mis sisaldavad ühte või mitut karbonüülrühma (C=O). Nende hulka kuuluvad CO, CO2, karbonaadid, uurea ja paljud teised. Orgaanilises keemias mõistetakse karbonüülühenditena aga ainult aldehüüde ja ketoone ning vähemal määral karboksüülhappeid ja nende derivaate. Aldehüüdides on karbonüülrühm seotud ühe süsivesiniku radikaali ja ühe vesinikuaatomiga, samas kui ketoonides on oksorühm seotud kahe süsivesiniku radikaaliga.
Karbonüülsüsinik, olles sp2 hübridisatsiooni olekus, moodustab hapnikuaatomiga kaksiksideme. Oksoühendites sisalduval hapnikul on kaks mittesiduvat elektronide paari. Hapniku elektronegatiivsus on suurem kui süsinikul ning süsiniku ja hapniku y- ja eriti p-sidemete elektronid on tugevalt nihkunud hapnikuaatomi poole. Teisisõnu, karbonüülrühm on väga polaarne. Karbonüülrühma polaarsuse keemiline tagajärg on mitmesuguste polaarsete reagentide liitumisreaktsioonid karbonüülrühmas.
Karbonüülhapniku üksikud elektronpaarid annavad karbonüülrühmale Lewise järgi nõrga aluse omadused, mis mängib olulist rolli aldehüüdide ja ketoonide keemiliste omaduste tõlgendamisel.
Metallorgaaniliste ühendite lisamine:
Metallorgaanilised ühendid lisanduvad karbonüülühenditele, moodustades magneesium- või liitiumalkoksiidid, mis hüdrolüüsuvad kergesti alkoholideks. Grignardi reagendi lisamisel formaldehüüdile saadakse primaarsed alkoholid, sama reaktsioon teiste aldehüüdide ja ketoonidega viib vastavalt sekundaarsete ja tertsiaarsete alkoholide moodustumiseni. Sekundaarsete ja tertsiaarsete alkoholide saamine magneesiumorgaanilistest ühenditest ja aldehüüdidest või ketoonidest on sageli komplitseeritud kõrvalprotsesside tõttu. Kõrvalreaktsioonid saab täielikult välistada, kui karbonüülrühma külge kinnitamiseks kasutatakse liitiumorgaanilisi ühendeid. Sel juhul on isegi võimalik läbi viia tertsiaarsete alkoholide süntees, mis sisaldavad karbonüüli süsinikuaatomi juures samaaegselt kolme tertsiaarset alküülrühma:
Karbonüülühendite oksüdeerimine:
Aldehüüdid oksüdeeruvad kergesti karboksüülhapeteks mitte ainult selliste reagentide nagu permanganaat või dikromaat, vaid isegi selliste nõrkade oksüdeerivate ainete nagu hõbeioonide toimel. Seetõttu kasutatakse aldehüüdide tuvastamiseks "hõbepeegli" reaktsiooni: aldehüüd reageerib Tollensi reagendiga (hõbedase ammoniaagi lahusega), et sadestada metallist hõbedat peegelkatte kujul. Ketoonide oksüdatsioon toimub raskemates tingimustes, kasutades tugevaid oksüdeerivaid aineid happelises või aluselises keskkonnas, kuna reaktsiooniga kaasneb süsinik-süsinik sideme katkemine. Paljud ketoonid lõhustatakse mõlemal pool karbonüülrühma, mille tulemuseks on hapete segu.
Karbonüülühendite taaskasutamine:
Aldehüüdid redutseeritakse primaarseteks alkoholideks ja ketoonid sekundaarseteks alkoholideks kas katalüütilise hüdrogeenimise tulemusena või komplekshüdriidide (naatriumboorhüdriidi ja liitiumalumiiniumhüdriidi) abil. Naatriumboorhüdriid, erinevalt liitiumalumiiniumhüdriidist, tagab aldehüüdide ja ketoonide karbonüülrühma selektiivse redutseerimise teiste funktsionaalrühmade (ester, nitriil, amiid) ja C-C topeltsidemete juuresolekul, mida see reagent ei mõjuta.
Ketoonide redutseerimine metüleenrühmaks amalgameeritud tsingiga vesinikkloriidhappes (Clemmenseni redutseerimine) tekitab primaarse alküülrühmaga alküülbenseene
b-karbonüülühendite halogeenimine:
Aldehüüdid ja ketoonid on võimelised reageerima halogeenidega, asendades vesinikuaatomid b-süsiniku aatomi juures.
Leeliselises keskkonnas on reaktsiooni monohalogeenimise etapis raske peatada, kuna monohalogeenderivaat läbib nendes tingimustes järgneva halogeenimise kiiremini kui lähtealdehüüd või ketoon. Seetõttu asendatakse nendes tingimustes kõik 6-vesiniku aatomid halogeeniga. Monohalokarbonüülühendid saadakse hapete juuresolekul
6 Sulfoonimis- ja sulfatsiooniprotsessid
Sulfoneerimine (sulfoonimine), sulforühma SO2OH viimine molekuli org. ühendused; laiemas tähenduses on sulfoneerimine SO2X rühma sissetoomine (X = OH, ONa, OAlk, OAr, Hal, NAlk2 jne). SO3H rühma sissetoomisest koos O-S sidemete moodustamisega (O-sulfoonimine, sulfaadimine, sulfoesterdamine).
Protsessi, sulfoonimise vastupidist protsessi (SO2X rühma eemaldamine orgaanilise ühendi molekulist), nimetatakse. desulfoonimine (desulfoonimine). Sulfoonimine toimub vahetult sulfoneerivate ainete abil või kaudselt, näiteks sulforühma lisamisega sulfoalküülfragmentide (CH2)nSO2X koostisesse. Sulfoneerivad ained: H2SO4, SO3 ja selle kompleksid org. ühendid (estrid, tertsiaarsed amiinid ja fosfiinid, karboksüülhapete amiidid, trialküülfosfaadid jne), oleum. SOCl2, halosulfoon- ja sulfaamhapped, dialküülsulfaadid, atsüülsulfaadid.
Aromaatne sulfoneerimine. süsivesinikud voolavad läbi elektroforeesi mehhanismi. Asendused (vt lisa 2).
Reaktsioon viiakse läbi nii aurus kui ka vedelas faasis (lahustid: SO2, CC14, freoonid jne). Väävelhappega sulfoonimisel kasutatakse tasakaalu paremale nihutamiseks happe liiast või seotakse vesi ooleumi lisamise, aseotroopse destilleerimise vms teel.
Elektrone loovutavate asendajatega ühendid on reaktiivsemad ja on valdavalt sulfoonitud. orto- ja paraasendis; ühendid, mille metapositsioonis on elektrone tagasitõmbavad asendajad. Enamasti tekivad asendatud benseenide sulfoonimisel isomeeride segud, mille suhe sõltub asendaja olemusest, sulfoneerivast reagendist ja reaktsioonitingimustest (reaktiivide kontsentratsioon, temperatuur, lahusti, katalüsaatorite olemasolu, jne.). Valides optimaalse tingimustes, on võimalik selektiivne sulfoneerimine. Niisiis, tolueeni sulfoonimisel väävelhappega 20 °C juures saadakse võrdsed kogused o- ja n-tolueensulfoonhappeid ning kui SO3 kasutatakse samadel tingimustel, siis eranditult n-isomeeriks; fenooli sulfoneerimisel külmas eelsoojus. tekib o-fenoolsulfoonhape, 100°C juures aga n-fenoolsulfoonhape. Reeglina on sellised erinevused tingitud mõnede isomeeride muutumisest teisteks, mis on termodünaamiliselt stabiilsemad tänu isomerisatsioonile või sulfoonimise pöörduvusele. Näiteks naftaleen temperatuuril alla 100 ° C moodustab algselt α-naftaleensulfoonhappe, mis aja jooksul muutub. β-isomeeriks järjestikuse väävlitustamise-resulfoonimise tulemusena. sulfoonimine 160 °C juures annab eranditult β-naftaleensulfoonhappe (vt Naftaleensulfoonhapped).
Heterotsükliliste ühendite (furaan, pürrool, tiofeen, indool jne) sulfoneerimiseks kasutatakse SO3 komplekse dioksaani või püridiiniga. Samu reaktiive kasutatakse alifaatsete ainete sulfoneerimiseks. side, mis sisaldab tugevaid elektrone väljatõmbavaid rühmi; sel juhul tekivad reeglina a-sulfoderivaadid (vt lisa 3).
Kaudsed sulfoneerimismeetodid hõlmavad sulfometüülimist, sulfoetüülimist jne (vt lisa 4).
Sulfoneerimist kasutatakse pindaktiivsete ainete, ioonivahetusmembraanide ja -vaikude, bioloogiliselt aktiivsete ainete, värvainete jms tootmisel.
Järeldus
Praktika ajal tutvusin naftakeemia sünteesiga seotud seadmetega ja nägin, kuidas nendega õigesti töötada. Mulle tutvustati ohutusjuhendit, näidati töökohta ja selle taga töötamist.
Õpetaja näitas, kuidas teha tööd naftakeemia sünteesi alal.
Viidi läbi hüdrogeenimise, dehüdrogeenimise, alküülimise protsessid. Teadmisi kasutati esterdamise, hüdrolüüsi, hüdratatsiooni, dehüdratsiooni, karbonüülrühma lisamise ja kondenseerimise, sulfoneerimise ja sulfaadimise läbiviimiseks.
esterdamine hüdrolüüs dehüdratsioon karbonüül
Bibliograafia
1. Suur entsüklopeediline sõnastik. Keemia. M., 2001.
2. Grushevitskaya T. T., Sadokhin A. P. Kaasaegse loodusteaduse kontseptsioonid.
. Kaasaegse loodusteaduse kontseptsioonid. Under. toim. V. N. Lavrinenko, V. P. Ratnikova. M., 1997.
. Kuznetsov V. I. Üldine keemia. Arengutrendid. M., 1989.
. Kuznetsov V. I., Idlis GM. , Gutina VN Loodusteadus. M., 1996.
. Molin Yu. N. Füüsika rollist keemiauuringutes. Keemia metodoloogilised ja filosoofilised probleemid. Novosibirsk, 1981.
. Keemia//Keemiaentsüklopeediline sõnaraamat. M., 1983.
. Pilipenko A. T., Pjatnitski I. V. Analüütiline keemia. - M.: keemia, 1990.
. V. P. Vasiliev Analüütiline keemia - M.: Bustard 2004
. Analüütilise keemia alused / Toim. Akadeemik Yu. A. Zolotov. - M.: Kõrgkool, 2002. Raamat. 1, 2. 15. N. P. Agafošin, Perioodiline seadus ja elementide perioodiline süsteem, D. I. Mendelejev, Dmitri Ivanovitš. M. : Haridus, 1973.
. Jevdokiomv Yu., Ph.D. Teadused. Perioodilise õiguse ajaloost. Teadus ja elu, nr 5 (2009).
. Makarenja A. A., Rysev Yu. V. D. I. Mendelejev Dmitri Ivanovitš. - M.: Valgustus, 1983.
. Makarenja A. A., Trifonov D. N. D. I. Dmitri Ivanovitš Mendelejevi perioodiline seadus. - M.: Haridus, 1969.
Lisa

1. (Katalüsaatori desaktiveerimine ja koksistamine).
2. (Aromaatsete ainete sulfatsioon).

3. (Heterotsükliliste ühendite sulfatsioon).

4. (Sulfometüülimine, sulfoetüülimine).
Teema: Naftakeemia sünteesi hetkeseis. Peamised tooted ja tehnoloogiad
Sissejuhatus
1. Alternatiivsed kütused, toorained
1.1 Dimetüüleeter
1.2 Sünteetiline bensiin
1.3 Alkoholkütused
1.4 Biomassi kütus
2. Tehnoloogia
2.1 DME süntees maagaasist (metanooli kaudu)
2.2 DME üheastmeline süntees sünteesgaasist ja bensiini süntees (DME kaudu)
2.3 Mootorikütuste tootmise ebatraditsioonilised protsessid ja tehnoloogiad
2.3.1 BIMT tehnoloogia
2.3.2 BIMT-2 tehnoloogia
2.3.3 JALGRATTA protsess
Järeldus
Kirjandus
Sissejuhatus
Kütusetööstuse arengut mõjutavad mitmed tegurid. Nafta tooraine leidmise, kaevandamise ja massitarbimiskohtadesse toimetamise kallinemine tõi kokkuvõttes kaasa naftast saadava kütuse kallinemise. Kasvavad keskkonnanõuded toodetava mootorikütuse kvaliteedile põhjustavad ka algsete õlifraktsioonide töötlemise kulude tõusu.
Teine oluline energiakütuste sektori muutuste trajektoori kujundav tegur on vajadus vähendada süsinikdioksiidi, peamise kasvuhoonegaasi, heitkoguseid atmosfääri. Ökoloogi seisukohalt ei saa ühtegi praegu olemasolevat kütuseliiki pidada vastuvõetavaks. Kõik, mida transpordis energia tootmiseks kasutatakse, on süsinikuühendid. Nende põletamisel automootoris või elektrijaama (tehase või elektrijaama) ahjus tekib (parimal juhul) süsihappegaas, mis satub atmosfääri. Maanteetranspordi ja suuremahuliste elektrijaamade tulevikku seostatakse tavaliselt taastuvatest energiaallikatest toodetud elektri ja vesiniku kasutamisega viisil, mis praegu ei paista loodust kahjustavat. Nende ambitsioonikate projektide elluviimine kätkeb endas palju tehnilisi väljakutseid, mille lahendamine võtab üsna kaua aega, isegi kui ülemaailmne teaduslik ja tehnoloogiline potentsiaal mobiliseeritakse.
Nafta hinna ja selle töötlemismeetodite tõusu, kasvava mootoriseerituse ja tsivilisatsiooni kasvava vajaduse taustal kvaliteetse kütuse järele pööravad keemikud praegu oma tähelepanu naftaga mitteseotud allikatele, et toota uusi süsivesinikkütuste koostisi. on tarbija-autojuhile tuttavaks saanud.
Praegu on ainuke majanduslikult vastuvõetav viis sõidukite keskkonnasõbralikkuse parandamiseks vahetada need üle alternatiivsetele kütustele, mis vähendavad automootorite kahjulikke heitmeid keskkonda tasemele, mis vastab rangetele Euroopa standarditele. Euroopa Komisjonil on kavas välja töötada ulatuslik programm alternatiivsete mootorikütuste kasutuselevõtuks. Aastaks 2020 tuleb üle 1/5 naftapõhistest kütustest asendada alternatiivsete toodetega, nagu biokütused, maagaas ja vesinik.
1. Alternatiivsed kütused, toorained
1.1 Dimetüüleeter
Dimetüüleetri (DME) ja bensiini süntees läbi dimetüüleetri on üks uusi suundi maagaasi ja muude süsinikuallikate (kivisüsi, puidujäägid jne) töötlemise vallas. Metaani mootorikütusteks töötlemise peamised viisid on näidatud skeemil 1. Nagu skeemist näha, sobib DME süntees maagaasi töötlemise skeemi alternatiivina metanooli sünteesile.
Mootorikütused
Hema 1 Maagaasi mootorikütusteks töötlemise peamised viisid
1.2 Sünteetiline bensiin
Sünteetilise mittenaftabensiini tootmise tooraineks võib olla kivisüsi, looduslikud ja nendega seotud naftagaasid, biomass, põlevkivi jne. Alternatiivsete mootorikütuste tootmiseks on kõige perspektiivikam maagaas, aga ka sellest saadav sünteesgaas (CO ja H2 segu erinevates vahekordades). Seal, kus maagaasi on lihtne eraldada, saab seda kasutada suru- ja veeldatud olekus sisepõlemismootorite mootorikütusena. Maagaasi veeldamise eeliseks kompressiooni ees on see, et see võib vähendada hoiusüsteemi mahtu peaaegu kolm korda.
Maagaasist saadud alternatiivsete kütuste kasutamine vähendab mürgiste komponentide sisaldust sõidukite heitgaasides.
1.3 Alkoholkütused
Selle kütuseliigi oluliseks miinuseks on kõrge hind – olenevalt tootmistehnoloogiast on alkoholkütused 1,8-3,7 korda kallimad kui naftakütused. Erinevatest alkoholidest ja nende segudest on mootorikütustena enim kasutatud metanooli ja etanooli. Praegu kasutatakse metanooli tootmiseks süngaasi, kuid suuremahuliste protsesside jaoks on eelistatud lähteaine maagaas. Energeetika seisukohalt seisneb alkoholide eelis peamiselt nende suures detonatsioonikindluses, mis määrab alkoholide valdava kasutamise sädesüütega sisepõlemismootorites. Nende peamised puudused on madal kütteväärtus, kõrge aurustumissoojus ja madal aururõhk.
Etanool toimib üldiselt paremini kui metanool. Etanooli hind on keskmiselt palju kõrgem kui bensiini hind. Praegu kasutatakse metanooli mootorikütusena piiratud koguses. Seda kasutatakse peamiselt sünteetiliste vedelkütuste tootmiseks, kõrge oktaanarvuga kütuselisandina ja toormaterjalina detonatsioonivastase lisandi, metüül-tert-butüüleetri, tootmiseks.
Üks tõsisemaid metanoolilisandite kasutamist takistavaid probleeme on bensiini-metanooli segude madal stabiilsus ja tundlikkus vee suhtes. Bensiini ja metanooli tiheduste erinevus ning viimase hea lahustuvus vees toovad kaasa asjaolu, et isegi väikese koguse vee sattumine segusse põhjustab selle kohese eraldumise ning kalduvus eraldumiseks suureneb temperatuuri langedes. , vee kontsentratsiooni tõus ja aromaatsete ühendite sisalduse vähenemine bensiinis. Bensiini-metanooli segude stabiliseerimiseks kasutatakse lisandeid - propanooli, isopropanooli, isobutanooli ja muid alkohole.
1.4 Biomassi kütus
Biomass on väga paljulubav taastuv tooraine. Seda saab kasutada alternatiivkütusena etanooli tootmiseks. Hinnanguliselt kasvatatakse igal aastal nii palju biomassi, et see suudab toota kaheksa korda rohkem energiat kui kõik fossiilkütused praegu pakuvad. Viimastel aastatel on laienenud teadusuuringud, mille eesmärk on luua vedelkütuste tootmine taimse päritoluga taastuvast toorainest.
Bioetanooli ja biobutanooli saadakse kääritamise teel. Kääritamise toorainena saab kasutada väga erinevaid süsivesikuid: suhkruid, tärklist, tselluloosi jne. Tärklisest bioetanooli tootmise alus koosneb kahest etapist: tärklise hüdrolüüs glükoosiks ensüümide toimel ja fermentatsioon. glükoosist etanooliks. Selle tehnoloogia oluline puudus on seotud asjaoluga, et kui etanooli kontsentratsioon reaktsioonisegus tõuseb üle teatud taseme, hakkab see käärimisprotsessi pärssima. Lisaks põhjustab käärimine tavaliselt mitmete metaboliitide moodustumist, mis kõrgendatud kontsentratsioonides vähendavad ka protsessi efektiivsust.
Kaasaegsed uuringud bioetanooli tootmise olemasolevate protsesside täiustamiseks toimuvad peamiselt kahes suunas: pidevas režiimis töötavate fermentatsioonisüsteemide arendamine ning etanooli ekstraheerimise ja puhastamise meetodite tootlikkuse tõstmine, et vähendada energiakulusid. kütusealkoholi tootmine.
2. Tehnoloogia
2.1 Dimetüüleetri süntees maagaasist (metanooli kaudu)
Maagaas on dimetüüleetri sünteesiks kõige lihtsam ja ligipääsetavam tooraine ning sellest tulenevalt on maagaasil põhinev DME saamise protsess parimate majandusnäitajatega. Praegu on DME (aerosooltäiteaine) tööstuslik toodang ca. 150 tuhat tonni aastas ja põhineb metanooli töötlemisel. Lihtsustatud skeemi maagaasil põhineva DME tootmiseks metanooli sünteesi ja sellele järgneva dehüdratsiooni kaudu võib esitada skeemina 2.
Skeem 2 Skeem DME sünteesimiseks maagaasist metanooli sünteesi ja dehüdratsiooni etappide kaudu
Vaatleme selle sünteesi üksikuid etappe.
Metaani muundamine.
Metaani muundamine (reformeerimine) sünteesgaasiks on kõrgtemperatuuriline protsess, mida saab läbi viia erinevate reaktsioonidega (erinevate reaktiivide osalusel). Nende hulgas:
veeauru reformimine CH4+H3O=CO+3H3 (1)
süsinikdioksiidi muundamine CH4+CO2+2CO+2H3 (2)
CH4+1/2O2=CO+2H3 mittetäielik oksüdatsioon (3)
Reaktsioonid (1) ja (2) on tugevalt endotermilised, seetõttu on laialt levinud autotermiline reformimine, st auruga reformimine hapniku juuresolekul. Autotermilise reformimise tingimustes toimuvaid reaktsioone (1) ja (3) täiendavad tugevalt eksotermilised täieliku oksüdatsiooni reaktsioonid:
CH4+2O2=CO2+2H3O (4)
H3+1/2O2=H3O (5)
CO+1/2O2=CO2 (6)
Need protsessid kompenseerivad reaktsioonis (1) tekkivaid soojuskadusid, kuid toovad kaasa lisakulusid toorainele.
Sünteesgaas on CO ja vesiniku segu vähese CO2-ga, mis võib sisaldada ka lämmastikku. Sünteesgaasi kõige olulisem omadus on H2:CO kontsentratsioonide suhe. Metanooli sünteesil peab see suhe olema suurem kui kaks, mis muudab aurureformi kasutamise vältimatuks (reaktsioon 1).
Reformimistingimused on termodünaamika (temperatuuri tõus ja rõhu langus metaani tasakaalukonversiooni suurendamiseks), majanduse ja materjaliteaduse nõuete kompromissi tulemus. Kõrgel temperatuuril (800-900 ºС) ja mitte liiga kõrgel rõhul (1-3 MPa) on protsessi termodünaamika soodne, mis võimaldab viia reaktsiooni täieliku transformatsioonini. Saavutatud kompromiss viib selleni, et metanooli sünteesi protsessis nõuab reformimise etapp ligikaudu 2/3 kapitaliinvesteeringutest ja üle poole tegevuskuludest. See asjaolu viis uute võimaluste otsimiseni maagaasi sünteesgaasiks muundamiseks.
Metaani otsene gaasifaasi selektiivne oksüdatsioon CO-ks ja H2-ks, s.o. sünteesgaasiks (reaktsioon 3) oleks alternatiivsetest meetoditest lihtsaim, kuid selle protsessi selektiivsus praktilistes tingimustes on madal (50% tasemel). Kõrge selektiivsuse võib saavutada kõrgetel temperatuuridel (umbes 1500 K), kui tasakaal on soodne sünteesgaasi tekkeks. Protsessi läbiviimine sellistel temperatuuridel on aga seotud mitmete raskustega, mis tulenevad väga rangetest nõuetest reaktori materjalile, mis puutub kokku korrodeeriva keskkonnaga kõrgel temperatuuril, ja protsessi juhtimise keerukusest, kuna põlemisseadused "rikkaid" segusid on suhteliselt vähe uuritud.
Samuti tekib küsimus, mida kasutada oksüdeeriva ainena. Kui metaan oksüdeeritakse puhta hapnikuga, suurenevad kapitaliinvesteeringud ja sünteesgaasi maksumus ning õhu kasutamisel on kõrge lämmastikusisaldusega (vähemalt 50-60% mahust) "halb" madala kvaliteediga sünteesgaas. saadud.
Tootmise majandusliku efektiivsuse ja tootekvaliteedi tõstmisele suunatud keskkonnakaitsetööstuse arengu peamised suundumused on seotud tooraine, energia säästmise ja kapitalikulude vähendamisega. Neist olulisemad on järgmised:
1. Uute tehnoloogiliste protsesside loomine, mis põhinevad kättesaadavamatel ja odavamatel toorainetel. Näiteks üleminek kallilt atsetüleenilt aromaatsete ainete, alkeenide, alkaanide ja lõpuks sünteesigaaside juurde vastavalt nende väärtusskaalale:
2. Üleminek otsestele sünteesimeetoditele, välja arvatud anorgaaniliste reaktiivide tarbimine. Näiteks etüleeni väävelhappehüdraatimise asendamine otsese katalüütilise hüdratsiooniga etanooli tootmisel.
3. Protsesside selektiivsuse suurendamine parameetrite optimeerimise, seadmete valiku ja väga selektiivsete katalüsaatorite valiku kaudu.
4. Tootmisetappide arvu vähendamine. Näiteks atseetaldehüüdi etüleenist etanooli kaudu sünteesimise kaheetapilise protsessi asendamine üheetapilise oksüdatiivse protsessiga:

5. Seadmete ühikuvõimsuse suurendamine ja sellest tulenevalt kapitalikulude vähendamine. Näiteks metanooli tootmisel kuni 300--500 tuhat tonni aastas.
6. Energiasääst ja sõlmede efektiivsuse tõstmine, eelkõige sekundaarsete energiaressursside kasutamise ja energiatehnoloogiliste skeemide juurutamise kaudu.
Sünteesgaas alternatiivina naftale
Pärast 1945. aastat puudus naftatootmise kiire arengu ja naftahinna languse tõttu vajadus sünteesida CO-st ja H 2 -st orgaanilisi aineid. Naftakeemia buum on saabunud. 1973. aastal aga puhkes naftakriis – naftat tootvad OPEC-i (Naftat Eksportivate Riikide Organisatsiooni) riigid tõstsid järsult toornafta hindu ning maailma üldsus oli sunnitud mõistma reaalset ammendumise ohtu lähitulevikus. odavad ja taskukohased naftavarud. 70ndate energiašokk äratas teadlaste ja töösturite huvi naftale alternatiivsete toorainete kasutamise vastu ning siin on esikohal kahtlemata kivisüsi. Maailma kivisöevarud on tohutud, need on erinevatel hinnangutel üle 50 korra suuremad kui naftavarud ja neid võib jätkuda sadadeks aastateks. Pole kahtlust, et sünteesgaasi kasutamine mängib lähitulevikus orgaanilise sünteesi jaoks võtmerolli. Praegu toodetakse bensiini, gaasiõli ja parafiine tööstuslikus mastaabis Fischer-Tropschi meetodil ainult Lõuna-Aafrikas. Sasoli tehased toodavad umbes 5 miljonit tonni vedelaid süsivesinikke aastas.
CO- ja H2-l põhinevate sünteeside uurimise intensiivistumise peegeldus on ühe süsiniku molekulide keemiale (nn C 1 -keemia) pühendatud publikatsioonide järsk kasv. Alates 1984. aastast ilmub rahvusvaheline ajakiri "C 1 -Molecule Chemistry". Seega oleme tunnistajaks söekeemia ajaloos saabuvale renessansile. Vaatleme mõningaid sünteesgaasi muundamise viise, mille tulemusel tekivad nii süsivesinikud kui ka mõned väärtuslikud hapnikku sisaldavad ühendid. Kõige olulisem roll CO transformatsioonides on heterogeensel ja homogeensel katalüüsil.
Sünteesgaasi tootmine
Esimene viis sünteesgaasi saamiseks oli kivisöe gaasistamine, mis viidi läbi 19. sajandi 30ndatel Inglismaal, et saada põlevaid gaase: vesinikku, metaani, süsinikmonooksiidi. Seda protsessi kasutati paljudes riikides laialdaselt kuni 1950. aastate keskpaigani, mil see asendati maagaasil ja naftal põhinevate meetoditega. Seoses naftavarude vähenemisega hakkas aga taas tõusma gaasistamisprotsessi tähtsus.
Praegu on sünteesgaasi saamiseks kolm peamist tööstuslikku meetodit.
1. Söe gaasistamine. Protsess põhineb kivisöe ja veeauru koostoimel:
See reaktsioon on endotermiline, tasakaal nihkub paremale temperatuuril 900-1000°. On välja töötatud tehnoloogilised protsessid, mis kasutavad auru-hapniku puhumist, milles koos ülaltoodud reaktsiooniga toimub söe põlemise eksotermiline reaktsioon, mis tagab vajaliku soojusbilansi:
2. Metaani muundamine. Metaani ja veeauru interaktsiooni reaktsioon viiakse läbi nikkelkatalüsaatorite (Ni-Al2O3) juuresolekul kõrgendatud temperatuuril (800-900°) ja rõhul:
Metaani asemel võib lähteainena kasutada mis tahes süsivesinike lähteainet.
3. Süsivesinike osaline oksüdatsioon. Protsess seisneb süsivesinike mittetäielikus termilises oksüdatsioonis temperatuuril üle 1300°:
Meetod on rakendatav mis tahes süsivesinike lähteaine jaoks, kuid kõige sagedamini kasutatakse tööstuses kõrge keemistemperatuuriga õli fraktsiooni - kütteõli.
CO:H2 suhe sõltub oluliselt sünteesgaasi saamiseks kasutatud meetodist. Söe gaasistamisel ja osalisel oksüdatsioonil on see suhe ligilähedane 1:1, samas kui metaani muundamise korral on CO:H2 suhe 1: 3. Praegu arendatakse maa-aluseid gaasistamisprojekte, see tähendab söe gaasistamist otse kihis. Huvitav on see, et seda ideed väljendas D.I. Mendelejev üle 100 aasta tagasi. Tulevikus saadakse sünteesgaasi gaasistades mitte ainult kivisütt, vaid ka muid süsinikuallikaid, sealhulgas linna- ja põllumajandusjäätmeid.
Süntees süsinikmonooksiidi baasil
Arvukad süsinikmonooksiidil ja vesinikul põhinevad sünteesid pakuvad nii praktilist kui ka teoreetiliselt suurt huvi, kuna need võimaldavad saada kahest lihtsast ainest kõige väärtuslikumad orgaanilised ühendid. Ja siin mängib otsustavat rolli siirdemetallide katalüüs, mis on võimeline aktiveerima inertseid CO ja H2 molekule. Molekulide aktiveerimine on nende üleviimine reaktiivsesse olekusse. Eraldi tuleb märkida, et sünteesgaasi muundamisel on laialdaselt välja töötatud uut tüüpi katalüüsi, siirdemetallide komplekside katalüüsi või metallikompleksi katalüüsi.
Märkigem mitmeid olulisi võtmereaktsioone metallikompleksi katalüüsis. Need on peamiselt oksüdatiivse lisamise ja redutseeriva eliminatsiooni reaktsioonid. Oksüdatiivne liitumine on neutraalsete A-B molekulide, nagu H2 või halogeen, lisamise reaktsioon kompleksi metallikeskmele. Sel juhul metall oksüdeerub, millega kaasneb selle koordinatsiooninumbri suurenemine. Selle lisamisega kaasneb A-B sideme lõhenemine.
Väga oluline on vesiniku molekuli oksüdatiivse lisamise reaktsioon, mille tulemusena toimub selle aktiveerimine. Vesiniku oksüdatiivse lisamise reaktsioon ühevalentse iriidiumi ruudukujulisele tasapinnalisele kompleksile, mille avastasid Vasco ja Dilucio, on laialt tuntud. Selle tulemusena tõuseb iriidiumi oksüdatsiooniaste I-lt III-le.
Oksüdatiivse lisamise pöördreaktsiooni nimetatakse redutseerivaks eliminatsiooniks, mille käigus vähendatakse metalli oksüdatsiooniastet ja koordinatsiooniarv kahe võrra.
Märgime ka migratsiooni sisestamise reaktsiooni, mis seisneb küllastumata ühendite sisestamises läbi metall-süsinik ja metall-vesiniksidemete. CO sisseviimise reaktsioon on paljude sünteesgaasi hõlmavate protsesside võtmeks.
Olefiinide kasutuselevõtt on olefiinide katalüütiliste muundumiste hulgas kõige olulisem reaktsioon: hüdrogeenimine, hüdroformüülimine jne.
Fischer-Tropschi süntees
Fischeri-Tropschi sünteesi võib vaadelda kui süsinikmonooksiidi redutseerivat oligomerisatsioonireaktsiooni, mille käigus moodustuvad süsinik-süsinik sidemed, ja üldiselt on see mitmete heterogeensete reaktsioonide kompleksne kombinatsioon, mida saab esitada üldiste võrranditega:
Reaktsiooniproduktideks on alkaanid, alkeenid ja hapnikku sisaldavad ühendid, st moodustub polümerisatsioonireaktsioonile iseloomulik kompleksne saaduste segu. Fischer-Tropschi sünteesi põhiproduktid on a- ja b-olefiinid, mis järgneva hüdrogeenimise tulemusena muudetakse alkaanideks. Kasutatava katalüsaatori iseloom, temperatuur, CO ja H 2 suhe mõjutavad oluliselt toodete jaotumist. Seega on raudkatalüsaatorite kasutamisel suur olefiinide osakaal, samas kui hüdrogeeniva aktiivsusega koobaltkatalüsaatorite puhul tekivad valdavalt küllastunud süsivesinikud.
Praegu kasutatakse olenevalt püstitatud ülesannetest (bensiinifraktsiooni saagise suurendamine, madalamate olefiinide saagise suurendamine jne) katalüsaatoritena nii alumiiniumi, räni ja magneesiumi oksiididel kandvaid kõrgdispersseid raudkatalüsaatoreid kui ka bimetallkatalüsaatoreid. Fischer-Tropsch süntees: raud - mangaan, raud-molübdeen jne.
Olefiinide hüdroformüülimine
Üks olulisemaid näiteid sünteesgaasi hõlmavatest tööstusprotsessidest on hüdroformüülimisreaktsioon (oksosüntees). 1938. aastal avastas Relin Fischer-Tropschi sünteesimehhanismi uurides selle tähelepanuväärse reaktsiooni, mille olulisust on vaevalt võimalik üle hinnata. Selles protsessis alkeenid katalüsaatorite, peamiselt koobalti või roodiumi juuresolekul rõhul üle 100 atm ja temperatuuril 140-180 °C. interakteeruvad sünteesgaasiga ja muutuvad aldehüüdideks - olulisemateks vaheühenditeks alkoholide, karboksüülhapete, amiinide, mitmehüdroksüülsete alkoholide jne tootmisel. Hüdroformüülimisreaktsiooni tulemusena saadakse sirge ja hargnenud ahelaga aldehüüdid, mis sisaldavad ühte süsinikku aatomit rohkem kui algses molekulis:
Kõige väärtuslikumad on tavalised aldehüüdid, samas kui isoaldehüüde võib pidada soovimatuteks kõrvalsaadusteks. Maailmas toodetakse hüdroformüülimise teel aldehüüde 7 miljoni tonnini aastas, samas kui umbes poole moodustab n-butüüraldehüüd, millest saadakse n-butüülalkohol. Aldooli kondenseerimisel, millele järgneb hüdrogeenimine, saadakse 2-etüülheksanool, mida kasutatakse PVC plastifikaatorite tootmisel.
Hüdroformüülimise katalüsaatoritena kasutatakse enim koobaltkarbonüüle, viimasel ajal on kirjeldatud roodiumkatalüsaatorite kasutamist, mis võimaldavad protsessi läbi viia leebemates tingimustes.
väljavaated
Suure tähtsusega on 1920. aastatel meisterdatud keemiatööstuse tähtsaimast tootest, sünteesgaasist metanooli saamise protsess. Samas tundub väga ahvatlev olevat ka teiste hapnikku sisaldavate ühendite otsene süntees sünteesgaasist. Kirjeldab sünteesgaasi kasutamist alkoholide saamiseks koostisega C1-C4 (madalamad alkoholid), millest seejärel saadakse dehüdratsiooni teel madalamad olefiinid. 1970. aastatel pakuti välja keerulise koostisega katalüsaatorid, mis koosnesid vase-, koobalti-, kroomi-, vanaadiumi-, mangaani- ja leelismetallisooladest, mis võimaldasid saada normaalse koostisega C1-C4 alkohole. sünteesgaasist temperatuuril 250? ja rõhk ainult 6 atm.
Kirjanduses on kirjeldatud erinevate hapnikku sisaldavate ühendite teket sünteesgaasist, näiteks: atseetaldehüüd, äädikhape, etüleenglükool jne.
Kõik need reaktsioonid tunduvad olevat üsna reaalsed. Kahjuks ei suuda need meetodid praegu konkureerida juba omandatud tööstusprotsessidega, kuna need toimivad väga karmides tingimustes ja vähese selektiivsusega. Võib loota, et sünteesgaasi tööstuslikuks kasutamiseks uute tõhusate meetodite otsimine jätkub intensiivselt ning pole kahtlust, et sellel alal on suur tulevik.
ALTERNATIIVSETEST SÜSIVESIKUTE ALLIKATE LOENGUKURSUS
JUHTIMINE
Põhilise orgaanilise sünteesi tööstus on nii keemia- kui ka naftakeemia tootmise üks olulisemaid harusid. Peamine orgaaniline süntees hõlmab monomeeride tootmist tehiskiudude, plastide, sünteetiliste kummide, pindaktiivsete ainete, sünteetiliste väetiste, lahustite ja paljude muude toodete tootmiseks, mis on vajalikud iga riigi normaalseks toimimiseks ja majanduse arenguks. Lisaks keemiatoodetele kulub ettevõtete, elamufondi ja transpordi majandustegevuse säilitamiseks üle maailma tohutul hulgal süsivesinike toorainet kütuse- ja energiakompleksi toimimiseks. Seetõttu on tooraine tootmise üks peamisi elemente ja määrab suuresti tööstuse ulatuse, tehnoloogia ja ökonoomika. Sellega seoses koolitatakse keemia- ja keemiatehnika osakonnas juba spetsialiste suunas - orgaaniliste ainete ja kütuste (sealhulgas alternatiivsete) tehnoloogia.
CHTO TÖÖSTUSE TOORMATERJALALLIKAD
On mineraalseid (taastumatuid) ja taastuvaid süsivesinike tooraineid. mineraalseks Siia kuuluvad: kivisüsi, põlevkivi, tõrvaliivad, turvas, nafta ja maagaas – kui need on tekkinud orgaanilise päritoluga toodetest. Nende arvele võib omistada ka mitteorgaanilise päritoluga mineraalsetel allikatel põhineva atsetüleeni. Andmed mineraalveeallikate varude kohta on üsna vastuolulised, kuna neid on raske hinnata. Kindlalt on aga teada, et tahkete fossiilkütuste varud ületavad oluliselt nafta ja gaasi varusid. Geokeemikute arvutused näitavad, et erinevate fossiilkütuste suhe maapõues on (%):
Söed, kiltkivid ja tõrvaliivad - 81-95,8; Turvas - 3,4-5; Õli - 0,7-9,8 (90% kütusena); Maagaas - 0,1-4,4 (50-52% töödeldud elektriks)
Lisaks mineraalsele - ammendavatele energiaallikatele (kütus> 90%) ja keemilistele (5-8%) toorainetele on taastuvate allikate varud piiramatud - see on biomass. Seda taastoodetakse spontaanselt, sõltumata inimtegevusest, ligikaudu 200 miljardi tonni ulatuses koguenergiapotentsiaaliga 3 vaid ühe aastaga. 10 21 J, mis on ~ 10 korda suurem kui maailma fossiilkütuste tootmise maht. Kogu biomassist moodustub ~ 40 miljardit tonni puiduna, ~ 30 miljardit tonni elusorganismide kujul (~ 10 miljardit tonni rasvkudesid) ja ~ 2-3 miljardit tonni õlina. -sisaldavad komponente õli moodustavates tehastes (võrdluseks, mitmete andmete kohaselt on maailma naftavarud praegu hinnanguliselt umbes 90 miljardit tonni). See ületab kõik uuritud mineraalsete toorainete varud, kuid nende kogumine on keeruline ja töötlemistehnoloogiad on eksperimentaalse või katsetööstusliku uurimistöö staadiumis. Sellega seoses on täna kõige vastuvõetavamad ja odavamad allikad riigi kütuse-, energia- ja keemiavajaduste rahuldamiseks: nafta, looduslikud ja seonduvad gaasid, samuti rafineerimistehaste gaasid. Siiski tuleb märkida, et edaspidi trend muutub seoses ülaltoodud maavarade varude ammendumise tõttu.
Enamiku riikide kaasaegne areng viimastel aastatel toimub üldise majanduskriisi kontekstis, eelkõige energia ja tooraine osas. Kuigi praegu on nafta ja gaasi osatähtsus peamiste kapitalistlike riikide kütusebilansis märkimisväärne, ilmneb prognooside kohaselt üldine suundumus nende tarbimise vähendamisele ning kivisöe ja muude taastuvate süsivesinike osatähtsuse mõningane suurenemine.
Maailma naftatarbimine ulatus 1970. aastal ~3 miljardi tonnini, 1990. aastal ulatus see väärtus ~ 4 - 4,5 miljardi tonnini aastas. 2000. aastal töödeldi juba ~ 5 miljardit tonni, 2020. aastal plaanitakse töödelda ~ 6 ja enam miljardit tonni. Sellel tasemel (ja see kasvab pidevalt) on nende reservide eluiga umbes 90/5=16 aastat. ?????? See muidugi ei tähenda, et selle aja jooksul ammendub kogu nafta maa peal, kuid see näitab, et praegune, seni veel jõukas riik maailmaturul on ilmne. (Seda on selgelt näha naftakatkestustes meie riigis ja eriti NYANPZ-is, mille toodang Slav-Neft ettevõtte poolt 2015. aastal ulatus 20 miljoni tonnini aastas, ja töötlemine NYANPZ-is kõige edukamal 2015. aastal viimase 10 aasta jooksul oli 13-14 miljonit tonni aastas, tehase võimsusega 15-16 miljonit tonni aastas) Võrdluseks võib öelda, et 2020. aastal on Venemaal oodatav nafta tootmine ja rafineerimine mitte rohkem kui 500 miljonit tonni, mis on vähem kui 1980. aastal – 610 miljonit tonni
Venemaa gaasitööstus on suhteliselt noor kütuse- ja energiatööstuse haru, mis on arenenud kiires tempos ja juba 1990. a. maagaasi toodang moodustas 850 miljardit m 3 . 2015. aastal jääb tootmine kütuse- ja energiakriisi tõttu samale tasemele (või veidi allapoole). 2015. aasta lõpuks ulatus gaasivarude defitsiit 20 miljardi m3ni ning 2016-2017 lõpuks kasvab see 45-50 miljardi m3-ni. Praegune gaasi hind (seisuga 1. jaanuar 2016) on ~ 280-320 USD. 1 tuhande m 3 eest. (seni on see 2-3 korda odavam kui kütteõli ja kivisüsi, kuid hindade tõusutendents on ilmne). Selle põhjuseks on asjaolu, et uute gaasimaardlate väljaarendamine võtab aega 7–10 aastat ning kallinevad uuringu-, tootmis- ja transpordihinnad.
KAASAEGSED TRENDID NAFTAKEEMILISTE SÜNTEESI TÖÖSTUSE ARENGUS JA ALTERNATIIVSETE SÜSIVESIINIKE ALLIKATE KASUTAMISE EFEKTIIVSUS
Nafta ja gaasi piiratud varud on tekitanud nafta rafineerimise ja naftakeemia jaoks uusi olulisi probleeme:
nafta rafineerimisprotsesside süvendamine koos maksimaalse kergete naftatoodete valikuga;
nafta kasutamise laiendamine naftakeemiatööstuse lähteainena ja vähemal määral kütusena (sh elektrijaamad ja küttejaamad);
kivisöe laialdane kasutamine katla kütusena (gaasi ja nafta asemel, kuna selle varud on suured);
kütuse ja elektrienergia ratsionaalne kasutamine nafta rafineerimise ja naftakeemia kaasaegsetes protsessides;
aatomienergia kasutamine nafta rafineerimisel ja naftakeemias;
sünteetiliste vedelkütuste ja maagaasi asendajate tootmise protsesside arendamine (söe baasil);
mitmete naftakeemiatoodete tootmise üleviimine toorsöele.
Praegu arendatakse laialdaselt ka alternatiivsete kütuste tootmisprotsesse. Need sisaldavad:
veeldatud ja surumaagaas (autode ja muude transpordiliikide kütusena);
veeldatud gaasid (sõidukite kütus);
sünteesgaasil põhinev metanool (tänapäeval kasutatakse seda juba edukalt otse kütusena või bensiinide lisandina, mis tõstab nende oktaaniarvu, ning töödeldakse ka (MTBe) metüül-tert-butüüleetri kõrge oktaanarvuga lisandiks, kõrge oktaanarvuga lisandiks. oktaanarvuga bensiin jne) ;
kivisöe gaasistamise teel toodetud maagaasi aseaine;
etüülalkohol (bensiini lisandina jne);
kaltsiumkarbiidil põhinev atsetüleen ja metaanpürolüüs (sellel põhinevad keemiatooted on mitmekesised, kuna atsetüleenil on 3 kaksiksidet ja see on väga reaktsioonivõimeline).