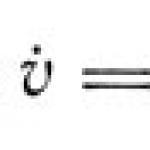Thermodynamics - sayansi ya mabadiliko ya aina moja ya nishati kuwa nyingine kwa misingi ya sheria ya uhifadhi wa nishati. Thermodynamics huanzisha mwelekeo wa mtiririko wa hiari wa athari za kemikali chini ya hali fulani. Katika athari za kemikali, vifungo katika vifaa vya kuanzia vinavunjwa na vifungo vipya vinatengenezwa katika bidhaa za mwisho. Jumla ya nguvu za dhamana baada ya majibu si sawa na jumla ya nguvu za dhamana kabla ya majibu, i.e. mwendo wa mmenyuko wa kemikali unaambatana na kutolewa au kunyonya kwa nishati, na fomu zake ni tofauti.
Thermochemistry ni tawi la thermodynamics inayojitolea kwa utafiti wa athari za joto za athari. Athari ya joto ya mmenyuko kipimo kwa joto la mara kwa mara na shinikizo inaitwa enthalpy ya majibu na huonyeshwa kwa joules (J) na kilojuli (kJ).
Kwa athari za exothermic, kwa endothermic -. Enthalpy ya malezi ya 1 mol ya dutu iliyotolewa kutoka kwa vitu rahisi, kipimo kwa joto la 298 K (25 ° C) na shinikizo la 101.825 kPa (1 atm), inaitwa kiwango (kJ / mol). Enthalpies ya vitu rahisi huchukuliwa kwa masharti sawa na sifuri.
Mahesabu ya thermochemical yanategemea sheria ya Hess: t Athari ya joto ya mmenyuko inategemea tu asili na hali ya kimwili ya vitu vya awali na bidhaa za mwisho, lakini haitegemei njia ya mpito. Mara nyingi katika mahesabu ya thermochemical, matokeo kutoka kwa sheria ya Hess hutumiwa: athari ya joto ya mmenyuko wa kemikali ni sawa na jumla ya joto la malezi bidhaa za majibu ukiondoa jumla ya joto la malezi ya vitu vya kuanzia, kwa kuzingatia coefficients mbele ya fomula za vitu hivi katika equation ya majibu:
Katika equations thermochemical zinaonyesha thamani ya enthalpy ya mmenyuko wa kemikali. Wakati huo huo, formula ya kila dutu inaonyesha hali yake ya kimwili: gesi (g), kioevu (l), fuwele imara (k).
Katika equations za thermochemical, athari za joto za athari hutolewa kwa mole 1 ya dutu ya kuanzia au ya mwisho. Kwa hiyo, coefficients ya sehemu inaruhusiwa hapa. Katika athari za kemikali, sheria ya lahaja ya umoja na mapambano ya wapinzani inaonyeshwa. Kwa upande mmoja, mfumo huwa na kurahisisha (jumla) - kupunguza H, na kwa upande mwingine, kuvuruga (kugawanyika). Mwelekeo wa kwanza huongezeka kwa kupungua kwa joto, na pili - na ongezeko lake. Tabia ya machafuko ina sifa ya wingi unaoitwa entropy S[J/(mol. K)]. Ni kipimo cha uharibifu wa mfumo. Entropy ni sawia na kiasi cha maada na huongezeka kwa kuongezeka kwa harakati ya chembe wakati wa joto, uvukizi, kuyeyuka, upanuzi wa gesi, kudhoofisha au kuvunja vifungo kati ya atomi, nk. Taratibu zinazohusiana na utaratibu wa mfumo: condensation, crystallization, compression, kuimarisha vifungo, upolimishaji, nk. kusababisha kupungua kwa entropy. Entropy ni kazi ya serikali, i.e.
Nguvu ya jumla ya kuendesha mchakato ina nguvu mbili: hamu ya utaratibu na hamu ya machafuko. Kwa p = const na T = const, nguvu ya jumla ya kuendesha mchakato inaweza kuwakilishwa kama ifuatavyo:
![]()
Nishati ya Gibbs, au uwezo wa isobaric-isothermal, pia hutii ufuataji wa sheria ya Hess:
Michakato huendelea kwa hiari, kwenda kwa mwelekeo wa kupunguza uwezo wowote na, haswa, katika mwelekeo wa kupungua. Kwa usawa, hali ya joto ambayo mmenyuko wa usawa huanza ni:
Jedwali 5
Enthalpies ya kawaida ya malezi , entropy na elimu ya nishati ya Gibbs baadhi ya dutu katika 298 K (25°C)
| Dawa | , kJ/mol | , J/mol | , kJ/mol |
| CaO (c) | -635,5 | 39,7 | -604,2 |
| CaCO 3 (c) | -1207,0 | 88,7 | -1127,7 |
| Ca (OH) 2 (c) | -986,6 | 76,1 | -896,8 |
| H 2 O (l) | -285,8 | 70,1 | -237,3 |
| H 2 O (g) | -241,8 | 188,7 | -228,6 |
| Na 2 O (c) | -430,6 | 71,1 | -376,6 |
| NaOH (c) | -426,6 | 64,18 | -377,0 |
| H 2 S (g) | -21,0 | 205,7 | -33,8 |
| SO 2 (g) | -296,9 | 248,1 | -300,2 |
| SO 3 (g) | -395,8 | 256,7 | -371,2 |
| C 6 H 12 O 6 (hadi) | -1273,0 | - | -919,5 |
| C 2 H 5 OH (l) | -277,6 | 160,7 | -174,8 |
| CO 2 (g) | -393,5 | 213,7 | -394,4 |
| CO(g) | -110,5 | 197,5 | -137,1 |
| C 2 H 4 (g) | 52,3 | 219,4 | 68,1 |
| CH 4 (g) | -74,9 | 186,2 | -50,8 |
| Fe 2 O 3 (c) | -822,2 | 87,4 | -740,3 |
| FeO (c) | -264,8 | 60,8 | -244,3 |
| Fe 3 O 4 (hadi) | -1117,1 | 146,2 | -1014,2 |
| CS 2 (g) | 115,3 | 65,1 | 237,8 |
| P 2 O 5 (c) | -1492 | 114,5 | -1348,8 |
| NH 4 Cl (hadi) | -315,39 | 94,56 | -343,64 |
| HCl (g) | -92,3 | 186,8 | -95,2 |
| NH 3 (g) | -46,2 | 192,6 | -16,7 |
| N 2 O (g) | 82,0 | 219,9 | 104,1 |
| HAPANA (g) | 90,3 | 210,6 | 86,6 |
| NO 2 (g) | 33,5 | 240,2 | 51,5 |
| N 2 O 4 (g) | 9,6 | 303,8 | 98,4 |
| CuO(k) | -162,0 | 42,6 | -129,9 |
| H 2 (g) | 130,5 | ||
| C (graphite) | 5,7 | ||
| O 2 (g) | 205,0 | ||
| N 2 (d) | 181,5 | ||
| Fe(k) | 27,15 | ||
| Cl 2 (g) | 222,9 | ||
| KNO 3 (hadi) | -429,71 | 132,93 | -393,13 |
| KNO 2 (k) | -370,28 | 117,15 | -281,58 |
| K 2 O (hadi) | -361,5 | 87,0 | -193,3 |
| ZnO (c) | -350,6 | 43,6 | -320,7 |
| Al 2 O 3 (hadi) | -1676,0 | 50,9 | -1582,0 |
| PCl 5 (g) | -369,45 | 362,9 | -324,55 |
| PCl 3 (g) | -277,0 | 311,7 | -286,27 |
| H 2 O 2 (l) | -187,36 | 105,86 | -117,57 |
Mwitikio wa kasi imedhamiriwa na asili na mkusanyiko wa viitikio na inategemea joto na kichocheo.
Sheria ya hatua ya wingi: Kwa joto la mara kwa mara, kiwango cha mmenyuko wa kemikali ni sawa na bidhaa ya mkusanyiko wa reactants na nguvu ya coefficients yao ya stoichiometric.
Kwa majibu aA + bB \u003d cC + dD, kiwango cha majibu ya moja kwa moja:
![]() ,
,
kiwango cha majibu ya nyuma: ![]() , uko wapi viwango vya misombo iliyoyeyushwa au gesi, mol / l;
, uko wapi viwango vya misombo iliyoyeyushwa au gesi, mol / l;
a, b, c, d ni mgawo wa stoichiometric katika equation;
K ni kiwango cha mara kwa mara.
Usemi wa kasi ya majibu haujumuishi mkusanyiko wa awamu dhabiti.
Athari ya joto kwenye kiwango cha mmenyuko inaelezwa na kanuni ya van't Hoff: kwa kila digrii 10 za joto, kiwango cha majibu huongezeka kwa mara 2-4.
Kiwango cha majibu kwa joto t 1 na t 2;
Mgawo wa joto wa majibu.
Athari nyingi za kemikali zinaweza kutenduliwa:
aA + bB cC + dD
uwiano wa viwango vya viwango ni thamani ya mara kwa mara inayoitwa usawa mara kwa mara
![]() K p = const kwa T = const.
K p = const kwa T = const.
Kanuni ya Le Chatelier: Ikiwa athari yoyote itatolewa kwenye mfumo katika hali ya usawa wa kemikali (mabadiliko ya joto, shinikizo au mkusanyiko), basi mfumo utaitikia kwa njia ya kupunguza athari inayotumika:
a) na ongezeko la joto katika mifumo ya usawa, mabadiliko ya usawa kuelekea mmenyuko wa mwisho wa joto, na kwa kupungua kwa joto, kuelekea mmenyuko wa exothermic;
b) wakati shinikizo linaongezeka, usawa hubadilika kuelekea kiasi kidogo, na wakati shinikizo linapungua, kuelekea kiasi kikubwa;
c) wakati mkusanyiko unapoongezeka, usawa hubadilika kwa mwelekeo wa kupungua kwake.
Mfano 1 Amua mabadiliko ya kawaida ya enthalpy:
Je, majibu haya ni ya nje ya joto au ya mwisho joto?
Suluhisho: Mabadiliko ya kawaida ya enthalpy ya mmenyuko wa kemikali ni sawa na jumla ya enthalpies ya kawaida ya malezi ya bidhaa za mmenyuko ukiondoa jumla ya enthalpies ya kawaida ya malezi ya viitikio.
Katika kila majumuisho, idadi ya moles ya vitu vinavyohusika katika mmenyuko inapaswa kuzingatiwa kwa mujibu wa equation ya majibu. Enthalpies ya kawaida ya malezi ya vitu rahisi ni sifuri:
Kulingana na data ya jedwali:
Majibu ambayo yanaambatana na kutolewa kwa joto huitwa exothermic, na yale ambayo yanaambatana na kunyonya joto huitwa endothermic. Kwa joto la mara kwa mara na shinikizo, mabadiliko katika enthalpy ya mmenyuko wa kemikali ni sawa kwa ukubwa, lakini kinyume katika ishara, kwa athari yake ya joto. Kwa kuwa mabadiliko ya kawaida katika enthalpy ya mmenyuko fulani wa kemikali ni , tunahitimisha kuwa mmenyuko huu ni wa joto.
Mfano 2 Mmenyuko wa kupunguza Fe 2 O 3 na hidrojeni huendelea kulingana na equation:
Fe 2 O 3 (K) + 3H 2 (G) \u003d 2Fe (K) + 3H 2 O (G)
Mwitikio huu unawezekana chini ya hali ya kawaida?
Suluhisho: Ili kujibu swali hili la tatizo, unahitaji kuhesabu mabadiliko ya kawaida katika nishati ya Gibbs ya majibu. Chini ya hali ya kawaida:
Muhtasari unafanywa kwa kuzingatia idadi ya mifano inayohusika katika mmenyuko wa vitu, uundaji wa urekebishaji thabiti zaidi wa dutu rahisi huchukuliwa sawa na sifuri.
Kwa kuzingatia hapo juu
Kulingana na data ya jedwali:

Michakato inayoendelea moja kwa moja hupungua. Kama< 0, процесс принципиально осуществим, если >0, mchakato hauwezi kukimbia moja kwa moja.
Kwa hiyo, mmenyuko huu hauwezekani chini ya hali ya kawaida.
Mfano 3 Andika misemo ya sheria ya hatua kwa watu wengi kwa athari:
a) 2NO (G) + Cl 2 (G) = 2NOCl (G)
b) CaCO 3 (K) \u003d CaO (K) + CO 2 (G)
Suluhisho: Kulingana na sheria ya hatua ya wingi, kiwango cha majibu ni sawia moja kwa moja na bidhaa ya viwango vya viitikio kwa nguvu sawa na coefficients stoichiometric:
a) V \u003d k 2.
b) Kwa kuwa kalsiamu carbonate ni dutu ngumu, mkusanyiko wake haubadilika wakati wa majibu, usemi unaotaka utakuwa:
V = k, i.e. katika kesi hii, kiwango cha majibu kwa joto fulani ni mara kwa mara.
Mfano 4 Mmenyuko wa mwisho wa mtengano wa pentakloridi ya fosforasi huendelea kulingana na equation:
PCl 5 (G) \u003d PCl 3 (G) + Cl 2 (G); ![]()
Jinsi ya kubadilisha: a) joto; b) shinikizo; c) mkusanyiko ili kuhamisha usawa kuelekea mmenyuko wa moja kwa moja - utengano wa PCl 5? Andika usemi wa kihisabati kwa viwango vya miitikio ya mbele na ya nyuma, pamoja na viasili vya usawa.
Suluhisho: Mabadiliko au mabadiliko ya usawa wa kemikali ni badiliko la viwango vya usawa vya viitikio kama matokeo ya mabadiliko katika mojawapo ya hali ya mmenyuko.
Mabadiliko ya usawa wa kemikali yanatii kanuni ya Le Chatelier, kulingana na ambayo mabadiliko katika mojawapo ya masharti ambayo mfumo uko katika usawa husababisha mabadiliko ya usawa katika mwelekeo wa majibu ambayo yanapingana na mabadiliko ya derivative.
a) Kwa kuwa mmenyuko wa mtengano wa PCl 5 ni endothermic, kisha kuhamisha usawa kuelekea mmenyuko wa moja kwa moja, ni muhimu kuongeza joto.
b) Kwa kuwa mtengano wa PCl 5 katika mfumo huu husababisha kuongezeka kwa kiasi (molekuli mbili za gesi huundwa kutoka molekuli moja ya gesi), kisha kuhamisha usawa kuelekea mmenyuko wa moja kwa moja, ni muhimu kupunguza shinikizo.
c) Mabadiliko ya usawa katika mwelekeo ulioonyeshwa yanaweza kupatikana wote kwa kuongeza mkusanyiko wa PCl 5 na kwa kupunguza mkusanyiko wa PCl 3 au Cl 2.
Kulingana na sheria ya hatua ya wingi, viwango vya athari za moja kwa moja (V 1) na kinyume (V 2) vinaonyeshwa na milinganyo:
V 2 \u003d k
Usawa wa mara kwa mara wa mmenyuko huu unaonyeshwa na equation:
![]()
Kazi za kudhibiti:
81 - 100. a) kuhesabu mabadiliko ya kawaida katika enthalpy ya mmenyuko wa moja kwa moja na kuamua ikiwa majibu haya ni ya nje au ya mwisho;
b) kuamua mabadiliko katika nishati ya Gibbs ya mmenyuko wa moja kwa moja na kuteka hitimisho kuhusu uwezekano wa utekelezaji wake chini ya hali ya kawaida;
c) kuandika usemi wa hisabati kwa kiwango cha athari za mbele na za nyuma, pamoja na viwango vya usawa;
d) masharti yanapaswa kubadilishwa vipi ili kuhamisha usawa wa mchakato kwenda kulia?
81. CH 4 (g) + CO 2 (g) \u003d 2CO (g) + 2H 2 (g)
82. FeO (K) + CO (g) \u003d Fe (K) + CO 2 (g)
83. C 2 H 4 (g) + O 2 (g) \u003d CO 2 (g) + H 2 O (g)
84. N 2 (g) + 3H 2 (g) \u003d 2NH 3 (g)
85. H 2 O (g) + CO (g) \u003d CO 2 (g) + H 2 (g)
86. 4HCl (g) + O 2 (g) \u003d 2H 2 O (g) + 2Cl 2 (g)
87. Fe 2 O 3 (K) + 3H 2 (g) \u003d 2Fe (K) + 3H 2 O (g)
88. 2SO 2 (g) + O 2 (g) \u003d 2SO 3 (g)
89. PCl 5 (g) \u003d PCl 3 (g) + Cl 2 (g)
90. CO 2 (g) + C (graphite) \u003d 2CO (g)
91. 2H 2 S (g) + 3O 2 (g) \u003d 2SO 2 (g) + H 2 O (g)
92. Fe 2 O 3 (K) + CO (g) \u003d 2FeO (K) + CO 2 (g)
93. 4NH 3 (g) + 5O 2 (g) \u003d 4NO (g) + 6H 2 O (g)
94. NH 4 Cl (K) = NH 3 (g) + HCl (g)
95. CH 4 (g) + 2O 2 (g) \u003d CO 2 (g) + 2H 2 O (g)
96. CS 2 (g) + 3O 2 (g) \u003d CO 2 (g) + 2SO 2 (g)
97. 4HCl (g) + O 2 (g) \u003d 2Cl 2 (g) + 2H 2 O (g)
98. 2 HAPANA (g) + O 2 (g) \u003d N 2 O 4 (g)
99. NH 3 (g) + HCl (g) \u003d NH 4 Cl (K)
100. CS 2 (g) + 3O 2 (g) \u003d 2Cl 2 (g) + 2SO 2 (g)
Mada ya 6: Suluhu. Njia za kuelezea mkusanyiko wa suluhisho
Ufumbuzi ni mifumo ya homogeneous inayojumuisha kutengenezea, vimumunyisho na bidhaa zinazowezekana za mwingiliano wao. Mkusanyiko wa suluhisho ni maudhui ya solute katika molekuli fulani au kiasi kinachojulikana cha ufumbuzi au kutengenezea.
Njia za kuelezea mkusanyiko wa suluhisho:
Sehemu ya wingi() inaonyesha idadi ya gramu ya solute katika 100 g ya suluhisho:
wapi T ni wingi wa dutu iliyoyeyushwa (g), T 1 - wingi wa suluhisho (g).
Mkusanyiko wa Molar inaonyesha idadi ya moles ya solute iliyo katika lita 1 ya suluhisho:
ambapo M ni molekuli ya molar ya dutu (g / mol), V ni kiasi cha suluhisho (l).
Mkusanyiko wa Molar inaonyesha idadi ya moles ya solute iliyo katika 1000 g ya kutengenezea: p 101-120. Pata sehemu ya misa, mkusanyiko wa molar, mkusanyiko wa molar kwa suluhisho zifuatazo:
| Chaguo | Dawa (x) | Uzito wa dutu (x) | Kiasi cha maji | Uzito wa Suluhisho |
| CuSO4 | 320 g | 10 l | 1,019 | |
| NaCl | 0.6 g | 50 ml | 1,071 | |
| H2SO4 | 2 g | 100 ml | 1,012 | |
| Na2SO4 | 13 g | 100 ml | 1,111 | |
| HNO3 | 12.6 g | 100 ml | 1,066 | |
| HCl | 3.6 kg | 10 kg | 1,098 | |
| NaOH | 8 g | 200 g | 1,043 | |
| MgCl 2 | 190 g | 810 g | 1,037 | |
| KOH | 224 g | 776 g | 1,206 | |
| CuCl 2 | 13.5 g | 800 ml | 1,012 | |
| HCl | 10.8 g | 200 g | 1,149 | |
| CuSO4 | 8 g | 200 ml | 1,040 | |
| NaCl | 6.1 g | 600 ml | 1,005 | |
| Na2SO3 | 4.2 g | 500 ml | 1,082 | |
| H2SO4 | 98 g | 1000 ml | 1,066 | |
| ZnCl 2 | 13.6 g | 100 ml | 1,052 | |
| H3PO4 | 9.8 g | 1000 ml | 1,012 | |
| Ba(OH)2 | 100 g | 900 g | 1,085 | |
| H3PO4 | 29.4 g | 600 ml | 1,023 | |
| NaOH | 28 g | 72 g | 1,309 |
1. Kiwango cha athari za kemikali. Ufafanuzi wa dhana. Mambo yanayoathiri kiwango cha mmenyuko wa kemikali: mkusanyiko wa reagent, shinikizo, joto, uwepo wa kichocheo. Sheria ya hatua ya molekuli (LMA) kama sheria ya msingi ya kinetiki ya kemikali. Kiwango cha mara kwa mara, maana yake ya kimwili. Ushawishi juu ya kasi ya mmenyuko mara kwa mara ya asili ya viitikio, joto na uwepo wa kichocheo.
Kiwango cha mmenyuko wa homogeneous ni kiasi cha nambari sawa na mabadiliko katika mkusanyiko wa molar ya mshiriki yeyote katika majibu kwa kila wakati wa kitengo.
Kiwango cha wastani cha mmenyuko v cf katika muda kutoka t 1 hadi t 2 imedhamiriwa na uwiano:
Sababu kuu zinazoathiri kiwango cha mmenyuko wa kemikali wa homogeneous ni:
- - asili ya reactants;
- - viwango vya molar ya reagents;
- - shinikizo (ikiwa gesi zinahusika katika mmenyuko);
- - joto;
- - uwepo wa kichocheo.
Kiwango cha mmenyuko wa kitofauti ni thamani kiidadi sawa na mabadiliko ya kiasi cha kemikali cha mshiriki yeyote katika athari kwa kila wakati wa kitengo kwa kila eneo la kitengo cha kiolesura: .
Kwa hatua, athari za kemikali zimegawanywa kuwa rahisi (msingi) na ngumu. Athari nyingi za kemikali ni taratibu ngumu zinazotokea katika hatua kadhaa, i.e. inayojumuisha michakato kadhaa ya kimsingi.
Kwa athari za kimsingi, sheria ya hatua ya wingi ni halali: kiwango cha mmenyuko wa kemikali ya msingi ni sawia moja kwa moja na bidhaa ya viwango vya viitikio kwa nguvu sawa na coefficients stoichiometric katika equation ya mmenyuko.
Kwa mmenyuko wa kimsingi aA + bB > ... kiwango cha athari, kulingana na sheria ya hatua ya wingi, inaonyeshwa na uhusiano:
ambapo c(A) na c(B) ni viwango vya molar ya viitikio A na B; a na b ni mgawo wa stoichiometric sambamba; k ndio kiwango kisichobadilika cha majibu haya.
Kwa athari tofauti, equation ya sheria ya hatua ya wingi haijumuishi viwango vya vitendanishi vyote, lakini ni gesi au kufutwa tu. Kwa hivyo, kwa majibu ya mwako wa kaboni:
C (c) + O 2 (g) > CO 2 (g)
equation ya kasi ina fomu:.
Maana ya kimwili ya kiwango kisichobadilika ni kwamba ni nambari sawa na kasi ya mmenyuko wa kemikali katika viwango vya viitikio sawa na 1 mol/dm 3 .
Thamani ya kiwango cha mara kwa mara cha mmenyuko wa homogeneous inategemea asili ya reactants, joto na kichocheo.
2. Athari ya joto kwenye kiwango cha mmenyuko wa kemikali. Mgawo wa joto wa kiwango cha mmenyuko wa kemikali. molekuli hai. Mkondo wa usambazaji wa molekuli kulingana na nishati yao ya kinetic. Nishati ya uanzishaji. Uwiano wa nishati ya kuwezesha na nishati ya dhamana ya kemikali katika molekuli za awali. Hali ya mpito, au changamano iliyoamilishwa. Nishati ya uanzishaji na athari ya joto ya mmenyuko (mpango wa nishati). Utegemezi wa mgawo wa joto wa kasi ya majibu kwa thamani ya nishati ya kuwezesha.
Kadiri hali ya joto inavyoongezeka, kiwango cha mmenyuko wa kemikali kawaida huongezeka. Thamani inayoonyesha ni mara ngapi kiwango cha athari huongezeka na ongezeko la joto kwa digrii 10 (au, ni nini sawa, na 10 K), inaitwa mgawo wa joto wa kiwango cha mmenyuko wa kemikali (r):

ambapo - maadili ya kiwango cha majibu, kwa mtiririko huo, kwa joto T 2 na T 1; r ni mgawo wa joto wa kasi ya majibu.
Utegemezi wa kasi ya mmenyuko kwenye halijoto ni takriban kuamuliwa na kanuni ya majaribio ya van't Hoff: kwa ongezeko la joto kwa kila digrii 10, kasi ya mmenyuko wa kemikali huongezeka kwa mara 2-4.
Maelezo sahihi zaidi ya utegemezi wa kasi ya majibu kwenye halijoto yanawezekana ndani ya mfumo wa nadharia ya kuwezesha Arrhenius. Kwa mujibu wa nadharia hii, mmenyuko wa kemikali unaweza kutokea tu wakati chembe hai zinapogongana. Chembe huitwa kazi ikiwa zina tabia fulani ya nishati ya mmenyuko fulani, ambayo ni muhimu kushinda nguvu za kukataa zinazotokea kati ya shells za elektroni za chembe zinazoitikia. Uwiano wa chembe hai huongezeka kwa joto la kuongezeka.
Mchanganyiko ulioamilishwa ni kikundi cha kati kisicho na msimamo ambacho huundwa wakati wa mgongano wa chembe hai na iko katika hali ya ugawaji upya wa vifungo. Wakati tata iliyoamilishwa hutengana, bidhaa za majibu zinaundwa.
Nishati ya uanzishaji E na ni sawa na tofauti kati ya nishati ya wastani ya chembe zinazoitikia na nishati ya tata iliyoamilishwa.
Kwa athari nyingi za kemikali, nishati ya kuwezesha ni ndogo kuliko nishati ya kutenganisha ya vifungo dhaifu zaidi katika molekuli za viitikio.
Katika nadharia ya uanzishaji, athari ya joto kwenye kiwango cha mmenyuko wa kemikali inaelezewa na equation ya Arrhenius kwa kiwango cha mara kwa mara cha mmenyuko wa kemikali:
ambapo A ni sababu ya mara kwa mara, isiyotegemea hali ya joto, imedhamiriwa na asili ya reactants; e ni msingi wa logarithm asili; E a - nishati ya uanzishaji; R ni gesi ya molar isiyobadilika.
Kama ifuatavyo kutoka kwa mlinganyo wa Arrhenius, kadiri kasi inavyoongezeka ya mmenyuko, ndivyo nishati ya kuwezesha inavyopungua. Hata kupungua kidogo kwa nishati ya uanzishaji (kwa mfano, wakati kichocheo kinapoanzishwa) husababisha ongezeko kubwa la kiwango cha majibu.
Kwa mujibu wa equation ya Arrhenius, ongezeko la joto husababisha kuongezeka kwa kiwango cha mara kwa mara cha mmenyuko wa kemikali. Kadiri thamani ya E a inavyokuwa ndogo, ndivyo athari ya halijoto inavyoonekana zaidi kwenye kiwango cha mmenyuko na, kwa hiyo, ndivyo mgawo wa joto wa kiwango cha majibu unavyoongezeka.
3. Ushawishi wa kichocheo juu ya kiwango cha mmenyuko wa kemikali. Kichocheo cha homogeneous na tofauti. Vipengele vya nadharia ya catalysis ya homogeneous. Nadharia ya misombo ya kati. Vipengele vya nadharia ya kichocheo tofauti. Vituo vinavyofanya kazi na jukumu lao katika kichocheo tofauti. Dhana ya adsorption. Ushawishi wa kichocheo kwenye nishati ya kuwezesha athari ya kemikali. Catalysis katika asili, sekta, teknolojia. kichocheo cha biochemical. Vimeng'enya.
Catalysis ni badiliko katika kiwango cha mmenyuko wa kemikali chini ya utendi wa vitu ambavyo wingi na asili yake baada ya kukamilika kwa mmenyuko hubaki sawa na kabla ya majibu.
Kichocheo ni dutu inayobadilisha kiwango cha mmenyuko wa kemikali, lakini inabakia bila kubadilika kwa kemikali.
Kichocheo chanya huongeza kasi ya majibu; kichocheo hasi, au kizuizi, hupunguza kasi ya majibu.
Katika hali nyingi, athari ya kichocheo inaelezewa na ukweli kwamba inapunguza nishati ya uanzishaji wa majibu. Kila moja ya michakato ya kati inayohusisha kichocheo huendelea na nishati ya chini ya kuwezesha kuliko majibu yasiyo ya kichocheo.
Katika kichocheo cha homogeneous, kichocheo na reactants huunda awamu moja (suluhisho). Katika kichocheo cha aina nyingi, kichocheo (kawaida kigumu) na viitikio viko katika awamu tofauti.
Katika kipindi cha kichocheo cha homogeneous, kichocheo huunda kiwanja cha kati na reagent, ambayo humenyuka na reagent ya pili kwa kiwango cha juu au hutengana kwa haraka na kutolewa kwa bidhaa ya majibu.
Mfano wa kichocheo cha homogeneous: uoksidishaji wa oksidi ya sulfuri (IV) hadi oksidi ya sulfuri (VI) na oksijeni katika njia ya nitrojeni ya kuzalisha asidi ya sulfuriki (hapa kichocheo ni oksidi ya nitrojeni (II), ambayo humenyuka kwa urahisi na oksijeni).
Katika kichocheo tofauti, majibu huendelea kwenye uso wa kichocheo. Hatua za awali ni uenezaji wa chembe zinazoathiriwa kwa kichocheo na urejeshaji wao (yaani kufyonzwa) na uso wa kichocheo. Molekuli za kitendanishi huingiliana na atomi au vikundi vya atomi vilivyo kwenye nyuso za kichocheo, na kutengeneza misombo ya uso wa kati. Ugawaji wa wiani wa elektroni unaotokea katika misombo hiyo ya kati husababisha kuundwa kwa vitu vipya ambavyo vinaharibiwa, yaani, kuondolewa kutoka kwa uso.
Mchakato wa malezi ya misombo ya uso wa kati hutokea kwenye vituo vya kazi vya kichocheo.
Mfano wa kichocheo tofauti ni kuongezeka kwa kasi ya oksidi ya oksidi ya salfa(IV) hadi oksidi ya sulfuri(VI) na oksijeni mbele ya oksidi ya vanadium(V).
Mifano ya michakato ya kichocheo katika tasnia na teknolojia: muundo wa amonia, muundo wa asidi ya nitriki na sulfuri, kupasuka na urekebishaji wa mafuta, kuchomwa kwa bidhaa za mwako usio kamili wa petroli kwenye magari, nk.
Mifano ya michakato ya kichocheo katika asili ni mingi, kwa kuwa athari nyingi za biochemical zinazotokea katika viumbe hai ni athari za kichocheo. Athari hizi huchochewa na protini zinazoitwa enzymes. Kuna takriban enzymes 30,000 katika mwili wa mwanadamu, ambayo kila moja huchochea aina moja tu ya mchakato (kwa mfano, mate ptyalin huchochea tu ubadilishaji wa wanga kuwa glukosi).
4. Usawa wa kemikali. Athari za kemikali zinazoweza kutenduliwa na zisizoweza kutenduliwa. hali ya usawa wa kemikali. Usawa wa kemikali mara kwa mara. Mambo ambayo huamua thamani ya usawa wa mara kwa mara: asili ya reactants na joto. Badilisha katika usawa wa kemikali. Ushawishi wa mabadiliko katika mkusanyiko, shinikizo na joto kwenye nafasi ya usawa wa kemikali.
Athari za kemikali, kama matokeo ambayo vitu vya kuanzia vinabadilishwa kabisa kuwa bidhaa za athari, huitwa zisizoweza kubadilika. Matendo yanayoenda kwa wakati mmoja katika pande mbili tofauti (mbele na nyuma) huitwa reversible.
Katika athari zinazoweza kugeuzwa, hali ya mfumo ambayo viwango vya athari ya mbele na ya nyuma ni sawa () inaitwa hali ya usawa wa kemikali. Usawa wa kemikali ni wa nguvu, i.e. kuanzishwa kwake haimaanishi kukomesha majibu. Katika hali ya jumla, kwa athari yoyote inayoweza kubadilishwa aA + bB - dD + eE, bila kujali utaratibu wake, uhusiano ufuatao unashikilia:

Katika usawa, bidhaa ya viwango vya bidhaa za mmenyuko, inajulikana kwa bidhaa ya viwango vya vifaa vya kuanzia, kwa mmenyuko fulani kwa joto fulani ni thamani ya mara kwa mara, inayoitwa usawa wa usawa (K).
Thamani ya mara kwa mara ya usawa inategemea asili ya reactants na joto, lakini haitegemei viwango vya vipengele vya mchanganyiko wa usawa.
Kubadilisha hali (joto, shinikizo, mkusanyiko), ambayo mfumo uko katika hali ya usawa wa kemikali (), husababisha usawa. Kama matokeo ya mabadiliko ya usawa katika viwango vya athari za moja kwa moja na za nyuma () kwa wakati, usawa mpya wa kemikali () umeanzishwa katika mfumo, unaolingana na hali mpya. Mpito kutoka hali moja ya usawa hadi nyingine inaitwa kuhama, au mabadiliko katika nafasi ya usawa.
Ikiwa, wakati wa mpito kutoka hali moja ya usawa hadi nyingine, viwango vya vitu vilivyorekodiwa upande wa kulia wa equation ya mmenyuko huongezeka, wanasema kwamba usawa hubadilika kwenda kulia. Ikiwa, wakati wa mpito kutoka hali moja ya usawa hadi nyingine, viwango vya vitu vilivyorekodiwa upande wa kushoto wa equation ya mmenyuko huongezeka, wanasema kwamba usawa huhamia kushoto.
Mwelekeo wa mabadiliko ya usawa wa kemikali kama matokeo ya mabadiliko katika hali ya nje imedhamiriwa na kanuni ya Le Chatelier: Ikiwa ushawishi wa nje unatolewa kwenye mfumo katika hali ya usawa wa kemikali (kubadilisha hali ya joto, shinikizo au mkusanyiko wa dutu). , basi itapendelea mtiririko wa moja ya michakato miwili iliyo kinyume, ambayo inadhoofisha athari hii.
Kulingana na kanuni ya Le Chatelier:
Kuongezeka kwa mkusanyiko wa sehemu iliyoandikwa upande wa kushoto wa equation husababisha kuhama kwa usawa kwa haki; ongezeko la mkusanyiko wa sehemu iliyoandikwa upande wa kulia wa equation husababisha kuhama kwa usawa kwa kushoto;
Kwa ongezeko la joto, mabadiliko ya usawa katika mwelekeo wa mmenyuko wa mwisho wa joto, na kwa kupungua kwa joto, kwa mwelekeo wa mmenyuko wa exothermic;
- - Kwa kuongezeka kwa shinikizo, usawa hubadilika kuelekea mmenyuko ambayo inapunguza idadi ya molekuli ya vitu vya gesi kwenye mfumo, na kwa kupungua kwa shinikizo, kuelekea mmenyuko unaoongeza idadi ya molekuli ya vitu vya gesi.
- 5. Photochemical na athari za mnyororo. Vipengele vya mwendo wa athari za picha. Athari za picha na wanyamapori. Athari za kemikali zisizo na matawi na matawi (kwa mfano wa athari za malezi ya kloridi hidrojeni na maji kutoka kwa vitu rahisi). Masharti ya kuanzisha na kukomesha minyororo.
Athari za Photochemical ni majibu ambayo hufanyika chini ya ushawishi wa mwanga. Mmenyuko wa fotokemikali huendelea ikiwa kitendanishi kinachukua kiasi cha mionzi, ambayo ina sifa ya nishati ambayo ni mahususi kwa majibu haya.
Katika kesi ya baadhi ya athari za photochemical, kwa kunyonya nishati, molekuli za reactant hupita katika hali ya msisimko, i.e. kuwa hai.
Katika hali nyingine, mmenyuko wa fotokemikali huendelea ikiwa kiasi cha nishati ya juu sana hufyonzwa hadi vifungo vya kemikali huvunjwa na molekuli kujitenga na kuwa atomi au vikundi vya atomi.
Kiwango cha mmenyuko wa pichakemikali ni kubwa zaidi, ndivyo nguvu ya mionzi inavyoongezeka.
Mfano wa mmenyuko wa picha katika wanyamapori ni photosynthesis, i.e. malezi ya vitu vya kikaboni vya seli kutokana na nishati ya mwanga. Katika viumbe vingi, photosynthesis hufanyika kwa ushiriki wa klorophyll; katika kesi ya mimea ya juu, photosynthesis ni muhtasari wa equation:
CO 2 + H 2 O viumbe hai + O 2
Michakato ya Photochemical pia inasimamia utendaji wa michakato ya maono.
Mwitikio wa mnyororo ni mmenyuko ambao ni mlolongo wa vitendo vya kimsingi vya mwingiliano, na uwezekano wa kila kitendo cha mwingiliano kutokea inategemea mafanikio ya kitendo cha hapo awali.
Hatua za mmenyuko wa mnyororo ni uanzishaji wa mnyororo, ukuzaji wa mnyororo, na kusitisha mnyororo.
Asili ya mnyororo hutokea wakati, kwa sababu ya chanzo cha nje cha nishati (quantum ya mionzi ya umeme, inapokanzwa, kutokwa kwa umeme), chembe za kazi na elektroni zisizoharibika (atomi, radicals bure) huundwa.
Wakati wa maendeleo ya mnyororo, radicals huingiliana na molekuli za awali, na radicals mpya huundwa katika kila tendo la mwingiliano.
Kukomesha kwa mnyororo hutokea ikiwa radicals mbili zinagongana na kuhamisha nishati iliyotolewa katika kesi hii kwa mwili wa tatu (molekuli inayostahimili kuoza, au ukuta wa chombo). Mnyororo pia unaweza kusitishwa ikiwa radical isiyofanya kazi itaundwa.
Kuna aina mbili za athari za mnyororo - zisizo na matawi na matawi.
Katika athari zisizo na matawi, katika hatua ya ukuzaji wa mnyororo, radical moja mpya huundwa kutoka kwa kila itikadi kali.
Katika athari za matawi katika hatua ya ukuzaji wa mnyororo, radicals 2 au zaidi mpya huundwa kutoka kwa athari moja ya kiitikadi.
6. Mambo yanayoamua mwelekeo wa mmenyuko wa kemikali. Vipengele vya thermodynamics ya kemikali. Dhana: awamu, mfumo, mazingira, macro- na microstates. Tabia za msingi za thermodynamic. Nishati ya ndani ya mfumo na mabadiliko yake katika mwendo wa mabadiliko ya kemikali. Enthalpy. Uwiano wa enthalpy na nishati ya ndani ya mfumo. Enthalpy ya kawaida ya dutu. Mabadiliko ya enthalpy katika mifumo wakati wa mabadiliko ya kemikali. Athari ya joto (enthalpy) ya mmenyuko wa kemikali. Michakato ya exo- na endothermic. Thermochemistry. Sheria ya Hess. mahesabu ya thermochemical.
Thermodynamics husoma mifumo ya ubadilishanaji wa nishati kati ya mfumo na mazingira, uwezekano, mwelekeo na mipaka ya mtiririko wa moja kwa moja wa michakato ya kemikali.
Mfumo wa thermodynamic (au mfumo tu) ni mwili au kikundi cha miili inayoingiliana inayotofautishwa kiakili katika nafasi. Nafasi iliyobaki nje ya mfumo inaitwa mazingira (au mazingira tu). Mfumo huo umetenganishwa na mazingira na uso halisi au wa kufikiria.
Mfumo wa homogeneous una awamu moja, mfumo wa heterogeneous una awamu mbili au zaidi.
Awamu ni sehemu ya mfumo ambayo ni sawa katika sehemu zake zote kulingana na muundo wa kemikali na mali na hutenganishwa na sehemu zingine za mfumo na kiolesura.
Hali ya mfumo ina sifa ya jumla ya mali zake za kimwili na kemikali. Macrostate imedhamiriwa na vigezo vya wastani vya seti nzima ya chembe katika mfumo, na microstate imedhamiriwa na vigezo vya kila chembe ya mtu binafsi.
Vigezo vya kujitegemea vinavyoamua macrostate ya mfumo huitwa vigezo vya thermodynamic, au vigezo vya hali. Joto T, shinikizo p, ujazo V, kiasi cha kemikali n, mkusanyiko c, n.k. kwa kawaida huchaguliwa kama vigezo vya hali.
Kiasi cha kimwili, thamani ambayo inategemea tu vigezo vya hali na haitegemei njia ya mpito kwa hali fulani, inaitwa kazi ya serikali. Kazi za serikali ni, haswa:
U - nishati ya ndani;
H - enthalpy;
S - entropy;
G - Gibbs nishati (nishati ya bure au isobaric-isothermal uwezo).
Nishati ya ndani ya mfumo U ni nishati yake yote, inayojumuisha nishati ya kinetic na uwezo wa chembe zote za mfumo (molekuli, atomi, nuclei, elektroni) bila kuzingatia nishati ya kinetic na uwezo wa mfumo kwa ujumla. Kwa kuwa akaunti kamili ya vipengele hivi vyote haiwezekani, basi katika utafiti wa thermodynamic wa mfumo, mabadiliko ya nishati yake ya ndani wakati wa mpito kutoka hali moja (U 1) hadi nyingine (U 2) inazingatiwa:
U 1 U 2 U = U 2 -U1
Mabadiliko katika nishati ya ndani ya mfumo yanaweza kuamua kwa majaribio.
Mfumo unaweza kubadilishana nishati (joto Q) na mazingira na kufanya kazi A, au, kinyume chake, kazi inaweza kufanyika kwenye mfumo. Kulingana na sheria ya kwanza ya thermodynamics, ambayo ni matokeo ya sheria ya uhifadhi wa nishati, joto lililopokelewa na mfumo linaweza kutumika tu kuongeza nishati ya ndani ya mfumo na kufanya kazi na mfumo:
Q= U+A
Katika siku zijazo, tutazingatia mali ya mifumo hiyo, ambayo haiathiriwa na nguvu nyingine yoyote, isipokuwa kwa nguvu za shinikizo la nje.
Ikiwa mchakato katika mfumo unaendelea kwa kiasi cha mara kwa mara (yaani, hakuna kazi dhidi ya nguvu za shinikizo la nje), basi A \u003d 0. Kisha athari ya joto ya mchakato unaoendelea kwa kiasi cha mara kwa mara, Q v ni sawa na mabadiliko katika nishati ya ndani ya mfumo:
Athari nyingi za kemikali zinazokutana katika maisha ya kila siku hufanyika kwa shinikizo la mara kwa mara (michakato ya isobaric). Ikiwa hakuna nguvu zingine zinazofanya kazi kwenye mfumo, isipokuwa kwa shinikizo la nje la mara kwa mara, basi:
A = p(V2 - V 1 ) = pV
Kwa hivyo, kwa upande wetu (p = const):
Qp=U + pV
Q p \u003d U 2 -U 1 + p (V 2 - V 1 ), wapi
Qp = (U 2 +pV 2 )-(U 1 +pV 1 ).
Kazi ya U + pV inaitwa enthalpy; inaonyeshwa na barua N. Enthalpy ni kazi ya serikali na ina mwelekeo wa nishati (J).
Qp= H 2 - H 1 =H,
yaani, athari ya joto ya mmenyuko kwa shinikizo la mara kwa mara na joto T ni sawa na mabadiliko katika enthalpy ya mfumo wakati wa majibu. Inategemea asili ya reactants na bidhaa, hali yao ya kimwili, hali (T, p) ya mmenyuko, na pia kwa kiasi cha vitu vinavyohusika katika majibu.
Enthalpy ya mmenyuko ni mabadiliko katika enthalpy ya mfumo ambapo viitikio huingiliana kwa kiasi sawa na coefficients stoichiometric katika equation ya majibu.
Enthalpy ya mmenyuko inaitwa kawaida ikiwa viitikio na bidhaa za majibu ziko katika hali ya kawaida.
Hali ya kawaida ya dutu ni hali ya jumla au fomu ya fuwele ya dutu ambayo ni thabiti zaidi ya thermodynamically chini ya hali ya kawaida (T \u003d 25 o C au 298 K; p \u003d 101.325 kPa).
Hali ya kawaida ya dutu iliyopo 298 K katika fomu imara inachukuliwa kuwa kioo chake safi chini ya shinikizo la 101.325 kPa; katika fomu ya kioevu - kioevu safi chini ya shinikizo la 101.325 kPa; kwa fomu ya gesi - gesi yenye shinikizo lake la 101.325 kPa.
Kwa solute, hali yake katika suluhisho kwa molality ya 1 mol / kg inachukuliwa kuwa ya kawaida, na inachukuliwa kuwa suluhisho lina mali ya ufumbuzi usio na kipimo.
Enthalpy ya kawaida ya mmenyuko wa malezi ya mol 1 ya dutu fulani kutoka kwa vitu rahisi katika hali zao za kawaida inaitwa enthalpy ya kawaida ya malezi ya dutu hii.
Mfano wa kurekodi: (CO 2) \u003d - 393.5 kJ / mol.
Enthalpy ya kawaida ya malezi ya dutu rahisi ambayo iko katika hali ya utulivu zaidi (kwa kupewa p na T) hali ya mkusanyiko inachukuliwa sawa na 0. Ikiwa kipengele kinaunda marekebisho kadhaa ya allotropiki, basi tu imara zaidi (kwa kupewa p na T). ) urekebishaji una kiwango cha sifuri enthalpy ya malezi.
Kawaida, idadi ya thermodynamic imedhamiriwa chini ya hali ya kawaida:
p \u003d 101.32 kPa na T \u003d 298 K (25 ° C).
Equations za kemikali zinazoonyesha mabadiliko katika enthalpy (athari za joto za athari) huitwa equations thermochemical. Kuna aina mbili za uandishi wa milinganyo ya joto katika fasihi.
Aina ya thermodynamic ya equation ya thermochemical:
C (graphite) + O 2 (g) CO 2 (g); = - 393.5 kJ.
Fomu ya thermochemical ya equation ya thermochemical kwa mchakato sawa:
C (graphite) + O 2 (g) CO 2 (g) + 393.5 kJ.
Katika thermodynamics, athari za joto za taratibu zinazingatiwa kutoka kwa mtazamo wa mfumo. Kwa hivyo, ikiwa mfumo utatoa joto, basi Q< 0, а энтальпия системы уменьшается (ДH < 0).
Katika thermochemistry ya classical, athari za joto huzingatiwa kutoka kwa mtazamo wa mazingira. Kwa hivyo, ikiwa mfumo utatoa joto, basi inachukuliwa kuwa Q > 0.
Mchakato wa exothermic ni mchakato unaoendelea na kutolewa kwa joto (DH< 0).
Endothermic ni mchakato unaoendelea na ufyonzwaji wa joto (DH> 0).
Sheria ya msingi ya thermochemistry ni sheria ya Hess: "Athari ya joto ya mmenyuko imedhamiriwa tu na hali ya awali na ya mwisho ya mfumo na haitegemei njia ya mabadiliko ya mfumo kutoka hali moja hadi nyingine."
Matokeo kutoka kwa sheria ya Hess: Athari ya kawaida ya joto ya mmenyuko ni sawa na jumla ya joto la kawaida la malezi ya bidhaa za mmenyuko ukiondoa jumla ya joto la kawaida la malezi ya vitu vya kuanzia, kwa kuzingatia coefficients ya stoichiometric:
- (majibu) = (endelea.) -(nje.)
- 7. Dhana ya entropy. Mabadiliko ya Entropy wakati wa mabadiliko ya awamu na michakato ya kemikali. Dhana ya uwezekano wa isobaric-isothermal ya mfumo (nishati ya Gibbs, nishati ya bure). Uwiano kati ya ukubwa wa mabadiliko katika nishati ya Gibbs na ukubwa wa mabadiliko katika enthalpy na entropy ya mmenyuko (uhusiano wa msingi wa thermodynamic). Uchambuzi wa Thermodynamic wa uwezekano na hali ya kutokea kwa athari za kemikali. Vipengele vya mwendo wa michakato ya kemikali katika viumbe hai.
Entropy S ni thamani sawia na logariti ya idadi ya serikali ndogo zinazolingana (W) ambapo macrostate fulani inaweza kupatikana:
S=k ln W
Sehemu ya entropy ni J/mol?K.
Entropy ni kipimo cha kiasi cha kiwango cha shida katika mfumo.
Entropy huongezeka wakati wa mpito wa dutu kutoka kwa hali ya fuwele hadi hali ya kioevu na kutoka kwa kioevu hadi hali ya gesi, wakati wa kufutwa kwa fuwele, wakati wa upanuzi wa gesi, wakati wa mwingiliano wa kemikali unaosababisha kuongezeka kwa idadi ya chembe; na juu ya chembe zote katika hali ya gesi. Kinyume chake, taratibu zote, kama matokeo ambayo kuagiza kwa mfumo huongezeka (condensation, upolimishaji, compression, kupunguza idadi ya chembe), hufuatana na kupungua kwa entropy.
Kuna mbinu za kuhesabu thamani kamili ya entropy ya dutu, kwa hiyo, katika jedwali la sifa za thermodynamic za dutu binafsi, data hutolewa kwa S 0, na si kwa DS 0.
Entropy ya kawaida ya dutu rahisi, kinyume na enthalpy ya malezi jambo rahisi, si sawa na sifuri.
Kwa entropy, taarifa inayofanana na ile iliyozingatiwa hapo juu kwa H ni kweli: mabadiliko katika entropy ya mfumo kama matokeo ya mmenyuko wa kemikali (S) ni sawa na jumla ya entropies ya bidhaa za athari ukiondoa jumla ya Entropies ya vitu vya kuanzia. Kama katika hesabu ya enthalpy, muhtasari unafanywa kwa kuzingatia mgawo wa stoichiometric.
Mwelekeo ambao mmenyuko wa kemikali hujitokeza kwa hiari katika mfumo uliotengwa imedhamiriwa na hatua ya pamoja ya mambo mawili: 1) tabia ya mfumo wa mpito hadi hali yenye nishati ya chini ya ndani (katika kesi ya michakato ya isobaric, na enthalpy ya chini); 2) tabia ya kufikia hali inayowezekana zaidi, i.e., hali ambayo inaweza kupatikana kwa idadi kubwa ya njia zinazowezekana (microstates), i.e.:
DH > min, DS > max.
Utendaji wa serikali unaoonyesha wakati huo huo ushawishi wa mielekeo yote miwili iliyotajwa hapo juu juu ya mwelekeo wa michakato ya kemikali ni nishati ya Gibbs (nishati ya bure, au uwezo wa isobaric-isothermal), inayohusiana na enthalpy na entropy kwa uhusiano.
ambapo T ni joto kamili.
Kama unavyoona, nishati ya Gibbs ina kipimo sawa na enthalpy, na kwa hivyo kawaida huonyeshwa kwa J au kJ.
Kwa michakato ya isobaric-isothermal (yaani, michakato inayotokea kwa joto la kawaida na shinikizo), mabadiliko katika nishati ya Gibbs ni:
G= H-TS
Kama ilivyo kwa H na S, mabadiliko ya nishati ya Gibbs G kama matokeo ya mmenyuko wa kemikali (nishati ya Gibbs ya mmenyuko) ni sawa na jumla ya nguvu za Gibbs za uundaji wa bidhaa za athari ukiondoa jumla. nguvu za Gibbs za malezi ya vitu vya awali; muhtasari unafanywa kwa kuzingatia idadi ya moles ya vitu vinavyohusika katika mmenyuko.
Nishati ya Gibbs ya uundaji wa dutu inahusiana na mole 1 ya dutu hii na kwa kawaida huonyeshwa katika kJ/mol; katika kesi hii, G 0 ya malezi ya urekebishaji thabiti zaidi wa dutu rahisi inachukuliwa sawa na sifuri.
Kwa joto la mara kwa mara na shinikizo, athari za kemikali zinaweza kuendelea tu katika mwelekeo huo, ambapo nishati ya Gibbs ya mfumo hupungua (G0). Hili ni sharti la uwezekano wa kimsingi wa kutekeleza mchakato huu.
Jedwali hapa chini linaonyesha uwezekano na masharti ya majibu kuendelea na michanganyiko mbalimbali ya ishara za H na S:
Kwa ishara ya G, mtu anaweza kuhukumu uwezekano (hauwezekani) wa mtiririko wa moja kwa moja wa mchakato mmoja. Ikiwa mfumo unaathiriwa, basi inawezekana kufanya mabadiliko kutoka kwa dutu moja hadi nyingine, inayojulikana na ongezeko la nishati ya bure (G> 0). Kwa mfano, katika seli za viumbe hai athari za malezi ya misombo tata ya kikaboni huendelea; nguvu ya uendeshaji wa michakato hiyo ni mionzi ya jua na athari za oxidation katika seli.
Kutatua matatizo katika sehemu
Mada "Thermodynamics ya kemikali na kinetics", ambayo inahusisha utafiti wa hali zinazoathiri kiwango cha mmenyuko wa kemikali, hutokea mara mbili katika kozi ya kemia ya shule - katika darasa la 9 na 11. Walakini, ni mada hii ambayo ni moja wapo ngumu zaidi na ngumu sio tu kwa uelewa wa mwanafunzi "wastani", lakini hata kwa uwasilishaji wa walimu wengine, haswa wasio wataalamu wanaofanya kazi vijijini, ambao kemia ni nyongeza kwao. somo, kwa kuzingatia masaa ambayo mwalimu anapata kiwango, na hivyo matumaini ya mshahara zaidi au chini ya heshima.
Katika hali ya kupungua kwa kasi kwa idadi ya wanafunzi katika shule za vijijini, kwa sababu zinazojulikana, mwalimu analazimika kuwa generalist. Baada ya kuhudhuria kozi 2-3, anaanza kufundisha masomo, mara nyingi mbali sana na utaalam wake kuu.
Maendeleo haya yanalenga hasa walimu wanovice na walimu wa somo ambao wanalazimika kufundisha kemia katika uchumi wa soko. Nyenzo hii ina kazi za kupata viwango vya athari tofauti na zenye usawa na kuongeza kasi ya majibu kwa joto linaloongezeka. Licha ya ukweli kwamba kazi hizi ni msingi wa nyenzo za shule, ingawa ni ngumu kwa mwanafunzi "wastani" kujua, inashauriwa kutatua kadhaa katika somo la kemia.
Darasa la 11, na mengine kutoa katika mduara au darasa la hiari kwa wanafunzi wanaopanga kuunganisha hatima yao ya baadaye na kemia.
Mbali na kazi zilizochambuliwa kwa kina na kutolewa kwa majibu, maendeleo haya yana nyenzo za kinadharia ambazo zitasaidia mwalimu wa kemia, kimsingi ambaye sio mtaalamu, kuelewa kiini cha mada hii ngumu ya kozi ya kemia ya jumla.
Kulingana na nyenzo iliyopendekezwa, unaweza kuunda toleo lako mwenyewe la somo la somo, kulingana na uwezo wa wanafunzi darasani, na unaweza kutumia sehemu iliyopendekezwa ya kinadharia wakati wa kusoma mada hii katika darasa la 9 na 11.
Hatimaye, nyenzo zilizomo katika maendeleo haya hazitakuwa mbaya zaidi kuchambua peke yao kwa mhitimu ambaye anajiandaa kuingia chuo kikuu, ikiwa ni pamoja na moja ambayo kemia ni somo kuu.
Sehemu ya kinadharia juu ya mada
"Thermodynamics ya kemikali na kinetics"
Masharti yanayoathiri kiwango cha mmenyuko wa kemikali
1. Kiwango cha mmenyuko wa kemikali hutegemea asili ya reactants.
MIFANO.
Sodiamu ya metali, yenye asili ya alkali, humenyuka kwa ukali na maji na kutolewa kwa kiasi kikubwa cha joto, tofauti na zinki, ambayo ina asili ya amphoteric, ambayo humenyuka na maji polepole na inapokanzwa:
Iron ya unga humenyuka kwa ukali zaidi ikiwa na madini yenye asidi hidrokloriki kuliko asidi ya asetiki ya kikaboni dhaifu:

2. Kiwango cha mmenyuko wa kemikali inategemea mkusanyiko wa vitu vinavyoathiri katika hali ya kufutwa au gesi.
MIFANO.
Sulfuri huwaka kwa nguvu zaidi katika oksijeni safi kuliko hewani:

Na suluhisho la 30% la asidi hidrokloriki, magnesiamu ya unga humenyuka kwa nguvu zaidi kuliko suluhisho la 1% yake:

3. Kiwango cha mmenyuko wa kemikali ni sawia moja kwa moja na eneo la uso wa dutu inayojibu katika hali ngumu ya mkusanyiko.
MIFANO.
Kipande cha mkaa (kaboni) ni vigumu sana kuwasha na kiberiti, lakini vumbi la mkaa huwaka kwa mlipuko:
C + O 2 \u003d CO 2.
Alumini katika mfumo wa granule haifanyiki kwa kiwango kikubwa na fuwele ya iodini, lakini iodini iliyokandamizwa inachanganyika kwa nguvu na alumini katika mfumo wa poda:

4. Kiwango cha mmenyuko wa kemikali inategemea joto ambalo mchakato hutokea.
MFANO
Kwa kila ongezeko la 10 ° C la joto, kiwango cha athari nyingi za kemikali huongezeka kwa sababu ya 2-4. Ongezeko maalum la kiwango cha mmenyuko wa kemikali imedhamiriwa na mgawo maalum wa joto (gamma).
Kuhesabu ni mara ngapi kasi ya majibu itaongezeka:
2 HAPANA + O 2 \u003d 2NO 2,
ikiwa mgawo wa joto ni 3 na joto la mchakato limeongezeka kutoka 10 °C hadi 50 °C.
Mabadiliko ya joto ni:
t= 50 ° С - 10 ° С = 40 ° С.
Tunatumia formula:
![]()
ambapo ni kasi ya mmenyuko wa kemikali katika joto la juu, ni kasi ya mmenyuko wa kemikali kwenye joto la awali.
Kwa hivyo, kasi ya mmenyuko wa kemikali na ongezeko la joto kutoka 10 °C hadi 50 °C itaongezeka mara 81.
5. Kiwango cha mmenyuko wa kemikali inategemea uwepo wa vitu fulani.
Kichocheo Dutu inayoharakisha mwendo wa mmenyuko wa kemikali, lakini yenyewe haitumiwi wakati wa majibu. Kichocheo hupunguza kizuizi cha kuwezesha cha mmenyuko wa kemikali.
Kizuizi Dutu ambayo hupunguza kasi ya mmenyuko wa kemikali, lakini yenyewe haitumiwi wakati wa majibu.
MIFANO.
![]()
Kichocheo kinachoharakisha mwendo wa mmenyuko huu wa kemikali ni oksidi ya manganese (IV).
Fosforasi nyekundu ni kichocheo kinachoharakisha mwendo wa mmenyuko huu wa kemikali.
Kizuizi kinachopunguza kasi ya mmenyuko huu wa kemikali ni dutu ya kikaboni - urotropine (hexamethylenetetramine).
Kiwango cha mmenyuko wa kemikali ya homogeneous hupimwa na idadi ya moles ya dutu ambayo imeingia kwenye athari au imeundwa kama matokeo ya mmenyuko kwa kila kitengo cha muda kwa kiasi cha kitengo:
![]()
ambapo homog ni kiwango cha mmenyuko wa kemikali katika mfumo wa homogeneous, ni idadi ya moles ya moja ya reactants au moja ya dutu inayoundwa kama matokeo ya mmenyuko; V- kiasi,
t- wakati, - mabadiliko katika idadi ya moles ya dutu wakati wa majibu t.
Kwa kuwa uwiano wa idadi ya moles ya dutu kwa kiasi cha mfumo ni mkusanyiko kutoka, basi
Kwa hivyo:

Kiwango cha mmenyuko wa kemikali wa homogeneous hupimwa kwa mol/(l s).
Kwa kuzingatia hili, ufafanuzi ufuatao unaweza kutolewa:
kiwango cha mmenyuko wa kemikali ya homogeneous ni sawa na mabadiliko katika mkusanyiko wa moja ya reactants au moja ya vitu vinavyotengenezwa kutokana na mmenyuko kwa muda wa kitengo.
Ikiwa mmenyuko unaendelea kati ya vitu katika mfumo wa kutofautiana, basi vitu vinavyoathiri havigusana na kila mmoja kwa kiasi kizima, lakini tu juu ya uso wa imara. Kwa hiyo, kwa mfano, wakati kipande cha sulfuri ya fuwele kinapoungua, molekuli za oksijeni huguswa tu na atomi za sulfuri ambazo ziko juu ya uso wa kipande. Wakati wa kusaga kipande cha sulfuri, eneo la uso wa kukabiliana huongezeka, na kiwango cha kuungua kwa sulfuri huongezeka.
Katika suala hili, ufafanuzi wa kiwango cha mmenyuko wa kemikali tofauti ni kama ifuatavyo.
kiwango cha mmenyuko wa kemikali tofauti hupimwa na idadi ya moles ya dutu ambayo imeingia kwenye mmenyuko au iliyoundwa kama matokeo ya athari kwa kila wakati wa kitengo kwa kila uso wa kitengo:
![]()
wapi S ni eneo la uso.
Kiwango cha mmenyuko wa kemikali tofauti hupimwa kwa mol / (cm 2 s).
Kazi zinazohusiana
"Thermodynamics ya kemikali na kinetics"
1. 4 mol ya oksidi ya nitriki (II) na ziada ya oksijeni ililetwa ndani ya chombo kwa ajili ya kutekeleza athari za kemikali. Baada ya sekunde 10, kiasi cha oksidi ya nitriki (II) kiligeuka kuwa 1.5 mol. Pata kiwango cha mmenyuko huu wa kemikali ikiwa inajulikana kuwa kiasi cha chombo ni lita 50.
2. Kiasi cha dutu ya methane kwenye chombo kwa athari za kemikali ni 7 mol. Oksijeni ya ziada ililetwa ndani ya chombo na mchanganyiko ulilipuka. Ilibainishwa kwa majaribio kuwa baada ya sekunde 5 kiasi cha dutu ya methane kilipungua kwa mara 2. Pata kiwango cha mmenyuko huu wa kemikali ikiwa inajulikana kuwa kiasi cha chombo ni lita 20.
3. Mkusanyiko wa awali wa sulfidi hidrojeni katika chombo cha mwako wa gesi ilikuwa 3.5 mol / l. Oksijeni ya ziada ililetwa ndani ya chombo na mchanganyiko ulilipuka. Baada ya sekunde 15, mkusanyiko wa sulfidi hidrojeni ilikuwa 1.5 mol / l. Tafuta kiwango cha mmenyuko huu wa kemikali.
4. Mkusanyiko wa awali wa ethane katika chombo cha mwako wa gesi ulikuwa 5 mol/L. Oksijeni ya ziada ililetwa ndani ya chombo na mchanganyiko ulilipuka. Baada ya sekunde 12, mkusanyiko wa ethane ulikuwa 1.4 mol/L. Tafuta kiwango cha mmenyuko huu wa kemikali.
5. Mkusanyiko wa awali wa amonia katika chombo cha mwako wa gesi ulikuwa 4 mol / L. Oksijeni ya ziada ililetwa ndani ya chombo na mchanganyiko ulilipuka. Baada ya sekunde 3, mkusanyiko wa amonia ulikuwa 1 mol / l. Tafuta kiwango cha mmenyuko huu wa kemikali.
6. Mkusanyiko wa awali wa monoksidi kaboni(II) katika chombo cha mwako wa gesi ulikuwa 6 mol/L. Oksijeni ya ziada ililetwa ndani ya chombo na mchanganyiko ulilipuka. Baada ya sekunde 5, mkusanyiko wa monoksidi kaboni (II) ulipungua kwa nusu. Tafuta kiwango cha mmenyuko huu wa kemikali.
7. Kipande cha sulfuri kilicho na eneo la kujibu la 7 cm 2 kilichomwa katika oksijeni na kuundwa kwa oksidi ya sulfuri (IV). Kwa 10 s, kiasi cha suala la sulfuri kilipungua kutoka 3 mol hadi 1 mol. Tafuta kiwango cha mmenyuko huu wa kemikali.
8. Kipande cha kaboni chenye eneo la kuitikia la sm 10 kilichomwa katika oksijeni na kuunda monoksidi kaboni(IV). Katika sekunde 15, kiasi cha suala la kaboni kilipungua kutoka 5 mol hadi 1.5 mol. Tafuta kiwango cha mmenyuko huu wa kemikali.
9.
Mchemraba wa magnesiamu na eneo la uso wa mwitikio wa 15 cm2 na kiasi cha dutu
6 mol kuchomwa katika oksijeni ya ziada. Wakati huo huo, 7 s baada ya kuanza kwa majibu, kiasi cha dutu ya magnesiamu kiligeuka kuwa sawa na 2 mol. Tafuta kiwango cha mmenyuko huu wa kemikali.
10. Baa ya kalsiamu iliyo na eneo la athari ya jumla ya 12 cm 2 na kiasi cha dutu ya mol 7 ilichomwa kwa ziada ya oksijeni. Wakati huo huo, 10 s baada ya kuanza kwa majibu, kiasi cha dutu ya kalsiamu kiligeuka kuwa mara 2 chini. Tafuta kiwango cha mmenyuko huu wa kemikali.
Ufumbuzi na majibu
1 (HAPANA) = mol 4,
O 2 - ziada,
t 2 = sekunde 10,
t 1 = sekunde 0,
2 (HAPANA) = 1.5 mol,
Kutafuta:
Suluhisho
2 HAPANA + O 2 \u003d 2NO 2.
Kwa kutumia formula:
![]()
R-tion \u003d (4 - 1.5) / (50 (10 - 0)) \u003d 0.005 mol / (l s).
Jibu. p-tion \u003d 0.005 mol / (l s).
2.
1 (CH 4) \u003d 7 mol,
O 2 - ziada,
t 2 = 5 s
t 1 = sekunde 0,
2 (CH 4) \u003d 3.5 mol,
Kutafuta:
Suluhisho
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O.
Kwa kutumia formula:
![]()
Tafuta kasi ya mmenyuko huu wa kemikali:
R-tion \u003d (7 - 3.5) / (20 (5 - 0)) \u003d 0.035 mol / (l s).
Jibu. p-tion \u003d 0.035 mol / (l s).
3.
s 1 (H 2 S) = 3.5 mol / l,
O 2 - ziada,
t 2 = sekunde 15,
t 1 = sekunde 0,
kutoka 2 (H 2 S) \u003d 1.5 mol / l.
Kutafuta:
Suluhisho
2H 2 S + 3O 2 \u003d 2SO 2 + 2H 2 O.
Kwa kutumia formula:

Tafuta kasi ya mmenyuko huu wa kemikali:
R-tions \u003d (3.5 - 1.5) / (15 - 0) \u003d 0.133 mol / (l s).
Jibu. p-tion \u003d 0.133 mol / (l s).
4.
s 1 (C 2 H 6) = 5 mol / l,
O 2 - ziada,
t 2 = sekunde 12,
t 1 = sekunde 0,
c 2 (C 2 H 6) \u003d 1.4 mol / l.
Kutafuta:
Suluhisho
2C 2 H 6 + 7O 2 \u003d 4CO 2 + 6H 2 O.
Tafuta kasi ya mmenyuko huu wa kemikali:
P-tions \u003d (6 - 2) / (15 (7 - 0)) \u003d 0.0381 mol / (cm 2 s).
Jibu. p-tion \u003d 0.0381 mol / (cm 2 s).
10. Jibu. p-tion \u003d 0.0292 mol / (cm 2 s).
Fasihi
Glinka N.L. Kemia Mkuu, toleo la 27. Mh. V.A. Rabinovich. L.: Kemia, 1988; Akhmetov N.S. Kemia ya jumla na isokaboni. M.: Juu zaidi. shule, 1981; Zaitsev O.S. Kemia ya jumla. M.: Juu zaidi. shule, 1983; Karapetyants M.Kh., Drakin S.I. Kemia ya jumla na isokaboni. M.: Juu zaidi. shule, 1981; Korolkov D.V. Misingi ya kemia isokaboni. Moscow: Elimu, 1982; Nekrasov B.V. Misingi ya Kemia Mkuu. Toleo la 3, M.: Kemia, 1973; Novikov G.I. Utangulizi wa kemia isokaboni. Sura ya 1, 2. Minsk: Juu kabisa. shule, 1973–1974; Schukirev S.A.. Kemia isokaboni. T. 1, 2. M.: Juu. shule, 1970–1974; Schroeter W., Lautenschläger K.-H., Bibrak H. et al. Kemia. Rejea mh. Kwa. naye. Moscow: Kemia, 1989; Feldman F.G., Rudzitis G.E. Kemia-9. Kitabu cha maandishi kwa darasa la 9 la shule ya upili. M.: Elimu, 1990; Feldman F.G., Rudzitis G.E. Kemia-9. Kitabu cha maandishi kwa darasa la 9 la shule ya upili. M.: Mwangaza, 1992.
Kiwango cha athari za kemikali. Ufafanuzi wa dhana. Mambo yanayoathiri kiwango cha mmenyuko wa kemikali: mkusanyiko wa reagent, shinikizo, joto, uwepo wa kichocheo. Sheria ya hatua ya molekuli (LMA) kama sheria ya msingi ya kinetiki ya kemikali. Kiwango cha mara kwa mara, maana yake ya kimwili. Ushawishi juu ya kasi ya mmenyuko mara kwa mara ya asili ya viitikio, joto na uwepo wa kichocheo.
1. kutoka. 102-105; 2. kutoka. 163-166; 3. kutoka. 196-207, uk. 210-213; 4. kutoka. 185-188; 5. kutoka. 48-50; 6. kutoka. 198-201; 8. kutoka. 14-19
Kiwango cha majibu cha homogeneous - hii ni thamani kiidadi sawa na mabadiliko katika mkusanyiko wa mshiriki yeyote katika majibu kwa kila wakati wa kitengo.
Kiwango cha wastani cha majibu v cf katika muda kutoka t 1 kwa t 2 imedhamiriwa na uwiano:
Sababu kuu zinazoathiri kiwango cha mmenyuko wa kemikali wa homogeneous :
- asili ya reactants;
- ukolezi wa reagent;
- shinikizo (ikiwa gesi zinahusika katika mmenyuko);
- joto;
- uwepo wa kichocheo.
Kiwango cha majibu tofauti - hii ni thamani kiidadi sawa na mabadiliko katika mkusanyiko wa mshiriki yeyote katika majibu kwa kila wakati wa kitengo kwa kila uso wa kitengo: .
Kulingana na hatua za athari za kemikali zimegawanywa katika msingi Na changamano. Athari nyingi za kemikali ni taratibu ngumu zinazotokea katika hatua kadhaa, i.e. inayojumuisha michakato kadhaa ya kimsingi.
Kwa majibu ya kimsingi, sheria ya hatua ya wingi: kasi ya mmenyuko wa kimsingi wa kemikali katika halijoto fulani inalingana moja kwa moja na bidhaa ya viwango vya viitikio kwa uwezo sawa na mgawo wa stoichiometriki wa mlingano wa mmenyuko.
Kwa majibu ya kimsingi aA + bB → ... kiwango cha majibu, kulingana na sheria ya hatua ya wingi, inaonyeshwa na uwiano:
wapi (A) na kutoka (NDANI) - viwango vya molar ya reactants LAKINI Na KATIKA; a Na b- sambamba coefficients stoichiometric; k- kiwango cha mara kwa mara cha majibu haya .
Kwa athari tofauti, equation ya sheria ya hatua ya wingi haijumuishi viwango vya vitendanishi vyote, lakini ni gesi au kufutwa tu. Kwa hivyo, kwa majibu ya mwako wa kaboni:
C (c) + O 2 (g) → CO 2 (g)
equation ya kasi ina fomu.
Maana ya kimwili ya kiwango cha mara kwa mara ni kiidadi ni sawa na kasi ya mmenyuko wa kemikali katika viwango vya viitikio sawa na 1 mol/dm 3 .
Thamani ya kiwango cha mara kwa mara cha mmenyuko wa homogeneous inategemea asili ya reactants, joto na kichocheo.
Athari ya halijoto kwenye kiwango cha mmenyuko wa kemikali. Mgawo wa joto wa kiwango cha mmenyuko wa kemikali. molekuli hai. Mkondo wa usambazaji wa molekuli kulingana na nishati yao ya kinetic. Nishati ya uanzishaji. Uwiano wa nishati ya kuwezesha na nishati ya dhamana ya kemikali katika molekuli za awali. Hali ya mpito, au changamano iliyoamilishwa. Nishati ya uanzishaji na athari ya joto ya mmenyuko (mpango wa nishati). Utegemezi wa mgawo wa joto wa kasi ya majibu kwa thamani ya nishati ya kuwezesha.
1. kutoka. 106-108; 2. kutoka. 166-170; 3. kutoka. 210-217; 4. kutoka. 188-191; 5. kutoka. 50-51; 6. kutoka. 202-207; 8 . kutoka. 19-21.
Kadiri hali ya joto inavyoongezeka, kiwango cha mmenyuko wa kemikali kawaida huongezeka.
Thamani inayoonyesha ni mara ngapi kiwango cha athari huongezeka na ongezeko la joto kwa digrii 10 (au, ni nini sawa, na 10 K), inaitwa. mgawo wa joto wa kiwango cha mmenyuko wa kemikali (γ):
viwango vya majibu ni wapi, kwa mtiririko huo, kwa joto T 2 na T 1 ; γ ni mgawo wa joto wa kasi ya majibu.
Utegemezi wa kiwango cha mmenyuko kwenye joto ni takriban kuamuliwa na majaribio utawala wa van't Hoff: kwa kila ongezeko la digrii 10 kwa joto, kiwango cha mmenyuko wa kemikali huongezeka kwa mara 2-4.
Maelezo sahihi zaidi ya utegemezi wa kasi ya majibu kwenye halijoto yanawezekana ndani ya mfumo wa nadharia ya kuwezesha Arrhenius. Kwa mujibu wa nadharia hii, mmenyuko wa kemikali unaweza kutokea tu wakati chembe hai zinapogongana. Inayotumika chembe huitwa ambazo zina tabia fulani, tabia ya mmenyuko fulani, nishati muhimu ili kushinda nguvu za kukataa zinazotokea kati ya shells za elektroni za chembe zinazoitikia.
Uwiano wa chembe hai huongezeka kwa joto la kuongezeka.
Mchanganyiko ulioamilishwa - hiki ni kikundi cha kati kisicho na msimamo, ambacho huundwa wakati wa mgongano wa chembe hai na iko katika hali ya ugawaji upya wa vifungo.. Bidhaa za mmenyuko huundwa wakati wa mtengano wa tata iliyoamilishwa.
Nishati ya uanzishaji Na E lakini ni sawa na tofauti kati ya wastani wa nishati ya chembe zinazojibu na nishati ya changamano iliyoamilishwa.
Kwa athari nyingi za kemikali, nishati ya kuwezesha ni ndogo kuliko nishati ya kutenganisha ya dhamana dhaifu zaidi katika molekuli za viitikio.
Katika nadharia ya uanzishaji, ushawishi joto juu ya kiwango cha mmenyuko wa kemikali inaelezewa na equation ya Arrhenius kwa kiwango cha mara kwa mara cha mmenyuko wa kemikali:
wapi LAKINI ni sababu ya mara kwa mara ambayo haitegemei joto na imedhamiriwa na asili ya reactants; e ni msingi wa logarithm asili; E a ni nishati ya uanzishaji; R ni gesi ya molar mara kwa mara.
Kama ifuatavyo kutoka kwa mlinganyo wa Arrhenius, kadiri kasi inavyoongezeka ya mmenyuko, ndivyo nishati ya kuwezesha inavyopungua. Hata kupungua kidogo kwa nishati ya uanzishaji (kwa mfano, wakati kichocheo kinapoanzishwa) husababisha ongezeko kubwa la kiwango cha majibu.
Kwa mujibu wa equation ya Arrhenius, ongezeko la joto husababisha kuongezeka kwa kiwango cha mara kwa mara cha mmenyuko wa kemikali. Thamani kubwa zaidi E a, ndivyo athari ya halijoto inavyoonekana zaidi kwenye kasi ya mmenyuko na, kwa hiyo, ndivyo mgawo wa halijoto wa kasi ya mmenyuko unavyoongezeka.
Athari ya kichocheo kwenye kasi ya mmenyuko wa kemikali. Kichocheo cha homogeneous na tofauti. Vipengele vya nadharia ya catalysis ya homogeneous. Nadharia ya misombo ya kati. Vipengele vya nadharia ya kichocheo tofauti. Vituo vinavyofanya kazi na jukumu lao katika kichocheo tofauti. Dhana ya adsorption. Ushawishi wa kichocheo kwenye nishati ya kuwezesha athari ya kemikali. Catalysis katika asili, sekta, teknolojia. kichocheo cha biochemical. Vimeng'enya.
1. kutoka. 108-109; 2. kutoka. 170-173; 3. kutoka. 218-223; 4 . kutoka. 197-199; 6. kutoka. 213-222; 7. kutoka. 197-202.; 8. kutoka. 21-22.
kichocheo inayoitwa mabadiliko katika kiwango cha mmenyuko wa kemikali chini ya ushawishi wa vitu, idadi na asili ambayo baada ya kukamilika kwa mmenyuko hubakia sawa na kabla ya majibu..
Kichocheo - Hii ni dutu ambayo hubadilisha kiwango cha mmenyuko wa kemikali na kubaki bila kubadilika baada yake.
kichocheo chanya huharakisha majibu kichocheo hasi, au kizuizi hupunguza kasi ya majibu.
Katika hali nyingi, athari ya kichocheo inaelezewa na ukweli kwamba inapunguza nishati ya uanzishaji wa majibu. Kila moja ya michakato ya kati inayohusisha kichocheo huendelea na nishati ya chini ya kuwezesha kuliko majibu yasiyo ya kichocheo.
Katika kichocheo cha homogeneous kichocheo na viitikio huunda awamu moja (suluhisho). Katika kichocheo tofauti kichocheo (kawaida kigumu) na viitikio viko katika awamu tofauti.
Katika kipindi cha kichocheo cha homogeneous, kichocheo huunda kiwanja cha kati na reagent, ambayo humenyuka na reagent ya pili kwa kiwango cha juu au hutengana kwa haraka na kutolewa kwa bidhaa ya majibu.
Mfano wa kichocheo cha homogeneous: uoksidishaji wa oksidi ya sulfuri (IV) hadi oksidi ya sulfuri (VI) na oksijeni katika njia ya nitrojeni ya kuzalisha asidi ya sulfuriki (hapa kichocheo ni oksidi ya nitrojeni (II), ambayo humenyuka kwa urahisi na oksijeni).
Katika kichocheo tofauti, majibu huendelea kwenye uso wa kichocheo. Hatua za awali ni uenezaji wa chembe zinazoathiriwa kwa kichocheo na zao adsorption(yaani kunyonya) kwa uso wa kichocheo. Molekuli za reajenti huingiliana na atomi au vikundi vya atomi vilivyo kwenye nyuso za kichocheo, na kutengeneza. viunganisho vya uso wa kati. Ugawaji upya wa wiani wa elektroni unaotokea katika misombo ya kati kama hiyo husababisha kuundwa kwa vitu vipya, ambavyo desorbed, yaani, huondolewa kwenye uso.
Mchakato wa malezi ya misombo ya uso wa kati hutokea vituo vya kazi kichocheo - kwenye maeneo ya uso yenye sifa ya usambazaji maalum wa wiani wa elektroni.
Mfano wa kichocheo cha aina tofauti: uoksidishaji wa oksidi ya sulfuri (IV) hadi oksidi ya sulfuri (VI) na oksijeni katika njia ya mguso wa kutoa asidi ya sulfuriki (oksidi ya vanadiamu (V) yenye viungio inaweza kuwa kichocheo hapa).
Mifano ya michakato ya kichocheo katika tasnia na teknolojia: muundo wa amonia, muundo wa asidi ya nitriki na sulfuri, kupasuka na urekebishaji wa mafuta, kuchomwa kwa bidhaa za mwako usio kamili wa petroli kwenye magari, nk.
Mifano ya michakato ya kichocheo katika asili ni mingi, kwani wengi athari za biochemical- athari za kemikali zinazotokea katika viumbe hai - ni kati ya athari za kichocheo. Athari hizi huchochewa na protini zinazoitwa vimeng'enya. Kuna takriban enzymes elfu 30 kwenye mwili wa mwanadamu, ambayo kila moja huchochea kupita kwa mchakato mmoja tu au aina moja ya michakato (kwa mfano, ptyalin kwenye mate huchochea ubadilishaji wa wanga kuwa sukari).
usawa wa kemikali. Athari za kemikali zinazoweza kutenduliwa na zisizoweza kutenduliwa. hali ya usawa wa kemikali. Usawa wa kemikali mara kwa mara. Mambo ambayo huamua thamani ya usawa wa mara kwa mara: asili ya reactants na joto. Badilisha katika usawa wa kemikali. Ushawishi wa mabadiliko katika mkusanyiko, shinikizo na joto kwenye nafasi ya usawa wa kemikali.
1. kutoka. 109-115; 2. kutoka. 176-182; 3 . kutoka. 184-195, uku. 207-209; 4. uk.172-176, uk. 187-188; 5. kutoka. 51-54; 8 . kutoka. 24-31.
Athari za kemikali, kama matokeo ambayo vitu vya awali vinabadilishwa kabisa kuwa bidhaa za majibu, huitwa isiyoweza kutenduliwa. Matendo yanayotokea wakati huo huo katika pande mbili tofauti (mbele na nyuma) huitwainayoweza kutenduliwa.
Katika athari zinazoweza kugeuzwa, hali ya mfumo ambayo viwango vya athari ya mbele na ya nyuma ni sawa () inaitwa. hali ya usawa wa kemikali. Usawa wa kemikali ni yenye nguvu, yaani, kuanzishwa kwake haimaanishi kukomesha majibu. Katika hali ya jumla, kwa athari yoyote inayoweza kubadilishwa аА + bB ↔ dD + eE, bila kujali utaratibu wake, uhusiano unatimizwa:
Katika usawa wa kutosha, bidhaa ya viwango vya bidhaa za mmenyuko, inajulikana kwa bidhaa ya viwango vya vifaa vya kuanzia, kwa majibu fulani kwa joto fulani ni thamani ya mara kwa mara inayoitwa. usawa mara kwa mara(KWA).
Thamani ya mara kwa mara ya usawa inategemea asili ya reactants na joto, lakini haitegemei viwango vya vipengele vya mchanganyiko wa usawa.
Kubadilisha hali (joto, shinikizo, mkusanyiko), ambayo mfumo uko katika hali ya usawa wa kemikali (), husababisha usawa. Kama matokeo ya mabadiliko ya usawa katika viwango vya athari za moja kwa moja na za nyuma () kwa wakati, usawa mpya wa kemikali () umeanzishwa katika mfumo, unaolingana na hali mpya. Mpito kutoka hali moja ya usawa hadi nyingine inaitwa kuhama, au uhamishaji, wa nafasi ya usawa..
Ikiwa, wakati wa mpito kutoka kwa hali moja ya usawa hadi nyingine, viwango vya vitu vilivyorekodiwa upande wa kulia wa equation ya mmenyuko huongezeka, wanasema hivyo. usawa hubadilika kwenda kulia. Ikiwa, wakati wa mpito kutoka kwa hali moja ya usawa hadi nyingine, viwango vya vitu vilivyorekodiwa upande wa kushoto wa equation ya mmenyuko huongezeka, wanasema hivyo. usawa hubadilika kwenda kushoto.
Mwelekeo wa mabadiliko ya usawa wa kemikali kama matokeo ya mabadiliko katika hali ya nje imedhamiriwa na Kanuni ya Le Chatelier: Ikiwa ushawishi wa nje unafanywa kwenye mfumo ulio katika hali ya usawa wa kemikali, basi itapendelea mtiririko wa moja ya michakato miwili kinyume ambayo inadhoofisha ushawishi huu.
Kulingana na kanuni ya Le Chatelier,
Kuongezeka kwa mkusanyiko wa sehemu iliyoandikwa upande wa kushoto wa equation husababisha kuhama kwa usawa kwa haki; ongezeko la mkusanyiko wa sehemu iliyoandikwa upande wa kulia wa equation husababisha kuhama kwa usawa kwa kushoto;
Kwa ongezeko la joto, mabadiliko ya usawa katika mwelekeo wa mmenyuko wa mwisho wa joto, na kwa kupungua kwa joto, kwa mwelekeo wa mmenyuko wa exothermic;
Kwa kuongezeka kwa shinikizo, usawa hubadilika kuelekea mmenyuko ambao hupunguza idadi ya molekuli za vitu vya gesi kwenye mfumo, na kwa kupungua kwa shinikizo, kuelekea mmenyuko ambao huongeza idadi ya molekuli za vitu vya gesi.
Photochemical na athari za mnyororo. Vipengele vya mwendo wa athari za picha. Athari za picha na wanyamapori. Athari za kemikali zisizo na matawi na matawi (kwa mfano wa athari za malezi ya kloridi hidrojeni na maji kutoka kwa vitu rahisi). Masharti ya kuanzisha na kukomesha minyororo.
2. kutoka. 173-176; 3. kutoka. 224-226; 4. 193-196; 6. kutoka. 207-210; 8. kutoka. 49-50.
Athari za Photochemical - Hizi ni athari ambazo hufanyika chini ya ushawishi wa mwanga. Mmenyuko wa fotokemikali huendelea ikiwa kitendanishi kinachukua kiasi cha mionzi, ambayo ina sifa ya nishati ambayo ni mahususi kwa majibu haya.
Katika kesi ya baadhi ya athari za photochemical, kwa kunyonya nishati, molekuli za reactant hupita katika hali ya msisimko, i.e. kuwa hai.
Katika hali nyingine, mmenyuko wa fotokemikali huendelea ikiwa kiasi cha nishati ya juu sana hufyonzwa hadi vifungo vya kemikali huvunjwa na molekuli kujitenga na kuwa atomi au vikundi vya atomi.
Kiwango cha mmenyuko wa pichakemikali ni kubwa zaidi, ndivyo nguvu ya mionzi inavyoongezeka.
Mfano wa athari ya picha katika wanyamapori: usanisinuru, i.e. malezi na viumbe vya vitu vya kikaboni vya seli kutokana na nishati ya mwanga. Katika viumbe vingi, photosynthesis hufanyika kwa ushiriki wa klorophyll; katika kesi ya mimea ya juu, photosynthesis ni muhtasari wa equation:
CO 2 + H 2 O viumbe hai + O 2
Utendaji wa maono pia unategemea michakato ya picha.
Mwitikio wa mnyororo - mmenyuko, ambayo ni mlolongo wa vitendo vya msingi vya mwingiliano, na uwezekano wa kutokea kwa kila kitendo cha mwingiliano inategemea mafanikio ya kifungu cha kitendo kilichopita..
hatua mmenyuko wa mnyororo:
Asili ya mnyororo
maendeleo ya mnyororo,
Kuvunja mnyororo.
Asili ya mnyororo hutokea wakati, kwa sababu ya chanzo cha nje cha nishati (quantum ya mionzi ya umeme, inapokanzwa, kutokwa kwa umeme), chembe za kazi na elektroni zisizoharibika (atomi, radicals bure) huundwa.
Wakati wa maendeleo ya mnyororo, radicals huingiliana na molekuli za awali, na radicals mpya huundwa katika kila tendo la mwingiliano.
Kukomesha kwa mnyororo hutokea ikiwa radicals mbili zinagongana na kuhamisha nishati iliyotolewa katika kesi hii kwa mwili wa tatu (molekuli inayostahimili kuoza, au ukuta wa chombo). Mnyororo pia unaweza kusitishwa ikiwa radical isiyofanya kazi itaundwa.
Aina mbili athari za minyororo: isiyo na matawi na yenye matawi.
KATIKA isiyo na matawi athari katika hatua ya ukuaji wa mnyororo, itikadi kali moja mpya huundwa kutoka kwa itikadi kali moja.
KATIKA yenye matawi athari katika hatua ya ukuzaji wa mnyororo, zaidi ya radikali moja mpya huundwa kutokana na mwitikio mmoja mkali.
6. Mambo ambayo huamua mwelekeo wa mmenyuko wa kemikali. Vipengele vya thermodynamics ya kemikali. Dhana: awamu, mfumo, mazingira, macro- na microstates. Tabia za msingi za thermodynamic. Nishati ya ndani ya mfumo na mabadiliko yake katika mwendo wa mabadiliko ya kemikali. Enthalpy. Uwiano wa enthalpy na nishati ya ndani ya mfumo. Enthalpy ya kawaida ya dutu. Mabadiliko ya enthalpy katika mifumo wakati wa mabadiliko ya kemikali. Athari ya joto (enthalpy) ya mmenyuko wa kemikali. Michakato ya exo- na endothermic.
1. kutoka. 89-97; 2. kutoka. 158-163, uk. 187-194; 3. kutoka. 162-170; 4. kutoka. 156-165; 5. kutoka. 39-41; 6. kutoka. 174-185; 8. kutoka. 32-37.
Thermodynamics husoma mifumo ya ubadilishanaji wa nishati kati ya mfumo na mazingira, uwezekano, mwelekeo na mipaka ya mtiririko wa moja kwa moja wa michakato ya kemikali.
Mfumo wa Thermodynamic(au kwa urahisi mfumo) – mwili au kikundi cha miili inayoingiliana inayotambulika kiakili angani. Nafasi iliyobaki nje ya mfumo inaitwa mazingira(au kwa urahisi mazingira) Mfumo huo umetenganishwa na mazingira na uso halisi au wa kufikiria .
mfumo wa homogeneous lina awamu moja mfumo tofauti- kutoka awamu mbili au zaidi.
awamulakini –hii ni sehemu ya mfumo, yenye usawa katika sehemu zake zote katika muundo wa kemikali na mali na kutengwa na awamu zingine za mfumo na kiolesura.
Jimbo mfumo ni sifa ya jumla ya mali yake ya kimwili na kemikali. hali ya jumla imedhamiriwa na vigezo vya wastani vya seti nzima ya chembe za mfumo, na hali ndogo- vigezo vya kila chembe ya mtu binafsi.
Vigezo vya kujitegemea vinavyoamua macrostate ya mfumo huitwa vigezo vya thermodynamic; au vigezo vya serikali. Joto kawaida huchaguliwa kama kigezo cha serikali. T, shinikizo R, kiasi V, kiasi cha kemikali n, umakini kutoka na kadhalika.
Kiasi cha kimwili, thamani ambayo inategemea tu vigezo vya serikali na haitegemei njia ya mpito kwa hali fulani, inaitwa. kazi ya serikali. Kazi za serikali ni, haswa:
U- nishati ya ndani;
H- enthalpy;
S- entropy;
G Nishati ya Gibbs (au nishati ya bure, au uwezo wa isobaric-isothermal).
Nishati ya ndani ya mfumo U – hii ni nishati yake ya jumla, inayojumuisha nishati ya kinetic na uwezo wa chembe zote za mfumo (molekuli, atomi, nuclei, elektroni) bila kuzingatia nishati ya kinetic na uwezo wa mfumo kwa ujumla. Kwa kuwa akaunti kamili ya vipengele hivi vyote haiwezekani, basi katika utafiti wa thermodynamic wa mfumo, tunazingatia mabadiliko nishati yake ya ndani wakati wa mpito kutoka jimbo moja ( U 1) kwa mwingine ( U 2):
U 1 U 2 DU = U 2 - U 1
Mabadiliko katika nishati ya ndani ya mfumo yanaweza kuamua kwa majaribio.
Mfumo unaweza kubadilishana nishati (joto Q) na mazingira na kufanya kazi LAKINI, au, kinyume chake, kazi inaweza kufanyika kwenye mfumo. Kulingana na sheria ya kwanza ya thermodynamics, ambayo ni matokeo ya sheria ya uhifadhi wa nishati, joto lililopokelewa na mfumo linaweza kutumika tu kuongeza nishati ya ndani ya mfumo na kufanya kazi na mfumo:
Katika siku zijazo, tutazingatia mali ya mifumo hiyo, ambayo haiathiriwa na nguvu nyingine yoyote, isipokuwa kwa nguvu za shinikizo la nje.
Ikiwa mchakato katika mfumo unaendelea kwa kiasi cha mara kwa mara (yaani, hakuna kazi dhidi ya nguvu za shinikizo la nje), basi A = 0. Kisha athari ya jotomchakato kwa kiasi cha mara kwa mara, Q v ni sawa na mabadiliko katika nishati ya ndani ya mfumo:
Q v = ΔU
Athari nyingi za kemikali zinazopatikana katika maisha ya kila siku hufanyika kwa shinikizo la mara kwa mara ( michakato ya isobaric) Ikiwa hakuna nguvu zingine zinazofanya kazi kwenye mfumo, isipokuwa kwa shinikizo la nje la mara kwa mara, basi:
A \u003d p (V 2 -V 1) \u003d pDV
Kwa hivyo, kwa upande wetu ( R= const):
Q p \u003d U 2 - U 1 + p (V 2 - V 1), imetoka wapi
Q p \u003d (U 2 + pV 2) - (U 1 + pV 1)
Kazi U+PV, inaitwa enthalpy; inaonyeshwa na barua H . Enthalpy ni kazi ya serikali na ina mwelekeo wa nishati (J).
Q p \u003d H 2 - H 1 \u003d DH
Athari ya joto ya mmenyuko kwa shinikizo la mara kwa mara na halijoto T ni sawa na mabadiliko katika enthalpy ya mfumo wakati wa majibu. Inategemea asili ya viitikio na bidhaa, hali yao ya kimwili, hali ( T, r) kutekeleza majibu, pamoja na kiasi cha vitu vinavyohusika katika majibu.
Enthalpy ya majibuinayoitwa mabadiliko katika enthalpy ya mfumo ambapo viitikio huingiliana kwa kiasi sawa na coefficients stoichiometric ya equation ya majibu..
Enthalpy ya mmenyuko inaitwa kiwango, ikiwa viitikio na bidhaa za athari ziko katika hali ya kawaida.
Majimbo ya kawaida ni:
Kwa dutu thabiti, fuwele ya mtu binafsi katika 101.32 kPa,
Kwa dutu ya kioevu, dutu ya kioevu ya mtu binafsi katika 101.32 kPa,
Kwa dutu ya gesi - gesi kwa shinikizo la sehemu ya 101.32 kPa,
Kwa solute, dutu katika suluhisho kwa molality ya 1 mol / kg, ufumbuzi unachukuliwa kuwa na mali ya ufumbuzi usio na kipimo.
Enthalpy ya kawaida ya mmenyuko wa malezi ya mole 1 ya dutu fulani kutoka kwa vitu rahisi inaitwa kiwango enthalpy ya malezi dutu hii.
Mfano wa kurekodi: D f H o 298(CO 2) \u003d -393.5 kJ / mol.
Enthalpy ya kawaida ya uundaji wa dutu rahisi ambayo iko katika hali ya uthabiti zaidi (kwa kupewa p na T) inachukuliwa kuwa 0. Ikiwa kipengee kinaunda marekebisho kadhaa ya allotropiki, basi ile iliyoimara zaidi ndiyo iliyo na enthalpy ya kiwango cha sifuri ya malezi (kwa kupewa. R Na T) marekebisho.
Kawaida, wingi wa thermodynamic huamua saa hali ya kawaida:
R= 101.32 kPa na T\u003d 298 K (25 ° C).
Equations za kemikali zinazoonyesha mabadiliko katika enthalpy (athari za joto za athari) zinaitwa milinganyo ya thermochemical. Kuna aina mbili za uandishi wa milinganyo ya joto katika fasihi.
Aina ya thermodynamic ya equation ya thermochemical:
C (graphite) + O 2 (g) ® CO 2 (g); DH au 298= -393.5 kJ
Fomu ya thermochemical ya equation ya thermochemical kwa mchakato sawa:
C (graphite) + O 2 (g) ® CO 2 (g) + 393.5 kJ.
Katika thermodynamics, athari za joto za taratibu zinazingatiwa kutoka kwa mtazamo wa mfumo, kwa hiyo, ikiwa mfumo hutoa joto, basi. Q<0, а энтальпия системы уменьшается (ΔH< 0).
Katika thermochemistry ya classical, athari za joto huzingatiwa kutoka kwa mtazamo wa mazingira, kwa hiyo, ikiwa mfumo hutoa joto, basi inachukuliwa kuwa. Q>0.
exothermic ni mchakato unaoendelea na kutolewa kwa joto (ΔH<0).
endothermic mchakato unaoendelea na ufyonzaji wa joto (ΔH>0) unaitwa.
Sheria ya msingi ya thermochemistry ni Sheria ya Hess: athari ya joto ya mmenyuko imedhamiriwa tu na majimbo ya awali na ya mwisho ya mfumo na haitegemei njia ya mabadiliko ya mfumo kutoka hali moja hadi nyingine.
Matokeo kutoka kwa sheria ya Hess : athari ya kawaida ya joto ya mmenyuko ni sawa na jumla ya joto la kawaida la malezi ya bidhaa za majibu ukiondoa jumla ya joto la kawaida la malezi ya vitu vya kuanzia, kwa kuzingatia mgawo wa stoichiometric:
DH o 298 (p-tion) = åD f H o 298 (inaendelea) –åD f H o 298 (inayotoka)
7. Wazo la entropy. Mabadiliko ya Entropy wakati wa mabadiliko ya awamu na michakato ya kemikali. Dhana ya uwezekano wa isobaric-isothermal ya mfumo (nishati ya Gibbs, nishati ya bure). Uwiano kati ya ukubwa wa mabadiliko katika nishati ya Gibbs na ukubwa wa mabadiliko katika enthalpy na entropy ya mmenyuko (uhusiano wa msingi wa thermodynamic). Uchambuzi wa Thermodynamic wa uwezekano na hali ya kutokea kwa athari za kemikali. Vipengele vya mwendo wa michakato ya kemikali katika viumbe hai.
1. kutoka. 97-102; 2. kutoka. 189-196; 3. kutoka. 170-183; 4. kutoka. 165-171; 5. kutoka. 42-44; 6. kutoka. 186-197; 8. kutoka. 37-46.
Entropy S- ni thamani sawia na logaritimu ya idadi ya serikali ndogo zinazoweza kuwiana ambapo macrostate fulani inaweza kupatikana:
Sehemu ya entropy ni J/mol·K.
Entropy ni kipimo cha kiasi cha kiwango cha shida katika mfumo.
Entropy huongezeka wakati wa mpito wa dutu kutoka kwa hali ya fuwele hadi hali ya kioevu na kutoka kwa kioevu hadi hali ya gesi, wakati wa kufutwa kwa fuwele, wakati wa upanuzi wa gesi, wakati wa mwingiliano wa kemikali unaosababisha kuongezeka kwa idadi ya chembe; na juu ya chembe zote katika hali ya gesi. Kinyume chake, taratibu zote, kama matokeo ambayo kuagiza kwa mfumo huongezeka (condensation, upolimishaji, compression, kupunguza idadi ya chembe), hufuatana na kupungua kwa entropy.
Kuna njia za kuhesabu thamani kamili ya entropy ya dutu, kwa hiyo, katika jedwali la sifa za thermodynamic za dutu binafsi, data hutolewa kwa S0, si kwa Δ S0.
Entropy ya kawaida ya dutu rahisi, tofauti na enthalpy ya malezi ya dutu rahisi, si sawa na sifuri.
Kwa entropy, taarifa sawa na ile iliyozingatiwa hapo juu kwa DH: mabadiliko katika entropy ya mfumo kama matokeo ya mmenyuko wa kemikali (DS) ni sawa na jumla ya entropies ya bidhaa za mmenyuko ukiondoa jumla ya entropies ya dutu ya awali. Kama katika hesabu ya enthalpy, muhtasari unafanywa kwa kuzingatia mgawo wa stoichiometric.
Mwelekeo ambao mmenyuko wa kemikali huendelea kwa hiari imedhamiriwa na hatua ya pamoja ya mambo mawili: 1) tabia ya mfumo wa mpito hadi hali yenye nishati ya chini ya ndani (katika kesi ya michakato ya isobaric).-na enthalpy ya chini kabisa) 2) tabia ya kufikia hali inayowezekana zaidi, i.e., hali ambayo inaweza kupatikana kwa idadi kubwa ya njia zinazowezekana (microstates):
Δ H → dakika,Δ S→ upeo
Kazi ya serikali, ambayo wakati huo huo inaonyesha ushawishi wa mielekeo yote miwili iliyotajwa hapo juu juu ya mwelekeo wa michakato ya kemikali, ni. Nishati ya Gibbs (nishati ya bure , au uwezo wa isobaric-isothermal) , kuhusiana na enthalpy na entropy kwa uhusiano
G=H-TS,
wapi T ni joto kabisa.
Kama unavyoona, nishati ya Gibbs ina kipimo sawa na enthalpy, na kwa hivyo kawaida huonyeshwa kwa J au kJ.
Kwa michakato ya isobaric-isothermal, (yaani michakato inayotokea kwa halijoto isiyobadilika na shinikizo) mabadiliko katika nishati ya Gibbs ni sawa na:
Kama ilivyo kwa D H na D S, Gibbs mabadiliko ya nishati D G kama matokeo ya mmenyuko wa kemikali(Nishati ya Gibbs ya majibu) ni sawa na jumla ya nguvu za Gibbs za uundaji wa bidhaa za athari ukiondoa jumla ya nguvu za Gibbs za uundaji wa vitu vya awali; muhtasari unafanywa kwa kuzingatia idadi ya moles ya vitu vinavyohusika katika mmenyuko.
Nishati ya Gibbs ya uundaji wa dutu inahusiana na mole 1 ya dutu hii na kwa kawaida huonyeshwa katika kJ/mol; huku D G 0 ya uundaji wa muundo thabiti zaidi wa dutu rahisi inachukuliwa sawa na sifuri.
Kwa joto la mara kwa mara na shinikizo, athari za kemikali zinaweza kuendelea tu kwa mwelekeo huo, ambayo nishati ya Gibbs ya mfumo hupungua ( D G<0).Hili ni sharti la uwezekano wa kimsingi wa kutekeleza mchakato huu.
Jedwali hapa chini linaonyesha uwezekano na masharti ya majibu kuendelea na michanganyiko mbalimbali ya ishara D H na D S.
Kwa ishara D G mtu anaweza kuhukumu uwezekano (haiwezekani) kwa hiari uvujaji mtu binafsi mchakato. Ikiwa mfumo hutolewa athari, basi inawezekana kufanya mabadiliko kutoka kwa dutu moja hadi nyingine, inayojulikana na ongezeko la nishati ya bure (D G>0). Kwa mfano, katika seli za viumbe hai athari za malezi ya misombo tata ya kikaboni huendelea; nguvu ya uendeshaji wa michakato hiyo ni mionzi ya jua na athari za oxidation katika seli.