21-01-2013, 21:54
Antibakteriaalsete ravimite klassifikatsioon põhineb nendel molekulaarne struktuur, kuna struktuurselt identsetel rühmadel on sarnased farmakodünaamilised ja farmakokineetilised parameetrid. Antibakteriaalsete ravimite klassifikatsioon on esitatud tabelis. üksteist.
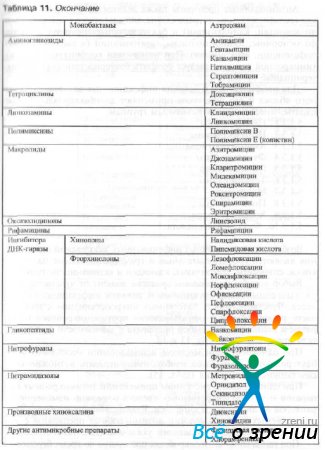
Tabel 11 Antibakteriaalsete ravimite klassifikatsioon
Ennetamiseks ja raviks nakkushaigused silmamuna ja selle lisasid kasutatakse antibakteriaalsed ravimid kuuludes erinevatesse rühmadesse.
- Penitsilliinid
- Tsefalosporiinid
- Aminoglükosiidid
- Fluorokinoloonid
- Glükopeptiidid
- Tetratsükliinid
- makroliidid
- Polümüksiinid
- Kloramfenikool
- Fusidiinhape.
Nägemisorgani mitmesuguste nakkushaiguste tekitajad on gramnegatiivsed ja grampositiivsed vardad ja kookid, spiroheedid, mükoplasma, klamüüdia ja aktinomütseedid (tabel 12).
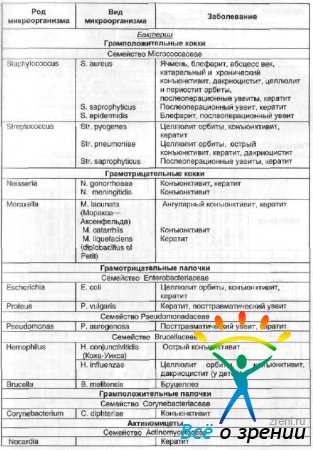
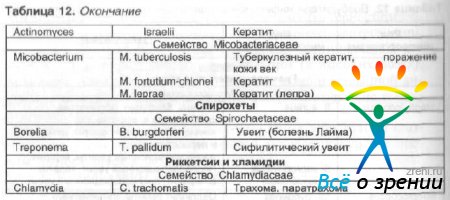
Tabel 12 Nägemisorgani nakkushaiguste tekitajad
Antibakteriaalse aine valik sõltub tundlikkusest patogeensed mikroorganismid ja gravitatsiooni nakkusprotsess. Patogeensete mikroorganismide tundlikkus oftalmoloogias enamkasutatavate antimikroobsete ravimite suhtes ja ravimi ratsionaalne valik sõltuvalt patogeenist on toodud tabelis. 13 ja 14.
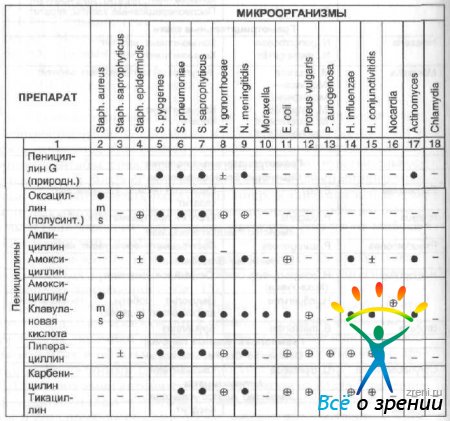
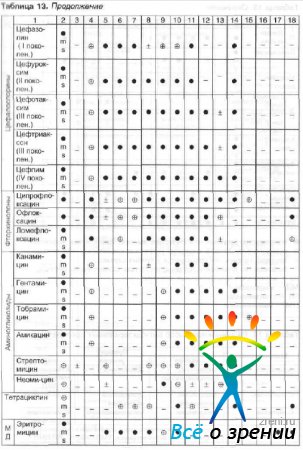
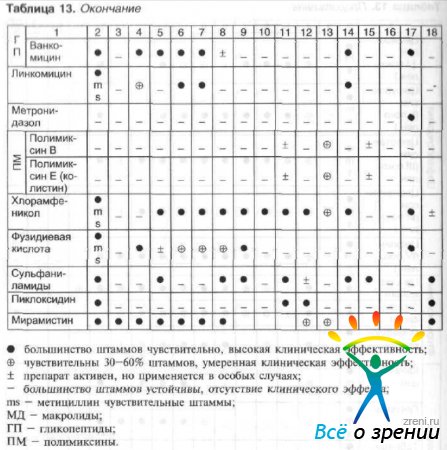
Tabel 13 Antimikroobsed spektrid
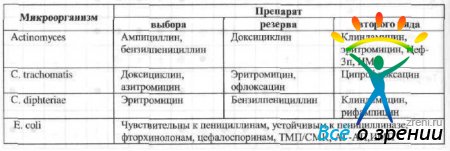

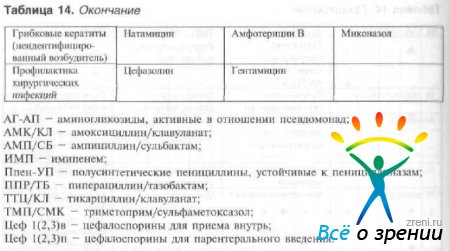
Tabel 14 Ratsionaalne antibiootikumide valik
Mitme antibakteriaalse ravimi samaaegsel kohalikul kasutamisel tuleb arvestada nende kombineeritud kasutamise võimalusega (tabel 15).
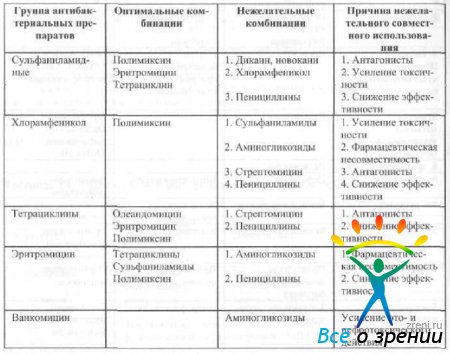
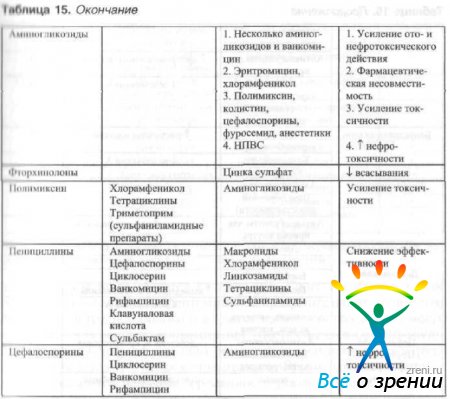
Tabel 15 Kombinatsiooni efektiivsus kohalik rakendus antibakteriaalsed ained
Samal ajal süsteemne kasutamine antimikroobsed ained ja teised ravimid on võimalik muuta nende dünaamika ja kineetika parameetreid. Oftalmoloogias kõige sagedamini kasutatavate antimikroobsete ravimite koostoime teiste ravimitega on näidatud tabelis. kuusteist.
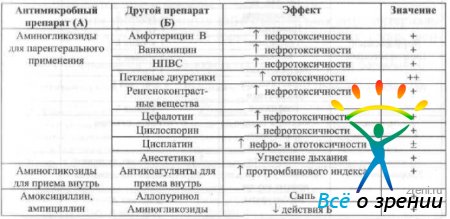
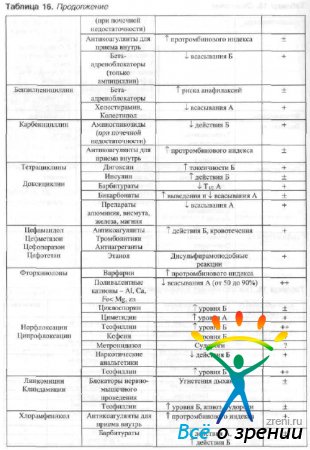
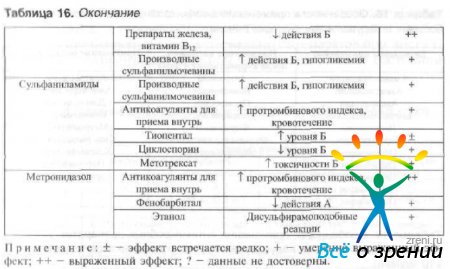
Tabel 16 Ravimite koostoimed
Antimikroobsete ravimite väljakirjutamisel raseduse ja imetamise ajal tuleb arvesse võtta ravimi transplatsentaarset läbimist ja selle võimet erituda ema piim. Oksatsilliin ei eritu rinnapiima. Antibiootikumid nagu gentamütsiin, kolistiin, streptomütsiin väikestes kogustes tungivad sisse rinnapiim ja vastsündinute vereplasmas saab määrata nende ravimite väikese kontsentratsiooni (kuni 0,05 mg / l). Ampitsilliin, bensüülpenitsilliin, erütromütsiin kogunevad rinnapiima märkimisväärses kontsentratsioonis. Soovitused ravimite kasutamiseks raseduse ajal on toodud tabelis. 17.

Tabel 17 Antimikroobsete ainete kasutamine raseduse ajal
Antimikroobsete ravimite määramisel maksa- ja neeruhaigustega patsientidele on oluline teada nende kineetika iseärasusi. Soovitused antimikroobikumide annustamiseks sellele patsientide rühmale on esitatud tabelis. 18 ja 19.

Tabel 18 Antimikroobsete ravimite kasutamise tunnused maksafunktsiooni kahjustusega patsientidel

Tabel 19 Antimikroobsete ravimite kasutamise tunnused raske neerukahjustusega patsientidel (kreatiniini kliirens<10 мл/мин)
Nakkuslike silmahaiguste ravis ei kasutata antibakteriaalseid ravimeid mitte ainult oftalmiliste ravimvormide (silmatilgad, salvid ja kiled), vaid ka süstitavate (subkonjunktivaalne, parabulbaarne, intramuskulaarne ja intravenoosne süstimine) kujul ning ravimite intraokulaarne manustamine. laialdaselt kasutatud.
Parenteraalsel manustamisel tuleb arvestada ravimi võimega tungida läbi vere-oftalmilise barjääri. Klooramfenikool, sulfoonamiidid, penitsilliinid, aminoglükosiidid, linkomidiin, tsefalosporiinid, fluorokinoloonid tungivad hästi läbi hematooftalmilise barjääri, tetratsükliinid, erütromütsiin, polümüksiinid läbivad barjääri halvasti. Kõige sagedamini kasutatavate antibakteriaalsete ravimite keskmised annused instillatsiooniks, subkonjunktiiviks, silmasiseseks ja süsteemseks kasutamiseks on toodud tabelis. 20.
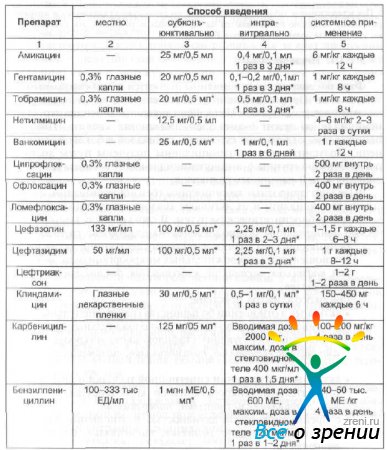
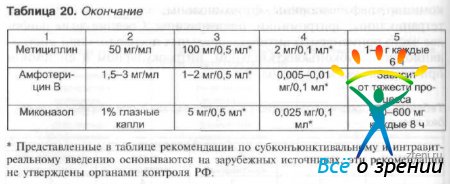
Tabel 20 Antibiootikumide keskmised annused täiskasvanutele erinevatel manustamisviisidel
Penitsilliinid
Farmakodünaamika: Penitsilliinid on beetalaktaamantibiootikumid. Looduslikke penitsilliinid sünteesivad teatud tüüpi seened (Penicillium notatum). Penitsilliinide struktuur põhineb 6-aminoenitsillaanhappel. Penitsilliini homoloogid erinevad külgmise aminoahela radikaalide struktuuri poolest. Poolsünteetilised penitsilliinid saadakse 6-aminopenitsillaanhappe aminorühma atsetüülimisel ja sellele erinevate radikaalide lisamisel.
Eraldage sünteetiliselt või biosünteetiliselt saadud looduslikud penitsilliinid (bensüülpenitsilliin, fenoksümetüülpenitsilliin) ja nende aktiivsed analoogid. Poolsünteetilised penitsilliinid jagunevad omakorda järgmistesse rühmadesse:
- penitsillinaasiresistentne, millel on valdav toime grampositiivsete mikroorganismide vastu: metitsilliin, naftsilliin, oksatsilliin, kloksatsilliin, dikloksatsilliin, flukloksatsilliin;
- lai valik toimingud:
- aktiivne enamiku gramnegatiivsete (v.a Pseudomonas aeruginosa) ja grampositiivsete (v.a penitsillinaasi moodustavad stafülokokid) mikroorganismide vastu: ampitsilliin, getatsilliin, pivampitsilliin, talampitsilliin, amoksitsilliin;
- aktiivne Pseudomonas aeruginosa ja teiste gramnegatiivsete mikroorganismide vastu: karbenitsilliin, tikartsilliin, aslotsilliin, metslotsilliin, piperatsilliin;
- valdava toimega gramnegatiivsete bakterite vastu: metsilliin, pivmetsilliin, bakmetsilliin, atsidotsilliin;
- kombineeritud antibiootikumid: ampioks;
- happeresistentsed antibiootikumid, kuid inaktiveeritud penitsillinaasiga: fenetsilliin, propitsilliin.
Antibakteriaalse toime spekter sõltub penitsilliinide struktuurist ja erineb looduslike ja poolsünteetiliste preparaatide puhul (vt täpsemalt tabel 13).
Penitsilliinid häirida rakuseina biosünteesi peatades peptoglükaani sünteesi mikroorganismide rakuseinas. Nad toimivad nii märgistuse sees kui ka väljaspool rakku mikroorganisme. Mõju intratsellulaarsetele mikroorganismidele on vähem väljendunud.
Resistentsus penitsilliinide suhtes tekib tänu ensüümi tootmisele - penitsillinaas(beeta-laktamaas), mis hävitab peptiidsidemed penitsilliini molekulis ja jätab selle ilma bakteritsiidsest toimest.
Mõned poolsünteetilised penitsilliinid on penitsillinaasi suhtes resistentsed, lisaks kasutatakse neid penitsillinaasi suhtes tundlike penitsilliinide efektiivsuse suurendamiseks koos penitsillinaasi inhibiitoritega (klavulaanhape, sulbaktaam).
Farmakokineetika: Penitsilliinid ei tungi hästi läbi hematoentseftalmilise barjääri. Põletikulise protsessi taustal aga suureneb nende tungimine silma sisestruktuuridesse ja penitsilliinide kontsentratsioon silma kudedes võib jõuda terapeutiliselt olulisele tasemele. Penitsilliinid erituvad peamiselt neerude kaudu (80% neerutuubulite kaudu, 20% glomerulaarfiltratsiooni teel). Väikesed kogused erituvad sapiga.
Kui penitsilliini lahused tilgutatakse konjunktiivikotti, leitakse neid terapeutilises kontsentratsioonis sarvkesta stroomas, paikselt manustatuna penitsilliinid praktiliselt silma eeskambri niiskusesse ei tungi.
Subkonjunktivaalsel manustamisel määratakse terapeutilised kontsentratsioonid sarvkestas ja eeskambri niiskuses. Klaaskehas on penitsilliinide kontsentratsioon alla terapeutilise taseme.
Intravitreaalsel manustamisel on poolväärtusaeg umbes 3 tundi.Penitsillinaasi inhibiitorite paralleelsel süsteemsel kasutamisel poolväärtusaeg pikeneb. Penitsilliini minimaalne kontsentratsioon, mis põhjustab võrkkesta toksilisi kahjustusi, on 5000 RÜ.
Näidustused Penitsilliinid on ette nähtud järgmiste haiguste raviks:
- gonokoki konjunktiviit (bensüülpenitsilliin);
- kanalipõletik, eriti need, mida põhjustavad aktinomütseedid (bensüülpenitsilliin, fenoksümetüülpenilliin);
- orbiidi abstsess ja flegmon (fenoksümetüülpenilliin, metitsilliin, oksütsilliin, kloksatsilliin, naftsilliin, dikloksatsilliin, ampitsilliini ja klavulanaadi kombinatsioon, ampitsilliin ja sulbaktaam, tikartsilliin ja klavulanaat);
- keratiit (bensüülpenitsilliin, metitsilliin, oksütsilliin, ampitsilliin, tikartsilliin, piperatsilliin);
- nägemisorgani kahjustus Lyme'i tõve korral (bensüülpenitsilliin);
- nägemisorgani kahjustus süüfilise korral (bensüülpenitsilliin).
Penitsilliinid kasutatakse ka nakkuslike tüsistuste vältimiseks silmalaugude ja silmaorbiidi vigastuste korral, eriti kui võõrkehad tungivad silmaorbiidi kudedesse (ampitsilliini ja klavulanaadi, ampitsilliini ja sulbaktaami, tikartsilliini ja klavulanaadi kombinatsioon).
Vastunäidustused: ülitundlikkus penitsilliini antibiootikumide ja tsefalosporiinide suhtes.
Poolsünteetilised antibiootikumid on vastunäidustatud:
- nakkuslik mononukleoos;
- lümfotsüütiline leukeemia;
- maksafunktsiooni häired;
- bronhiaalastma;
- raske allergiline diatees (amoksitsilliin, karbenitsilliin, ampitsilliin, oksatsilliin);
- mittespetsiifiline haavandiline koliit (karbenitsilliin).
Rakenduse omadused (tuleb ennekõike süsteemse kasutamise korral arvesse võtta).
Amoksitsilliini kombinatsioonis metronidasooliga ei soovitata kasutada alla 18-aastastel isikutel.
Karbenitsilliini ohutus pediaatrias ei ole kindlaks tehtud.
Neerufunktsiooni ja metaboolse aktiivsuse langus eakatel võib nõuda penitsilliinide annuse kohandamist.
Neeru- ja/või maksapuudulikkuse korral on võimalik ravimite kumulatsioon. Mõõduka ja raske neeru- ja/või maksapuudulikkuse korral on vajalik ravimite annuse kohandamine ja süstide vaheliste perioodide pikendamine.
Kasutamine raseduse ajal on võimalik ainult siis, kui oodatav kasu emale kaalub üles võimaliku ohu lootele.
Vajadusel peaks imetamise ajal kasutamine rinnaga toitmise lõpetama.
Kõrvalmõjud:
- Allergilised reaktsioonid - urtikaaria, erüteem, angioödeem, riniit, konjunktiviit. Harvadel juhtudel võib tekkida palavik, liigesevalu, eosinofiilia, üksikjuhtudel - anafülaktiline šokk.
- Kemoterapeutilise toimega seotud mõjud - superinfektsiooni tekkimine. Süsteemse kasutamise korral on võimalik suuõõne, tupe kandidoosi, soole düsbakterioosi areng.
- Seedesüsteemi poolt - süsteemse kasutamise korral tekib iiveldus, oksendamine, kõhulahtisus.
- Kesknärvisüsteemi küljelt - iiveldus, oksendamine. Suurenenud refleksi erutuvus, meningismi sümptomid, krambid, kooma. Neurotoksiline toime areneb bensüülpenitsilliini suurte annuste kasutamisel, eriti nimmepiirkonna sisemise manustamise korral.
- Vere hüübimissüsteemi osa - hemorraagiline sündroom. Täheldatud karbenitsilliini kasutamisel neerufunktsiooni kahjustusega patsientidel.
- Vee-elektrolüütide metabolismi poolelt - hüponatreemia või hüpokaleemia. Seda täheldatakse karbenitsilliini suurte annuste kasutamisel.
- Kuseteede süsteemist - hematuria, proteinuuria, interstitsiaalne nefriit. Täheldatud oksatsilliini kasutamisel.
- Amoksitsilliini kasutamisel koos klavulanaadiga on võimalik kolestaatilise ikteruse teke.
- Kohalikud reaktsioonid - põletustunne.
Annustamine ja manustamine: oftalmoloogias kasutatakse penitsilliinid parenteraalselt, suu kaudu, silmatilkade kujul, samuti manustatakse subkonjunktivaalselt ja intravitreaalselt. Suukaudseks ja parenteraalseks manustamiseks kasutatavad annused vastavad teiste bakteriaalsete haiguste raviks kasutatavatele keskmistele annustele.
Silmatilkade kujul kasutatakse penitsilliinid konjunktiivi ja sarvkesta haiguste raviks. Instillatsioonide sagedus sõltub põletikulise protsessi tõsidusest.
Mõõdukalt raskekujulise nakkusprotsessi korral süstitakse konjunktiivikotti iga 4 tunni järel 1-2 tilka ravimit või asetatakse haige silma alumise silmalau taha 1,5 cm pikkune salviriba 2-3 korda päevas. Raske nakkusprotsessi väljakujunemise korral tilgutatakse ravimit iga tund või asetatakse salvi alumise silmalau taha iga 3-4 tunni järel Põletiku vähenedes väheneb ravimi tilgutamise sagedus. Taotluse kestus ei ületa 14 päeva.
Penitsilliini lahuseid kasutatakse kanalikuliidi ravis pisarajuhade loputamiseks.
Paikseks kasutamiseks mõeldud lahused valmistatakse ex temporae.
- Bensüülpenitsilliin (bensüülpenitsilliin) [PIN]
Konjunktiivikotti tilgutatakse lahus, mis sisaldab 100 000–333 000 U / ml (pediaatrias kasutatakse vastsündinute gonorröa raviks lahuseid, mis sisaldavad 10 000–20 000 U / ml). Instillatsioonilahuse valmistamiseks lahustage 500 000 RÜ 5 ml soolalahuses. Pediaatrias instillatsiooniks kasutatava lahuse valmistamiseks lahustatakse 250 000 ühikut 5 ml soolalahuses, seejärel võetakse 1 ml saadud lahust ja lisatakse 5 ml soolalahust.
Subkonjunktivaalselt süstitakse 0,5-1 miljonit ühikut / 0,5 ml.
Intravitreaalselt ei manustata rohkem kui 2000 ühikut bensüülpenitsilliini. Intravitreaalseks manustamiseks mõeldud lahuse valmistamiseks lahustatakse 250 000 ühikut 5 ml soolalahuses, seejärel võetakse 1 ml saadud lahust ja lisatakse 12 ml soolalahust. Intravitreaalselt süstitakse mitte rohkem kui 0,5 ml saadud lahuse jalga. Paralleelselt määratakse suukaudselt probenetsiidi 0,5 g 4 korda päevas.
- Metitsilliin (metitsilliin) [INN]
Konjunktiivikotti tilgutatakse lahus, mis sisaldab 50 mg / ml.
75-100 mg / 0,5 ml manustatakse subkonjunktivaalselt.
Intravitreaalse süstina manustatakse mitte rohkem kui 2 mg metitsilliini. Paralleelselt määratakse suukaudselt probenetsiidi 0,5 g 4 korda päevas.
- Okeatsilliin (oksatsilliin) [INN]
Konjunktiivikotti tilgutatakse lahus, mis sisaldab 66 mg / ml. Instillatsioonilahuse valmistamiseks lahustatakse 250 mg ainet 4 ml soolalahuses.
75-100 mg / 0,5 ml manustatakse subkonjunktivaalselt. Lahuse valmistamiseks lahustatakse 250 mg ainet 2 (1,5) ml soolalahuses või 500 mg ainet 3,0 (2,5) ml soolalahuses.
Intravitreaalselt ei manustata rohkem kui 500 mikrogrammi oksatsilliini. Intravitreaalseks manustamiseks mõeldud lahuse valmistamiseks lahustatakse 250 mg ainet 5 ml soolalahuses, seejärel võetakse 1 ml saadud lahust ja lisatakse 10 ml soolalahust. Seejärel võtke 1 ml saadud lahust ja lisage 5 ml-ni soolalahust. Sisestage klaaskehasse mitte rohkem kui 0,5 ml saadud lahust.
- Ampitsilliin (ampitsilliin) [INN]
Konjunktiivikotti tilgutatakse lahus, mis sisaldab 50 mg / ml. Instillatsioonilahuse valmistamiseks lahustatakse 250 mg ainet 5 ml soolalahuses.
Subkonjunktivaalne süst 100 mg / 0,5 ml. Lahuse valmistamiseks lahustatakse 250 mg ainet 1,5 ml soolalahuses või 500 mg ainet 2,5 ml soolalahuses.
Intravitreaalselt ei manustata rohkem kui 5000 mkg ampitsilliini. Intravitreaalseks manustamiseks mõeldud lahuse valmistamiseks lahustatakse 250 mg 5 ml soolalahuses, seejärel võetakse 1 ml saadud lahust ja lisatakse 5 ml soolalahust. Sisestage klaaskehasse mitte rohkem kui 0,5 ml saadud lahust.
- Tikartsilliin (Tikartsilliin) [INN]
Konjunktiivikotti tilgutatakse lahus, mis sisaldab 6-20 mg / ml.
Subkonjunktivaalne süst 100 mg / 0,5 ml.
- Pineratsilliin (piperatsilliin) [INN]
Konjunktiivikotti tilgutatakse lahus, mis sisaldab 6-20 mg / ml. Instillatsioonilahuse valmistamiseks lahustatakse 2 g ainet 10 ml soolalahuses. Järgmisena võtke 1 ml määratud lahust ja lisage 10 ml-ni soolalahust.
Subkonjunktivaalne süst 100 mg / 0,5 ml. Lahuse valmistamiseks lahustatakse 2 g ainet 5 ml soolalahuses.
- Karbenitsilliin (INN)
Intravitreaalselt ei manustata rohkem kui 1000-2000 mcg karbenitsilliini. Intravitreaalseks manustamiseks mõeldud lahuse valmistamiseks lahustatakse 1 g ainet 10 ml soolalahuses, seejärel võetakse 1 ml saadud lahust ja lisatakse 10 ml soolalahust. Seejärel võtke 1 ml saadud lahust ja lisage 5 ml-ni soolalahust. Sisestage klaaskehasse mitte rohkem kui 0,5 ml saadud lahust.
Koostoimed teiste ravimitega.
Bakteriostaatiliste ravimitega (makroliidid, klooramfenikool, linkosamiidid, tetratsükliinid, sulfoonamiidid) kombineerimisel väheneb bakteritsiidne toime.
Penitsilliinid (ampitsilliin, oksatsilliin) vähendada suukaudsete rasestumisvastaste vahendite efektiivsust. Probenetsiid, diureetikumid, allopurinool, fenüülbutasoon, MSPVA-d võivad suurendada penitsilliinide plasmakontsentratsiooni. Antatsiidid, glükoosamiin, lahtistid ja aminoglükosiidid aeglustavad suukaudsete penitsilliinide imendumist. Suukaudsed penitsilliinid suurendavad kaudsete antikoagulantide toimet. Karbenitsilliin suurendab mittesteroidsete põletikuvastaste ravimite trombotsüütide vastast toimet.
Farmatseutiline kokkusobimatus ilmneb aminoglükosiidide ja karbenitsilliini kombinatsiooniga.
Penitsilliinide kombinatsioon bakteritsiidsete antibiootikumide ja penitsillinaasi inhibiitoritega põhjustab enamikul juhtudel aktiivsuse muutust. Optimaalne kombinatsioon on penitsilliinide ja aminoglükosiidide, tsefalosporiinide, tsükloseriini, vankomütsiini, rifampitsiini, klavulaanhappe, sulbaktaami kombinatsioon.
Ettevalmistused
- Bensüülpenitsilliini naatriumsool (bensüülpenitsilliini naatriumsool) (Venemaa) - pulber süstelahuse valmistamiseks 250 000, 500 000 ja 1 000 000 RÜ;
- Oksatsilliin (Oxacillin) (Venemaa) - pulber süstelahuse valmistamiseks 250 ja 500 mg;
- Pipracil (Lederle, USA) - 2 ja 4 g piperatsilliini süstelahuse pulber;
- Karbenitsilliini naatriumsool (Venemaa) - pulber süstelahuse valmistamiseks 1 g.
Korraga tegid tavalised hügieenireeglid lähenemises tõelise revolutsiooni. Isegi regulaarne kätepesu on oluliselt vähendanud paljude haiguste, sealhulgas soolehäirete ja mädakollete levikut. Isikuhooldustooted paranevad pidevalt ja täna on turg täis antibakteriaalse toimega tooteid. Kui tõhusad need on, millal neid tuleks kasutada ja millistel juhtudel on parem keelduda, ütleb MedAboutMe.
Antibakteriaalsed hügieenitooted - tooted, mis sisaldavad oma koostises aineid, mis on antibakteriaalsed ained. Kõige sagedamini mängib seda rolli triklosaan, laia toimespektriga antibakteriaalne ja seenevastane komponent. Enamik nahka mõjutavaid seeni, aga ka stafülokokkide ja streptokokkide perekonda kuuluvad bakterid on selle suhtes tundlikud.
Mõnes tootes on koostises triklosaani analoog triklokarbaan. Samuti võivad antibakteriaalse ainena toimida antiseptiline kloorheksidiin, antimikroobne ravim metronidasool ja teised. Tõhususe poolest jäävad need aga triklosaanile oluliselt alla, mistõttu kasutatakse neid harvemini.
Antibakteriaalsed hügieenitooted võivad olla:
- Seep (vedel ja tahke).
- Šampoonid.
- Keha geelid.
- Geelid intiimhügieeniks.
- Deodorandid.
- Hambapasta.
- Suuveed.
- Niisked salvrätikud.
- Pihustid kätele.
Samuti on triklosaan osa paljudest kodukeemiast ja sel juhul märgitakse need antibakteriaalseks. Need võivad olla geelid pindade pesemiseks, tualettide puhastamiseks ja isegi pesupulbrid.
Bakterid on paljude tõsiste haiguste peamine põhjus. Mõned nende mikroorganismide tüübid vabastavad oma elutegevuse käigus eksotoksiine, mida tänapäeval peetakse kõige ohtlikumateks mürkideks ja mis on võimelised esile kutsuma kõige raskemaid üldistatud infektsioone. Just bakterid põhjustavad sepsist, mädapõletikke, raskeid kopsukahjustusi, soolehaigusi ja paljusid muid haigusi.
Kõige sagedamini mõjutavad keha Staphylococcus aureus, Streptococcus aureus, Escherichia coli (suurim oht on siseorganitele). Kõik need mikroorganismid võivad aga esineda terve inimese nahal ja limaskestadel ega kutsu esile haiguse arengut. Seetõttu nimetatakse neid tavaliselt tinglikult patogeenseks mikroflooraks. See tähendab, et normaalse immuunsuse ja seisundiga nahka mikroobid ei käitu patogeensetena, vaid suudavad teiste mikroorganismidega läbi saada ega mõjuta. Näiteks ohtlikku Staphylococcus aureust leidub igal neljandal planeedi elanikul. Ja streptokokk võib isegi pärssida patogeensete bakterite, nagu salmonella, paljunemist.
Üldiselt on nahal ja limaskestadel elav mikrofloora alati tinglikult patogeenne - mikroorganismide hulgas on erinevate bakterite kolooniaid. Kui tasakaal on häiritud, võivad need põhjustada infektsioone – see võimaldab mikroobidel kontrollimatult paljuneda.
Triklosaan (ja selle analoogid) on laia toimespektriga antibakteriaalne aine, mis tähendab, et see ei toimi selektiivselt. Nahale kandmisel kannatavad kõik mikrofloora esindajad, häirides sellega tõsiselt väljakujunenud tasakaalu. See omakorda loob soodsad tingimused infektsioonide tekkeks. Seetõttu võivad antibakteriaalse toimega hügieenitooted sagedase kasutamise korral põhjustada tõsist tervisekahjustust.
Patogeensed mikroorganismid on võimelised välja töötama uusi kaitsemehhanisme, sealhulgas kasutatavate ravimite vastu. Seda nimetatakse resistentsuseks – resistentsus toimeaine suhtes. Eriti eredalt näitab seda võimet üks ohtlikumaid mikroobe Staphylococcus aureus. Algselt hävitas see penitsilliiniga kergesti, kuid tänapäeval on palju bakteritüvesid, mis on evolutsiooni käigus õppinud tootma spetsiaalset ensüümi penitsillinaasi, mis antibiootikumi lihtsalt lagundab.
Igal aastal avastatakse üha rohkem baktereid, mis on resistentsed olemasolevatele ravimitele. Arstid seostavad seda suundumust erinevat tüüpi antibakteriaalsete ainete kontrollimatu kasutamisega. Pidevalt bakterikolooniaid mõjutades kiirendab inimene seeläbi nende looduslikku valikut – resistentsed tüved jäävad ellu ja paljunevad veelgi.

Lisaks triklosaani kui ühe laia toimespektriga antibiootikumi üldisele kahjule on tänaseks tõestatud ka toimeaine enda kahju. Viimased meditsiiniuudised: triklosaan tuleks vedelate ja tahkete seepide koostisest välja jätta. Selle otsuse tegi FDA (USA toidu- ja ravimiamet). Minnesota osariigis eemaldati triklosaan igat tüüpi tarbekaupade nimekirjast. Seadus hakkab kehtima 1. jaanuaril 2017.
Sellised meetmed võetakse toimeaine mitmete uuringute tulemuste põhjal, mille käigus tehti järgmised järeldused:
- Triklosaan võib põhjustada maksavähki. See on tingitud asjaolust, et see pärsib androstaani retseptorit, mis on seotud toksiinide eemaldamisega kehast. Selle tulemusena degenereeruvad kuded kiuliseks, mis provotseerib onkoloogiat.
- Triklosaan võib põhjustada viljatust, kahjustada raseduse kulgu ja loote arengut. Triklosaan võib koguneda ja seda on leitud isegi nabaväädiveres.
- Antibakteriaalsete toodete efektiivsus kätele ja kehale pikaajalisel kasutamisel ei ole tõestatud. Bakterid hävivad osaliselt ja keskkonna mõjul taastub nende arv kiiresti.

Ja veel, mõnel juhul on antibakteriaalsete hügieenitoodete kasutamine õigustatud.
- Antibakteriaalne toime tuleb kasuks erinevate kätepuhastusspreide ja niiskete salvrätikute kasutamisel, kui neid kasutatakse matkadel, matkadel jm. See on ajutine kasutamine keskkonnas, kus on kõrge bakteriaalsete infektsioonide oht ja piiratud isiklik hügieen.
- Triklosaan on osutunud efektiivseks hambapastades. Aine vähendab tõesti riski haigestuda igemepõletikku ja teistesse suuõõne põletikesse, samuti vähendab hambakivi teket.
Ei ole vaja täielikult loobuda antibakteriaalsetest hügieenitoodetest. Siiski ei soovitata neid endiselt kasutada igapäevaselt ja ilma oluliste näidustusteta. Nagu iga toimeaine puhul, tuleb ka antibakteriaalseid aineid kasutada ainult siis, kui see on hädavajalik.
Antibakteriaalsed hügieenitooted ilma triklosaanita
Toodetud üle 100 aasta. Toimeaineteks on maitsetaimed – eukalüpt, mentool jt. Kaitseb hambakatu eest ja on igemepõletiku ennetaja. Alla 12-aastastel lastel ei ole soovitatav kasutada.

Kompositsioon sisaldab kloorheksidiini, mis toimib õrnemalt kui triklosaan. Võitleb tõhusalt erinevate põletikuliste protsesside vastu, võib leevendada igemepõletiku seisundit ja olla kasutatav ennetava meetmena. Sel juhul tuleks pasta kasutada kursustel - mitte kauem kui 30-60 päeva.

Uudsus, mis sisaldab nahale ohutuid aineid. Tootjad garanteerivad kaitset bakterite ja nende põhjustatud ebameeldiva lõhna eest 48 tundi. Antiseptilised omadused tagavad bensüülbensoaat (kasutatakse meditsiinis sügeliste eest kaitsmiseks) ja bensüülsalitsülaat. Saadaval sprei ja rull-antiperspirandina.

Looduslik koostis - rohelise tee ja viinamarjade ekstrakt. Tänu 70% alkoholile, mis on selle koostises, on see antiseptik. Sobib reisimiseks ja õues kasutamiseks - annab värskustunde, kuivab kiiresti. Võib kasutada lastele.

Vahendid on saadaval geelide ja tahkete seepide kujul. Kompositsioon sisaldab ka pehmendavaid ja niisutavaid komponente ning antibakteriaalse toime tagab bensalkooniumkloriid. Ei ole lastele keelatud. Kuid siiski soovitatakse seda seepi kasutada vaheldumisi teiste tüüpidega.
AT ravipraktika Nakkushaiged kasutavad tohutul hulgal etiotroopseid aineid. See on tingitud asjaolust, et tekivad kõrge patogeensusega patogeenide tüved ja nende ravimiresistentsus antibakteriaalsete ravimite suhtes, samuti muutused makroorganismi resistentsuses ja sekundaarne immuunpuudulikkus. Ravimite õigeks kasutamiseks ja soovitud tulemuste saavutamiseks peavad olema teadmised ravimite omadustest, järgima kodumaise nakkushaiguste ravi teaduse aluspõhimõtteid. Ilma selleta on arstil raske orienteeruda paljudes antibakteriaalsetes ainetes ja nende kasutusviisides. Nakkushaigustega patsientide ravi peamised sätted kliiniku seisukohast sõnastas A.F. Bilibin (1958). Suurimat tähelepanu ei pööratud mitte ainult antibiootikumi valikule, selle manustamisviisile, vaid, mis on eriti oluline, ka nakkusprotsessile, mis on allutatud kolmele tegurile: "tekitaja, makroorganism ja keskkond".
Praegu võimaldavad edusammud mikrobioloogias ja saavutused farmakokineetikas valida antibiootikume, millel on väljendunud antimikroobne toime ja “kitsas” fookus, mis vähendab düsbakterioosi riski.
Selles jaotises on esitatud üld- ja erisätted antimikroobsete ainete kasutamise kohta. Erinevalt juba avaldatud teabest [Yu. V. Lobzin et al., 1998], see töö tutvustab lisaks antibakteriaalsete ravimite ja teiste ravimite koostoime ebasoovitavaid mõjusid, samuti nakkuspatsientide antibakteriaalse ravi kliinilisi aspekte.
Praegu on lisaks keemiaravi ravimite efektiivsuse andmetele teatud tähtsust nende kallinemine, mis võib sageli mõjutada antibiootikumi valikut.
Juhendis sätestatud antibakteriaalsete ainete kasutamise põhinõuete täitmine on mõeldud nakkushaigete edukale ravile kaasaaitamiseks.
Antibakteriaalsed ained mõjutavad oluliselt enamiku nakkushaiguste kulgu ja tulemusi. Seetõttu peaks nakkushaigete kompleksne ravi olema suunatud eelkõige haiguse põhjustajale. Ravimite eesmärk on põhjendatud haiguse etioloogia, patogeneesiga, võttes arvesse organismi füsioloogilisi omadusi, haiguse tõsidust ja perioodi.
Sest mõju patogeenile keemiaravi ja antibiootikumravi. Keemiaravi tähendab antimikroobset, parasiitidevastast ravi kemikaalide abil. See termin võeti kasutusele selleks, et põhimõtteliselt eristada antimikroobset ravi farmakoteraapiast üldiselt. Antibiootikumravi olemus on ravi mikroorganismide poolt toodetud loodusliku päritoluga ravimitega; selle ravi eesmärk on pärssida nakkushaiguste korral haigusi põhjustavate mikroobide kasvu või hävitamist. Paljud kaasaegsed antibiootikumid on poolsünteetilised, s.t. loodud algse molekuli muutmise teel.
Esimene antimikroobsetest ainetest kliiniline praktika kasutati sulfaniilamiidi (1936). Veidi hiljem, 1941. aastal, omandas A. Fleming Oxfordi ülikoolis penitsilliini ja kasutas seda esimest korda edukalt. Tänapäeval mõõdetakse looduslike, poolsünteetiliste ja sünteetiliste antibakteriaalsete ravimite arvu tuhandetes. Praktikas saab aga kasutada vaid kümneid antibiootikume, mis on vähetoksilised ja millel on samal ajal väljendunud antibakteriaalne toime. Suur hulk antibiootikume patogeensete ja oportunistlike bakterite mitmekesisuse tõttu.
Antibiootikumide klassifikatsioon.
Antibiootikumide kaasaegne klassifikatsioon töötati välja Riiklikus Antibiootikumikeskuses [S. M. Navashin, 1994], mille kohaselt neid iseloomustab toimemehhanism, keemiline struktuur, antimikroobne spekter, toime tüüp rakule.
Sõltuvalt toimemehhanismist jagatakse antibiootikumid kolme põhirühma:
» mikroorganismide rakuseina sünteesi inhibiitorid (penitsilliinid, tsefalosporiinid, vankomütsiin, teikoplaniin jt);
» antibiootikumid, mis rikuvad molekulaarkorraldust, rakumembraanide funktsioone (polümüksiin, nüstatiin, levoriin, amfoteritsiin jne);
"valkude ja nukleiinhapete sünteesi inhibeerivad antibiootikumid, eelkõige valgusünteesi inhibiitorid ribosoomide tasemel (klooramfenikool, tetratsükliinid, makroliidid, linkomütsiin, aminoglükosiidid) ja RNA polümeraasi inhibiitorid (rifampitsiin) jne. Keemilise struktuuri järgi eristatakse järgmisi antibiootikumide rühmi : beetalaktaamid (penitsilliinid, tsefalosporiinid jne), aminoglükosiidid, klooramfenikool, tetratsükliinid, fusidiin, ansamakroliidid (rifampitsiinid), polümüksiinid, polüeenid, makroliidid jne.
Sõltuvalt mikroobirakkudele avalduva toime tüübist jagatakse antibiootikumid kahte rühma:
» bakteritsiidsed (penitsilliinid, tsefalosporiinid, aminoglükosiidid,
rifampitsiin, polümüksiinid jne);
» bakteriostaatilised (makroliidid, tetratsükliinid, linkomütsiin,
klooramfenikool jne).
Nakkuskliiniku jaoks on eriti oluline teada antibiootikumide antimikroobse toime spektrit, kuna seda võetakse antibiootikumi valikul arvesse.
Antimikroobse toime spektri järgi jagatakse antibiootikumid järgmistesse rühmadesse.
1. Grampositiivsetele bakteritele ja kokkidele mõjuvad ravimid: biosünteetilised penitsilliinid, isoksasolpenitsilliinid (oksatsilliin), linkosamiidid, vankomütsiin, fusidiin.
2. Gramnegatiivsete bakterite vastu aktiivsed antibiootikumid: astreonaam, polümüksiinid.
3. Laia toimespektriga antibiootikumid, mis toimivad grampositiivsete ja gramnegatiivsete bakterite vastu: aminopenitsilliinid (ampitsilliin), karbenitsilliin, ureidopenitsilliinid (piperatsilliin), tsefalosporiinid, aminoglükosiidid, levomütsetiin, tetratsükliinid, makroliidid, rifamütsiinid, karbapenitsilliinid, penemütsiinid.
4. TB-vastased antibiootikumid (streptomütsiin, rifampitsiin, florimütsiin).
5. Seenevastased antibiootikumid (nüstatiin, levoriin, griseofulviin, amfoteritsiin B, ketokonasool, ankotüül, diflukaan jne).
Ülaltoodud omadused määravad põhimõtteliselt antibiootikumi valiku nakkushaige raviks. See võtab tingimata arvesse ravimi farmakodünaamikat ja farmakokineetikat, patsiendi individuaalseid omadusi (vanus, immuunstatus, kaasuvad haigused jne).
Tõhusus antibiootikumidega ravi nende õigeaegse määramisega määravad suuresti järgmised tegurid:
» haiguse etioloogiline diagnoos, nakkushaiguse nosoloogiliste vormide kliiniline diagnoosimine, haigusetekitaja isoleerimine, millele järgneb tema tundlikkuse määramine antibiootikumide suhtes;
» kõige aktiivsemate ja samal ajal kõige vähem mürgiste toodete valik
konkreetse patsiendi ravimi jaoks;
» antibiootikumi optimaalse annuse määramine, selle manustamisviis, et tekitada infektsioonikoldes kontsentratsioon, mis on 2-3 korda kõrgem selle mikroobi minimaalsest inhibeerivast kontsentratsioonist (MIC);
» antibiootikumi võimalike kõrvaltoimete tundmine ja arvestamine; » ravimite kombinatsiooni kasutamine vastavalt näidustustele nende toimespektri laiendamiseks ja/või antimikroobse toime tugevdamiseks.
Antibiootikumide farmakokineetika ja farmakodünaamika.Farmakokineetika- farmakoloogia osa, mis uurib ravimite sisenemise, jaotumise ja metabolismi teid organismis, samuti nende väljutamist.
Farmakodünaamika- farmakoloogia osa, mis uurib elundite, kudede või keha kui terviku reaktsiooni ja selle reaktsiooni ulatust vastusena manustatud ravimile, samuti antibiootikumide toime omadusi seoses patogeenidega.
Antibiootikumi kliinilise efektiivsuse määrab suuresti selle jaotumine elundites ja kudedes, võime tungida läbi keha füsioloogiliste ja patoloogiliste barjääride. See võib muutuda hepatotsellulaarse puudulikkusega, neerude eritusfunktsiooni rikkumisega jne. Antibiootikumide saatuse organismis määrab nende ainevahetus ja valkudega seondumise määr. Hea ravitoime eelduseks on ka piisav imenduvus. Lisaks sellele läbivad antibiootikumid kehas ensümaatilise toime (ainevahetus), mille tulemusena moodustuvad mitteaktiivsed ja mõnikord mürgised tooted.
Organismi sisestatud antibiootikumi koostoime protsess "sihtmärkidega" jaguneb kolmeks peamiseks kronoloogiliseks faasiks: farmakotseutiline, farmakokineetiline ja farmakodünaamiline.
Lagunemine toimub farmakotseutilises faasis annustamisvorm lahustumise tõttu vabaneb toimeaine ja toimeaine, mis muutub imendumiseks kättesaadavaks. Antibiootikumide ja keemiaravi ravimite koostoime tulemusena toidu koostisosade ja seedemahladega võivad mõned ravimid läbida mitmesuguseid modifikatsioone, sealhulgas inaktiveerida. Toidukomponentide seondumine ravimitega toimub peamiselt seedetraktis, kus tekivad lahustumatud või halvasti lahustuvad ühendid, mis imenduvad halvasti verre. Tetratsükliini seeria antibiootikumid seonduvad kaltsiumiga (sealhulgas piima, kodujuustu ja muude piimatoodete kaltsiumiga), sulfoonamiidid - toiduvalkudega. Sulfadimetoksiini, sulfametoksüpüridasiini ja teiste sulfoonamiidide imendumine aeglustub oluliselt esimese 3 tunni jooksul pärast sööki. Kuid 6, 8 ja 27 tunni pärast muutub sulfoonamiidide kontsentratsioon veres samaks kõigil, kes võtsid neid ravimeid nii tühja kõhuga kui ka vahetult pärast sööki. Toidu mõjul väheneb kvantitatiivselt tetratsükliinide, penitsilliini, erütromütsiini, rifampitsiini, klooramfenikooli ja teiste ravimite imendumine. Rauasoolade rikkad toidud, aga ka anorgaanilised rauapreparaadid koos tetratsükliinravimitega põhjustavad nende antibiootikumide imendumise pärssimist, mille tulemusel väheneb nende kontsentratsioon veres 50% või rohkem. Sellest järeldub, et tetratsükliinravi ajal tuleb hoiduda rauapreparaatide ja rauasoolade rikka toidu võtmisest. Furadoniin, mida manustatakse koos rasvase toiduga, viibib kauem maos, kus see lahustub ja laguneb, mis viib selle kontsentratsiooni vähenemiseni soolestikus ja selle tulemusena terapeutilise aktiivsuse vähenemiseni. Samal ajal ei mõjuta toidu tarbimine tsefaleksiini, levomütsetiini ja teiste antibiootikumide imendumist.
Erinevates teatmeteostes pakutud soovitused antibiootikumide ja keemiaravi ravimite võtmise aja kohta ei saa olla üheselt mõistetavad, vaid neid tuleks kasutada, võttes arvesse paljusid punkte ja eelkõige patsiendi individuaalseid iseärasusi, haiguse olemust, funktsionaalset seisundit. seedesüsteemi, ravimvormi ja ravimi füüsikalis-keemiliste omaduste kohta.
Farmakokineetilises faasis toimub ravimi imendumine, jaotumine, metabolism ja eritumine. Selles faasis on antibiootikumil patogeenile bioloogiline toime. Faas kestab hetkest, mil ravim ilmub verre, kuni see sealt kaob.
Antibiootikumi intravaskulaarsel manustamisel tekib otsene kontakt veres ringleva patogeeniga, kiirem tungimine infektsioonikoldesse. Kui antibiootikumi manustatakse subkutaanselt või intramuskulaarselt, on imendumise kiirus otseselt võrdeline selle lahustuvusega vees ja lipiidides. Antibiootikumide parenteraalsel manustamisel sõltub nende biosaadavus suuresti ka barjääride, nagu näiteks hematoentsefaalbarjääri, ületamise kiirusest. Penitsilliini, tetratsükliini, tsefalosporiinide hematoentsefaalbarjääri läbilaskvus on piiratud. Antibiootikumide kontsentratsioon võib väheneda infektsioonikolletes (sinusiit, abstsessid jne), kuna väheneb nende tungimine läbi põletikuliste bioloogiliste barjääride [Yu. P. Finogeev et al., 1976]. Sellega seoses võib olla tõhusam manustada kemoterapeutilisi aineid ja antibiootikume otse nakkuskohta, näiteks hingamisteede haiguste aerosoolide kujul [Yu. P. Finogeev, 1980], lahustes - amööbse maksa abstsesside õõnsusse [V. M. Volžanin, 1992].
Farmakodünaamilises faasis toimub teatud bioloogilise aktiivsuse saavutamisel antibiootikumi (kemoterapeutilise aine) koostoime mikroorganismiga. 3. faasi kestus on mitmest tunnist mitme päevani (individuaalsed antibiootikumid ja pikatoimelised sulfoonamiidid).
Ravimite (antibiootikumide) tugevuse määravad järgmised tegurid:
» ravimvorm, mis tagab ravimaine sobiva farmatseutilise kättesaadavuse;
» antibiootikumi kogus; selle terviklikkus kudedes, elundis (nakkuse fookuses), mis on tingitud selle ainevahetuse ja eliminatsiooni kiirusest.
Ajavahemikud ravimite võtmise vahel, ravi kestus sõltuvad ka ravimite farmakokineetikast ja farmakodünaamikast. Alati tuleb meeles pidada, et kõik kemoterapeutilised ained ja antibiootikumid on organismile võõrad, seetõttu nimetatakse neid mõnikord ka ksenobiootikumideks ning et kemoterapeutilised ained ei ole alati makroorganismi suhtes ükskõiksed.
Antibiootikumi valik bakteriaalsete infektsioonidega patsientide ravis. Nakkushaige antibiootikumravi peamiseks näidustuseks on sellise bakteriaalse patogeeni olemasolu organismis, millega organism ise ei suuda toime tulla või mille puhul on võimalikud olulised tüsistused. Samal ajal on antibakteriaalse aine valikul peamine ja määrav tegur patogeen ja selle tundlikkus valitud ravimi suhtes [V. G. Bochorišvili, 1988].
Enamikul juhtudel viiakse esialgne antibiootikumravi läbi empiiriliselt. Enne antibakteriaalse ravimi väljakirjutamist on aga kohustuslik valida materjal (veri, tserebrospinaalvedelik, mandlite lima jne) bakterioloogiliseks uuringuks, s.o. haiguse põhjustaja eraldamine ja selle tundlikkuse määramine antibiootikumide suhtes. Haiguse kliinilise diagnoosi kindlaksmääramisel saate valida selle nakkuse jaoks kõige tõhusama ravimi (tüüfus, pseudotuberkuloos, erüsiipel, difteeria, leptospiroos jne). Meningiit, kopsupõletik, sepsis, haiglanakkused ja mõned muud patoloogilised seisundid võivad olla põhjustatud erinevatest patogeenidest, nii et pärast vastuvõttu empiiriline teraapia patogeeni täpseks tuvastamiseks ja seeläbi antibakteriaalse ravi sihipäraseks muutmiseks, võttes arvesse isoleeritud mikroorganismi tundlikkust, eelistades kitsa spektriga ravimeid, on vaja hoolikalt kontrollida protsessi dünaamikat ja teha korduvaid bakterioloogilisi uuringuid. tegevusest.
Raske seisundiga patsientidele määratakse viivitamatult antibiootikumravi, määramata etioloogiaga, kasutatakse laia toimespektriga ravimeid, mõnel juhul kasutatakse ravimite kombinatsiooni. Immuunpuudulikkusega patsientidele on eelistatav välja kirjutada bakteritsiidsed ravimid: beetalaktaamid, aminoglükosiidid, vankomütsiin, fosfomütsiin, fluorokinoloonid jne.
Soovitused optimaalseks antibiootikumide valikuks olenevalt nakkushaiguse etioloogiast on toodud tabelis. 3, 4 ja 5.
Antibakteriaalsed ained grampositiivsete ja gramnegatiivsete kokkide põhjustatud nakkushaiguste raviks
Tabel 3
Tabel 4


Arst peab alati korreleerima laboratoorseid andmeid haiguse kliinilise kulgemisega dünaamikas, samuti võtma arvesse patogeeni võimalikku muutumist ja eriti selle tundlikkuse muutust antibiootikumi suhtes (kopsupõletik, sepsis jne).
Tuleb märkida, et patogeenide tundlikkus antibiootikumide suhtes võib erinevates piirkondades olla väga erinev, olenevalt teatud pikka aega kasutatud antibiootikumidest, makroorganismi seisundist ja muudest teguritest. Elundite ja kudede või organismi kui terviku reaktsioon manustatud ravimile ei sõltu ainult toimeaine keemilistest omadustest, vaid ka selle koostoimest teatud reageerivate organitega.
Sageli kasutavad nakkushaiguste spetsialistid kliinilises praktikas kombineeritud antibiootikumravi. Selle rakendamise peamised näpunäited on järgmised:
» segainfektsioonid;
» vajadus vältida mikroorganismide antibiootikumiresistentsuse teket;
» antibakteriaalse toime tugevdamise otstarbekus;
» Patogeenide ebapiisav tundlikkus monoantibiootikumide suhtes.
Antibiootikumide koostoimeks nende kombineeritud kasutamisega on võimalikud järgmised võimalused:
» ükskõikne toime - ei täheldata muutusi ühegi antimikroobse aine (levomütsitiin + erütromütsiin) toimes;
» aditiivne toime (summeerimine) - kasutatavate ravimite antibakteriaalne toime võrdub igaühe toime summaga eraldi, üksteisest sõltumatult (ampitsilliin + oksatsilliin);
» sünergistlik toime – kahe antibiootikumi kombineeritud kasutamise mõju ületab iga ravimi eraldiseisva toime lihtsa liitmise (betalaktaamid + aminoglükosiidid);
» Antagonistlik toime - mitme ravimi kombineerimisel saavutatav toime on väiksem kui igaühe toime eraldi (betalaktaamid + tetratsükliinid).
Antagonistlik interaktsioon antibiootikumid on seletatavad nende toimemehhanismiga mikroobirakkudele. Beetalaktaamid, vankomütsiin ja fosfomütsiin toimivad mikroorganismidele ainult mitoosi ajal ja seetõttu võib mikroobirakkude jagunemist häirivate bakteriostaatikumide samaaegne manustamine jätta bakteritsiidsed antibiootikumid ilma substraadist, millele nad toimivad. Optimaalne on kahe bakteritsiidse antibakteriaalse aine kombinatsioon.
Erinevate bakteritsiidse tüüpi antibiootikumide kombinatsiooniga antagonismi juhtumeid reeglina ei täheldata. Bakteriostaatiliste ja bakteritsiidsete ravimite kombinatsioon põhjustab mõnikord nende antagonismi.
Teatavasti muutusid antibiootikumide mõjul mikrofloora omadused, muutusid vaated resistentsuse mehhanismidele, tekkis mitmekordne resistentsus. See raskendas otsust kasutada erinevate antibiootikumide kombinatsiooni. Kuid praktikas ei tohiks arst teatmeteostes ja käsiraamatutes soovitatud kombinatsioonidest täielikult loobuda. Samal ajal on vajalik nakkusetekitajate omaduste põhjalik kaalumine. Siiski tuleb siiski meeles pidada, et prioriteet on monoantibiootikumravi, mille puhul eelistatakse välja kirjutada kitsama toimespektriga ravimeid, eriti pikaajalise ravi korral. Antibiootikumide kombinatsiooni määramisel on soovitatav kasutada nende sobivuse tabeleid. Teatud tingimustel aitavad need vältida ebasoodsaid (tõhususe langus jne) tagajärgi.
Antibiootikumide koostoime teiste ravimitega. Antibakteriaalsete ainete valikut mõjutavad nende farmakokineetika ja farmakodünaamika iseärasused: tungimine läbi hematoentsefaalbarjääri, aktiivsuse muutused sõltuvalt pH-st.
Patogeeni intratsellulaarse lokaliseerimisega bakteriaalsete infektsioonide ravis tuleb arvestada antibakteriaalsete ravimite erinevat rakku tungimise astmega. Aminoglükosiidid tungivad rakku väikestes kogustes ja neil on madal antibakteriaalne toime. Makroliidid ja fluorokinoloonid tungivad hästi rakkude tsütoplasmasse ja vakuoolidesse ning avaldavad antibakteriaalset toimet rakusiseste bakterite suhtes. Beetalaktaamid tungivad ainult rakkude tsütoplasmasse ja neil on väheste eranditega madal intratsellulaarne aktiivsus.
Kesknärvisüsteemi infektsioonide korral on oluline, et antibakteriaalne ravim tungiks läbi hematoentsefaalbarjääri, mille kaudu tungivad hästi levomütsetiin, sulfoonamiidid, kotrimoksasool, nitroimidasoolid ja flukonasool. Tungivad ainult põletikuga - bensüülpenitsilliin, ampitsilliin, oksatsilliin, piperatsilliin, tsefuroksiim, tseftriaksoon, tsefotaksiim, tseftasidiim, tsefpiroom, meropeneem, astreonaam, amikatsiin, kanamütsiin, vankomütsiin, doksütsükliin, pefloksatsiin, pefloksatsiin.
Raskete patsientide ravimisel tuleb meeles pidada, et aminoglükosiidide aktiivsus atsidoosi ja hüpoksia korral väheneb.
Ravimi manustamisviisi määrab selle biosaadavus, mis viitab ravimi osale, mis pärast allaneelamist siseneb aktiivsel kujul süsteemsesse vereringesse.
antibakteriaalsed ravimid, mille biosaadavus on üle 60%: levomütsetiin, doksütsükliin, flukloksatsilliin, aminopenitsilliinid (v.a ampitsilliin), tsefalosporiinide enteraalsed vormid, fusidiin, fosfomütsiin, rifamütsiinid, kui võimalik, betrodasoolid, fluorokinoloonid, koo-niasoliid, va norfloksatsiin (v.a. , seega kui kõrge biosaadavus tagab ravimi enteraalse ja parenteraalse manustamise annuste sarnasuse koos minimaalse kõrvalnähtude riskiga, lihtsuse ja kuluefektiivsuse.
Antibakteriaalsed ravimid, mille biosaadavus on 30–60%, on efektiivsemad parenteraalsel manustamisel (oksatsilliin, kloksatsilliin, ampitsilliin, linkosamiidid) ja suukaudselt, kui patogeen on nende suhtes väga tundlik (tetratsükliin, metatsükliin, makroliidid, fenoksümetüülpenitsilliin, norfloksatsiin). .
Antibakteriaalsed ravimid koos biosaadavus alla 30% - aminoglükosiide, ureidopenitsilliine, tsefalosporiinide süstitavaid vorme, karbapeneeme, astreonaami, vankomütsiini kasutatakse parenteraalselt. Suukaudsel manustamisel on neil ainult kohalik toime [I. B. Mihhailov, 1998].
Režiim doseerimine antibiootikumid (aminoglükosiidid), mille aktiivsus sõltub peamiselt nende kontsentratsioonist (kontsentratsioonist sõltuvad tapvad ravimid), on tekitada veres ravimi kontsentratsioonis võimalikud suuremad, toksilisele lähedased piigid [C. N. Nightingall, 1998]. Kogu üksainus haldus päevane annus aminoglükosiidid, tavaliselt intravenoosse tilgutiga. Samal ajal tagab antibiootikumi kõrge tippkontsentratsioon bakterite maksimaalse hävimise, madalama toksilisuse, on mugavam nii patsiendile, meditsiinipersonalile kui ka säästlikum [L. S. Stragunsky, S. N. Kozlov, 1998].
Beetalaktaamide, makroliidide ja linkosamiidide rühma kuuluvate antibiootikumide kasutamisel, mille aktiivsus sõltub peamiselt kontsentratsiooni kestusest (ajast sõltuvad surmavad ravimid), on vaja pidevalt hoida nende ravimite kontsentratsiooni veres üle taseme. MIC-st nende süstide vahel. Nende antibiootikumide manustamise sagedus sõltub reeglina poolestusajast (Ti / 2), mis määrab suuresti aja, mis kulub ravimi vajaliku kontsentratsiooni säilitamiseks veres pärast ühekordset süstimist. Ravimi konstantse säilitusannuse sisseviimisel sama manustamisintervalliga luuakse keskmiselt pärast 4-5 Ti / 2 selle tasakaalukontsentratsiooni vereplasmas. Seega on Ti / 2 bensüülpenitsilliini 1 tund, seega tuleb seda manustada iga 4 tunni järel. Bakteritsiidsete antibakteriaalsete ravimite kasutamise terapeutiline toime ilmneb 1-2 päeva pärast, bakteriostaatiline - 3-4 päeva pärast. Selle aja möödudes hinnatakse antibakteriaalse aine kliinilist toimet.
Antibiootikumravi kestus sõltub nosoloogilise vormi kliinilisest kulgemisest. Tsükliliste, kuid korduvate infektsioonide (tüüfus) korral võib antibakteriaalse ravimi kasutamise katkestada 1-2 päeva pärast kliinilise toime saavutamist. Tsükliliste, kuid korduvate haiguste korral (tüüfus, pseudotuberkuloos) jätkatakse antibiootikumravi nii kaua, kuni haigus oleks kestnud ilma etiotroopne ravi. Atsükliliste infektsioonide, sealhulgas sepsise, ja enamiku oportunistlikust taimestikust põhjustatud haiguste korral määratakse antibakteriaalsed ravimid empiiriliselt kindlaks määratud optimaalsetel aegadel, võttes arvesse kliinilist taastumist.
Antibakteriaalsete ravimitega ravimisel tuleb silmas pidada mikroorganismide sekundaarset resistentsust. Beeta-laktaamide, tetratsükliinide, linkosamiidide, klooramfenikooli, vankomütsiini, fosfomütsiini, fluorokinoloonide, nitrofuraanide, nitroimidasoolide suhtes tekib sekundaarne resistentsus aeglaselt ("penitsilliini" tüüpi resistentsus). Aminoglükosiidide, makroliidide, rifamütsiinide, fusidiini, 8-hüdroksükinoliini derivaatide ja I-II põlvkonna kinoloonide suhtes tekib kiiresti sekundaarne resistentsus ("streptomütsiini" tüüpi resistentsus). Seetõttu tuleks neid ravimeid välja kirjutada mitte kauemaks kui 5-7 päevaks või kombineerida teiste antibakteriaalsete ravimitega [I. B. Mihhailov, 1998].
Antibiootikumide koostoimel teiste ravimitega võib samaaegsel kasutamisel olla nii positiivne kui ka negatiivne tulemus.
Niisiis on meningokoki meningiidi raviks valitud ravim, nagu teate, bensüülpenitsilliin. Penitsilliini nõutav terapeutiline kontsentratsioon kesknärvisüsteemis tagatakse tavaliselt selle kasutamisega megadoosides (200 000-500 000 RÜ 1 kg kehakaalu kohta päevas). Samal ajal sõltub antibiootikumi optimaalne ööpäevane annus selle kombinatsioonist erinevate patogeneetiliste ainetega, mis võivad vähendada penitsilliini kontsentratsiooni tserebrospinaalvedelikus (antagonistlik farmakokineetiline toime) või suurendada seda (sünergistlik farmakokineetiline toime). Näiteks penitsilliini kombinatsioon sünergistlike ravimite kompleksiga (kofeiin aminofülliiniga või baralgiin koos furosemiidi ja isotooniliste lahustega) võimaldab teil saavutada meningokoki meningiidiga patsientidel optimaalse ravitoime, vähendades penitsilliini ööpäevast annust 2 korda. suurendades selle läbilaskvust läbi hematoentsefaalbarjääri [K. S. Ivanov, 1982]. Samal ajal täheldatakse meningiidi ravis penitsilliiniga antagonistlikku toimet osmootsete diureetikumide (mannitool, uurea), hüpertooniliste lahuste ja glükokortikosteroidide kasutamisel. Selle põhjuseks on penitsilliini suurenenud eritumine uriiniga, hematoentsefaalbarjääri läbilaskvuse vähenemine hormoonravi ajal selle põletikuvastase toime tõttu. Teatud antibiootikumide (kanamütsiini) koosmanustamine glükokortikosteroididega (hüdrokortisoon) viib aga nende kõrge kontsentratsiooni pikema säilimiseni veres [K. S. Ivanov et al., 1976].
Kell kompleksse etiopatogeneetilise ravi planeerimine on vaja arvestada antibiootikumide, patogeneetiliste ainete ja alkoholi võimalike kõrvalmõjude (soovitavate) vastastikuse tugevnemisega. Andmed ravimite kokkusobimatuse kohta antibiootikumidega on toodud tabelis. 6, 7. Nende ravimite kombinatsioone ei soovitata praktiliseks kasutamiseks, kuna need on patsientidele enam-vähem ebasoodsad. Inimesed, kellel on suurenenud risk antibiootikumide kombinatsioonide kõrvaltoimete tekkeks, on eakad, samuti neeru- ja maksapuudulikkuse all kannatavad inimesed. Need nakkushaigustega patsiendid saavad reeglina samaaegse patoloogia ravi, kui on eriti vaja arvestada antibiootikumide, keemiaravi ravimite koostoime võimalusega teiste ravimitega. Raviainete rühma, mille kombinatsioone antibiootikumidega tuleb hoolikalt kontrollida, kuuluvad antikoagulandid, diabeedivastased ained, metallisoolad, diureetikumid, mittesteroidsed põletikuvastased ravimid ja muud ravimid.
Antibiootikumravi efektiivsuse hindamine. Arsti praktikas tekib sageli olukord, kus enne haiguse lõpliku diagnoosi kindlaksmääramist, selle etioloogia selgitamist (haiguse tekitaja eraldamine ja tundlikkuse määramine antibiootikumide ja keemiaravi ravimite suhtes) on vaja määrata antibiootikumravi. Sellistel juhtudel kasutatakse antimikroobse ravi alustamise põhimõtet.
Kõrvaltoimed antibiootikumide koostoimel erinevate ravimitega (V. E. Novikovi järgi, 1994)


Tõhususe peamine kriteerium Antibakteriaalne ravi on kõige sagedamini mürgistusastme vähenemine koos kehatemperatuuri langusega. Koos nakkusprotsessi dünaamika kliinilise kontrolliga kasutatakse bakterioloogilisi meetodeid - patogeeni eraldamist, selle tundlikkuse kvantitatiivset ja kvalitatiivset määramist antibiootikumide suhtes, farmakodünaamiliste ja farmakokineetiliste näitajate võrdlemist.
Bakteriaalsete infektsioonide sihipärases ravis on ideaalne kasutada haiguse bakterioloogilise diagnoosimise meetodeid ja teadmisi antibiogrammi kohta. Ainult nii on võimalik teha õige valik toimespektri poolest paljude sarnaste seast kõige tõhusam ravim. See on eriti oluline seoses antibiootikumiresistentsete mikroorganismitüvede laialdase levikuga.
Mikroorganismide tundlikkus antibiootikumide suhtes. Alates antibiootikumide avastamisest on mõned nakkushaiguste patogeenid nende ravimite esialgse tundlikkuse olemust vähe muutnud (A-rühma streptokokid, pneumokokid, meningokokid, brutsella, mõned salmonellad).
Samal ajal omandas enamik patogeenseid mikroobe lõpuks resistentsuse laialdaselt, mõnikord kontrollimatult ja põhjendamatult kasutatud antimikroobsete ainete suhtes. Mikroobide resistentsuse probleem on kõige olulisem stafülokokkide, shigella, Escherichia, Proteuse puhul, mille hulgast eraldatakse kõige sagedamini antibiootikumiresistentseid tüvesid.
Peamiste antibiootikumide suhtes tundlikkuse astme järgi jaotatakse mikroobid tundlikeks, mõõdukalt tundlikeks ja resistentseteks. Tundlike rühma kuulub enamik mikroorganismide tüvesid, mille kasv toitainekeskkonnas peatub, kui kasutatakse antibiootikumide keskmistele terapeutilistele annustele vastavaid kontsentratsioone. Kui see on alla surutud ainult ravimite maksimaalsete annuste kasutamisel, on sellised mikroorganismid antibiootikumi suhtes mõõdukalt tundlikud. Kui laboratoorses katses saavutatakse kasvu pärssimine ainult ravimi väga kõrgete kontsentratsioonide juures, mida ei saa organismis tekitada, siis liigitatakse sellised nakkusetekitajad antibiootikumi suhtes resistentseteks.
Mikroobide tundlikkuse määramiseks antibiootikumide suhtes On mitmeid meetodeid: seerialahjendusmeetod vedelas toitainekeskkonnas või toiteagaris, difusioonimeetod agaris, antibiootikumidega küllastatud ketaste meetod ja kiirendatud meetodid. Kettameetod on lihtne, laialdaselt kasutatav, kuid annab ainult kvalitatiivse vastuse. Usaldusväärsem ja täpsem kvantitatiivne meetod on antibiootikumide seerialahjendamise meetod toitekeskkonnas standardsetes katsetingimustes. Enamikul juhtudel on laboratoorsete andmete korrelatsioon kliiniliste andmetega üsna täielik ja ravi on efektiivne, kui uuritakse dünaamikas mitte ainult protsessi kliinilist kulgu, vaid ka patogeeni võimalikku muutust või selle tundlikkust antibiootikumide suhtes.
Antibiootikumide kontsentratsioon kudedes ja kehavedelikes, samuti nende antimikroobne toime on üks peamisi parameetreid, mis määravad antibiootikumravi efektiivsuse. Selle uuringus kasutatakse enim mikrobioloogilisi uurimismeetodeid, mis põhinevad antibiootikumi võimel pidurdada uuritava mikroobi kasvu. Mikrobioloogilistest meetoditest antibiootikumide kontsentratsioonide määramiseks kehavedelikes ja kudedes on enim kasutatud agari difusioonimeetodit ja seerialahjendusmeetodit vedelas toitekeskkonnas.
Praeguseks on antibiootikumiresistentsuse automaatseks ja poolautomaatseks tuvastamiseks ja hindamiseks loodud mikrobioloogilised süsteemid, mis võivad oluliselt kiirendada bakterioloogilist analüüsi ja tõsta selle täpsust. Antibiootikumide farmakokineetika uurimiseks on olemas kiirendatud füüsikalis-keemilised ja keemilised meetodid (ensümaatiline immunoanalüüs, immunofluorestsents jne), mis aitavad kiiresti optimeerida raviskeeme, neid individualiseerida ja tõsta etiotroopse ravi efektiivsust.
Antibiootikumi valikul tuleks lähtuda infost üksikute patogeenide minimaalsete inhibeerivate kontsentratsioonide kohta, mis võivad olla erinevad nii mikroobitüübi kui ka patsiendi organismi erinevate kudede (keskkondade) suhtes. Praktikas saavutatakse ravitoime antibakteriaalsete ravimite väljakirjutamisega annustes, mis tagavad nende kõrgema taseme domineerivate elupaikade ja patogeenide keskkondades.
Antibiootikumravi ebaefektiivsed põhjused. Antibiootikumravi ebaõnnestumised on tingitud eelkõige sellest, et ravi viiakse läbi ilma nakkushaiguse patogeenide tundlikkust ettenähtud ravimi suhtes arvestamata, samas ei järgita antibiootikumravi individuaalset taktikat. Lisaks võib ravi ebaõnnestumise põhjuseks olla vale annuste ja ravimi manustamisviiside valik, ravi hiline alustamine, antibiootikumide kasutamine väikestes annustes kombineeritud ravis ning ravikuuri ebapiisav kestus. Alati ei võeta arvesse ravimite inaktiveerimise võimalust keha ensüümsüsteemide poolt, nende seondumist vere ja koevalkudega. Isegi patogeeni õige tundlikkuse korral antibiootikumi suhtes on ebarahuldavad ravitulemused võimalikud, kuna ebapiisav verevarustus, bioloogilise barjääri moodustumine (granulatsioonivõll, fibriini ladestumine) on tingitud ravimi halvast tungimisest infektsioonikoldesse. , kudede nekroos jne) infektsioonikolde ümbruses, ebasoodsad imendumistingimused koos generaliseerunud kapillaartoksikoosiga.
Praegu on olemas mõiste "makroorganismi kemoterapeutiline resistentsus", kui ravitulemuste puudumist ei seostata antibiootikumiga, vaid selle määrab patsiendi keha seisund, selle reaktiivsuse vähenemine. Seetõttu tuleb etiotroopsete ainete kasutamine tingimata kombineerida aktiivse patogeneetilise raviga. Antibiootikumidel ei ole sageli lõplikku desinfitseerivat toimet nakkushaiguste korral, mis tekivad glükokortikosteroidide, tsütostaatikumide, kaasuva kiiritushaiguse jms kasutamise taustal.
Mõnikord on ravi positiivsed tulemused isegi siis, kui isoleeritud patogeen on selle ravimi suhtes resistentne. Selle põhjuseks on antibiootikumide (eriti bensüülpenitsilliini) kasutamine suurtes ("mega") annustes, mis on palju suuremad kui IPC laboris kehtestatud.
Antibiootikumide kõrvalmõju. Antibiootikumide ja keemiaravi käigus on vaja mitte ainult hästi tunda ravis kasutatavate ravimite antimikroobset toimet, vaid olla teadlik ka nende kõrvaltoimete võimalikkusest, patogeneesist, avaldumisvormidest, ennetamisest ja ravist. Antibiootikumide ja keemiaravi ravimite kõrvalmõju taandub peamiselt allergilisteks, toksilisteks reaktsioonideks või sõltub keemiaravi kõrvalmõjust – bakteriolüüsi reaktsioon, düsbakterioos, superinfektsioon jne.

Allergiliste reaktsioonide kliinilisi ilminguid väljendatakse anafülaktilise šoki, nahakahjustuste, limaskestade, Quincke ödeemi, astmaatilise bronhiidi kujul.
Toksiliste reaktsioonide avaldumist iseloomustavad selged sümptomid ja need esinevad sagedamini kui allergilised. Aminoglükosiidide võtmisel on neile iseloomulik kuulmisnärvi neuriit, nägemisnärvi kahjustus, vestibulaarsed häired, polüneuriidi võimalik areng ja toksilised neerukahjustused. Tetratsükliinid, rifampitsiin, erütromütsiin, sulfoonamiidid omavad hepatotoksilist toimet. Klooramfenikool, rifampitsiin, streptomütsiin võivad avaldada patoloogilist toimet vereloomesüsteemile. Tetratsükliin, erütromütsiin, amfoteritsiin B jne avaldavad seedetraktile toksilist toimet.
Antibiootikumide kõrvalmõju Seotud bioloogilise aktiivsusega peaks hõlmama Jarisch-Herxheimeri reaktsiooni, nakkuslik-toksilist šokki, mis on põhjustatud nn "toksiini šokist" massilise bakteriolüüsi tulemusena. Nakkuslik-toksiline šokk areneb sageli intensiivse baktereemiaga infektsioonide korral (meningokokeemia, kõhutüüfus, leptospiroos jne), eriti bakteritsiidsete antibakteriaalsete ravimite kasutamisel. Šoki teket hoiab ära glükokortikosteroidide samaaegne manustamine (pulssravi), infusioon-detoksikatsiooniravi. Samal põhjusel on meningokokeemiaga patsientide ravi soovitatav alustada bakteriostaatilise ravimi - klooramfenikooli - kasutamisega.
Antimikroobsed ained võib põhjustada düsbakterioosi ehk organismi immuunvastuse pinge vähenemist, mis lõpuks väljendub re- või superinfektsioonina. Normaalse soole mikrofloora pärssimise tõttu võib tekkida hüpovitaminoos.
Antibiootikumide ja keemiaravi kõrvaltoimete vältimine põhineb radikaalsel ravil, mille käigus on teada ravimi üldised omadused, toimemehhanismid, farmakokineetika ja kasutusviisid.
Tagasi numbri juurde
Kriitilise ravi meditsiinis kasutatavate antibakteriaalsete ravimite põhirühmade omadused
Antibiootikumid klassifitseeritakse mikroflooraga kokkupuute tulemuse, keemilise struktuuri ja toimemehhanismi järgi.
Antibakteriaalsete ravimite (ABP) klassifitseerimise aluseks on nende keemiline struktuur. Antibiootikumide klassifikatsioon nende järgi keemiline struktuur on toodud tabelis. üks.
Formaalselt tähendab mõiste "antibiootikumid" ainult neid aineid, mida toodavad mikroobid. Seetõttu ei ole antibakteriaalsed või antimikroobsed ained, nagu sulfoonamiidid, kinoloonid ja trimetoprim, rangelt võttes antibiootikumid.
Bakteritsiidse ja bakteriostaatikumi üldiste teoreetiliste kontseptsioonide põhjal on need mõisted suhtelised, kuna mõlemad ravimite rühmad häirivad valgusünteesi erinevates rakustruktuurides. Ainus erinevus seisneb selles, et bakteritsiidne toime sõltub ravimi kontsentratsioonist bioloogilistes vedelikes ja bakteriostaatiline toime ei sõltu sellest või sõltub sellest vähe. Mikroorganismidega kokkupuute tagajärjel toodavad bakteritsiidseid antibiootikume hävitades mikroobiraku ja bakteriostaatiline- selle kasvu ja paljunemise pärssimine. Bakteritsiidsed preparaadid kasutatakse raskete ägedate nakkusprotsesside korral.Ägeda nakkusprotsessi põhjustab intensiivne rakkude jagunemine. Valgusünteesi rikkumisega rakkude jagunemise toime on lühike protsess, seetõttu on bakteritsiidsed ravimid lühiajalised, neid kasutatakse kuni kliinilise toime saamiseni.
Bakteriostaatilised ravimid- ravimid pikaajaliseks kasutamiseks kroonilise kulgemise või infektsioonide raviks ägedate protsesside vajumise staadiumis. Resistentsus makroliidide, rifampitsiini, linkomütsiini, fusidiini suhtes areneb aga kiiresti välja, mistõttu soovitatakse neid kasutada kuni 5-päevaste lühikeste kuuridena. Toimemehhanismi järgi jagatakse antibiootikumid tavaliselt kolme rühma:
I rühm - antibiootikumid, mis rikuvad mitoosi ajal mikroobide seina sünteesi: penitsilliinid, tsefalosporiinid (CS), karbapeneemid, monobaktaamid (astreonaam), ristomütsiin, fosfomütsiin, glükopeptiidravimid (vankomütsiin, teikoplaniin). Farmakoloogilise toime järgi on selle rühma ravimid bakteritsiidsed antibiootikumid.
II rühm - antibiootikumid, mis rikuvad tsütoplasmaatilise membraani funktsiooni: polümüksiinid, polüeeni ravimid (nüstatiin, levoriin, amfoteritsiin B jne).
Farmakoloogilise toime järgi on need ka bakteritsiidsed.
III rühm - antibiootikumid, mis häirivad valkude ja nukleiinhapete sünteesi: levomütsetiin, tetratsükliinid, linkosamiidid (linkomütsiin, klindamütsiin), makroliidid (erütromütsiin, roksitromütsiin, asitromütsiin jne), rifamütsiinid, fusidiin, griseofulviin (AG), aminokaanglükosamütsiin gentamütsiin, netilmitsiin jne).
Farmakoloogilise toime järgi on need bakteriostaatilised. Erandiks on amikatsiin, mis toimib bakteritsiidne sõltumata kontsentratsioonist.
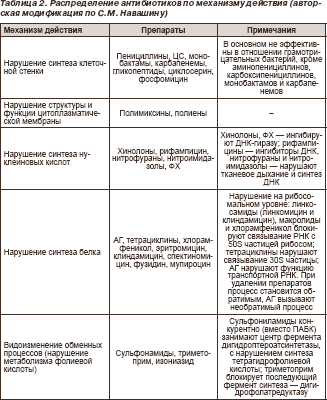
AT viimastel aegadel aktsepteeritud antibiootikumide jagamine vastavalt toimemehhanismile 5 põhirühma (tabel 2).
ABP peamiste rühmade omadused
ABP-de kasutamise süstematiseerimiseks on olemas WHO oluliste ravimite nimekiri (WHO Mode1 List of essential Drugs). WHO esitatud nimekiri on ligikaudne mudel sellise nimekirja koostamiseks igas riigis, võttes arvesse kohalikke tervisetingimusi. Nagu näitab praktika, on antimikroobsete ravimite arv erinevates riikides ligikaudu sama. Oma ülevaates tahame tutvustada peamisi loomsete kõrvalsaaduste kõrvaltoimeid, mida kasutatakse intensiivravis.
Penitsilliinid
Penitsillinaasi suhtes stabiilsed penitsilliinid. Oksatsilliini antimikroobse toime spekter on lähedane looduslikele penitsilliinidele (grampositiivsed bakterid), kuid aktiivsuse tase streptokokkide ja pneumokokkide vastu on mitu korda madalam; ei mõjuta enterokokke, gonokokke ja anaeroobsed bakterid. Peamine erinevus oksatsilliini ja looduslike ja teiste poolsünteetiliste penitsilliinide vahel on resistentsus stafülokoki beeta-laktamaasidele, ensüümidele, mis hävitavad penitsilliinide beeta-laktaamtsüklit.
Oksatsilliin on kõrge aktiivne vahend Staphylococcus aureus'e ja koagulaasnegatiivsete vastu, kuid ei mõjuta erineva resistentsusmehhanismiga stafülokokke - nn metitsilliini- või oksatsilliiniresistentseid stafülokokke. Oksatsilliini peamised näidustused on oksatsilliini suhtes tundlike stafülokokkide põhjustatud infektsioonid, samuti stafülokoki kahtlusega infektsioonid (äge artriit, äge osteomüeliit, tüsistusteta naha ja pehmete kudede infektsioonid, trikuspidaalklapi endokardiit). Oksatsilliini piisav annustamisskeem haiglas saadud stafülokoki infektsioonide korral on 2 g intravenoosselt 4-6-tunnise intervalliga Suukaudsel manustamisel imendub oksatsilliini seedekulglas halvasti, seetõttu on eelistatav kasutada kloksatsilliini või dikloksatsilliini.
Aminopenitsilliinid neil on mõnede gramnegatiivsete bakterite tõttu laiem toimespekter võrreldes looduslike penitsilliinidega - E. coli, Shigella spp., Salmonella spp., Proteus mirabilis, Haemophilus influenzae(peamiselt kogukonnas omandatud tüved); ravimid on samuti aktiivsed anaeroobsed mikroorganismid, kuid vastupidavuse tase neile on kõrge. Samal ajal hüdrolüüsivad aminopenitsilliinid stafülokokkide ja gramnegatiivsete bakterite β-laktamaaside toimel, mistõttu ei ole neil praegu haiglanakkuste ravis olulist tähtsust.
Ampitsilliin kasutatakse parenteraalselt (suukaudsel manustamisel madal biosaadavus) kogukonnas omandatud kopsupõletiku, nakkusliku endokardiidi, meningiidi korral. Amoksitsilliin Seda kasutatakse mitte-raskete kogukonnas omandatud hingamisteede infektsioonide korral ja seda võib määrata ka ampitsilliini asendamiseks astmelises ravis.
Inhibiitoriga kaitstud aminopenitsilliinid ei hävita enamik gramnegatiivsete bakterite beetalaktamaase, mistõttu on nende antimikroobse toime spekter laiem võrreldes kaitsmata ravimitega mõnede gramnegatiivsete bakterite vastu ( Klebsiella spp. , Proteus vulgaris, Moraxella catarrhalis, Citrobacter diversus) ja anaeroobid ( Bacteroides fragilis). Peamine näidustus inhibiitoritega kaitstud penitsilliinide kasutamiseks haiglas on postoperatiivsete septiliste tüsistuste intraoperatiivne ennetamine. Sel eesmärgil manustatakse ravimit ühekordse annusena 30-60 minutit enne operatsiooni. (amoksitsilliin/klavulanaat 1,2 g, ampitsilliin/sulbaktaam (ampisulbiin-CMP) 3 g, unasiin). Inhibiitoriga kaitstud penitsilliinid on väga tõhusad abstsesseeriva kopsupõletiku ja kergete vaagnapõletike korral. Amoksitsilliin/klavulanaat on samuti aluseks haiglaravil viibivate patsientide raviks, kellel on mõõduka raskusega kogukonnas omandatud kopsupõletik või kroonilise bronhiidi ägenemine. Haiglainfektsioonide korral (kopsupõletik, peritoniit, nahk ja pehmed koed) on nende ravimite väärtus peamiste patogeenide märkimisväärse resistentsuse tõttu madal.
Karboksüpenitsilliinid ja ureidopenitsilliinid. Neid ravimeid kombineeritakse tavaliselt ühe nime all - antipseudomonas penitsilliinid. Neil on aminopenitsilliinidega (enamik perekonna baktereid) laiem toimespekter Enterobacteriaceae, Рseudomonas aeruginosa), kuid neid ravimeid hävitavad gramnegatiivsete bakterite ja stafülokokkide β-laktamaasid, mistõttu on nende kasutamine praegu piiratud. Peamine näidustus on Pseudomonase infektsioonid, kuid tuleb arvestada resistentsuse suurenemisega R. aeruginosa karboksü- ja ureidopenitsilliinidele. Nende ravimite väljakirjutamisel pseudomonase infektsiooni jaoks (väljakujunenud tundlikkusega!) tuleb neid kombineerida aminoglükosiididega, kasutades piisavaid annuseid: karbenitsilliin intravenoosselt 4-5 g 4-tunnise intervalliga, piperatsilliin intravenoosselt 2-4 g intervalliga 6-8 tundi Anti-pseudomonaalsete penitsilliinide (eriti karboksüpenitsilliinide!) kasutamisel on vajalik kontrollida elektrolüütide sisaldust veres ja vere hüübimisnäitajaid.
Kaitstud antipseudomonas penitsilliinid. Neil on haiglanakkuste näidustused laiemad, kuid arvestada tuleks ka suurenenud viimased aastad gramnegatiivsete bakterite resistentsus nende ravimite suhtes. Tikartsilliin/klavulanaat ja piperatsilliin/tasobaktaam kasutatakse peamiselt segatüüpi aeroobsete-anaeroobsete infektsioonide korral - intraabdominaalsed ja günekoloogilised infektsioonid, kopsupõletikud. Nende ravimite kombinatsioon aminoglükosiididega on soovitatav, eriti raskete infektsioonide korral. Tikartsilliini / klavulanaadi annustamisskeem on 3,2 g intravenoosselt 6-8-tunnise intervalliga, piperatsilliini / tasobaktaami - 2,5-4,5 g intervalliga 8 tundi.
Tsefalosporiinid
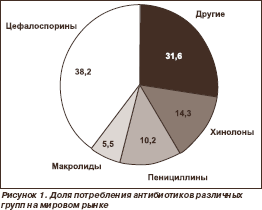
Tsefalosporiinide tarbimine "suurenes nii järsult, et seda saab võrrelda esialgse reaktsiooniga penitsilliini ilmumisele". Neid peetakse intensiivraviosakonnas enim määratud ABP-deks maailmas (joonis 1).
Sellesse rühma kuuluvad erineva antimikroobse toime spektriga ravimid, seetõttu jaotatakse need sõltuvalt spektrist põlvkondadesse. Kõigile tsefalosporiinidele (va tsefoperasoon/sulbaktaam) on omane nõrk toime anaeroobsete mikroorganismide vastu (seetõttu, kui segainfektsioonid neid tuleks kombineerida metronidasooli või linkosamiididega). Kõik CA-d ei ole aktiivsed enterokokkide, metitsilliiniresistentsete stafülokokkide, listeria ja atüüpiliste mikroorganismide (legionella, klamüüdia, mükoplasma) vastu.
1. põlvkonna tsefalosporiinid. Neil on valdav toime grampositiivsete bakterite (stafülokokid, streptokokid, pneumokokid) ja mõnede gramnegatiivsete bakterite vastu. E. coli, Shigella spp., Salmonella spp., R. mirabilis.
Gramnegatiivsete bakterite haiglatüvede omandatud resistentsuse laialdase leviku tõttu on esimese põlvkonna tsefalosporiinide kliiniline tähtsus nendes infektsioonides siiski väike. Peamine kliiniline rakendus tsefasoliin haiglas - väljakujunenud stafülokoki infektsioon erinev lokaliseerimine.
2. põlvkonna tsefalosporiinid mida esindab tsefuroksiim (Zinacef, Kimacef), millel on laiem toimespekter gramnegatiivsete bakterite vastu, leiate rohkem lai rakendus haiglanakkustega, kuid enamikul juhtudel on soovitatav neid kombineerida aminoglükosiididega. Tsefuroksiim on efektiivne kogukonnas omandatud tüsistusteta kopsupõletiku korral. Näidustatud nakkuslike tüsistuste ennetamiseks pärast operatsiooni.
Tsefalosporiinid III põlvkond mida iseloomustab kõrge aktiivsus gramnegatiivsete enterobakterite vastu ja tsefotaksiim ja tseftriaksoon arvuline tseftasidiim ja tsefoperasoon. Põhiline erinevus nende ravimite vahel on toime Pseudomonas aeruginosale: tsefotaksiimil ja tseftriaksoonil ei ole märkimisväärset toimet. R. aeruginosa(soovitav on jagada need alarühma IIIa), tseftasidiim ja tsefoperasoon on aktiivsed R. aeruginosa(tseftasidiim on veidi parem kui tsefoperasoon) - alarühm IIIb. Sellest lähtuvalt erineb ka nende tsefalosporiinide koht haiglanakkustes. Tseftasidiim (tseftum) ja tsefoperasoon (gepacef, tsefobiid) on peamised ravimid väljakujunenud Pseudomonas-nakkuste või kõrge haigestumise riskiga haiguste ravis R. aeruginosa. Tsefoperasoon, mis tungib suures kontsentratsioonis sappi, on näidustatud ka sapiteede infektsioonide raviks. Tsefotaksiim ja tseftriaksoon (oframaks) on praegu põhiravimid erinevate haiglanakkuste ravis. Nende tsefalosporiinide aktiivsuse tase on sama, erinevused nende vahel on seotud eliminatsiooni kiirusega: tseftriaksooni poolväärtusaeg on umbes 8 tundi, seega määratakse ravim annuses 2 g 24-tunnise intervalliga. , tsefotaksiim eritub kiiremini, seetõttu manustatakse tavaliselt 2 g 6-8-tunnise intervalliga.
IV põlvkonna tsefalosporiinid. Praegu esindab üks ravim - tsefepiim (maksimaalne), millel on tsefalosporiini antibiootikumide seas kõige laiem ja tasakaalustatuim antimikroobse toime spekter. On kliiniliselt oluline, et tsefepiim võib jääda aktiivseks teatud tüvede vastu Enterobakterid(peamiselt Enterobakter spp., Serratia spp., Morganellamorganii, Providencia rettgeri, C. freundii, mis on C-klassi kromosomaalsete beetalaktamaaside hüpertootjad), on resistentsed III põlvkonna tsefalosporiinide suhtes. Tsefepiim on aktiivne ka teatud tüvede vastu Klebsiella spp., mis toodavad laiendatud spektriga beeta-laktamaasi, kuid mitmed tüved on resistentsed. Tsefepiimi peamiseks kasutusvaldkonnaks kliinikus on rasked haiglanakkused, eriti kolmanda põlvkonna tsefalosporiinide suhtes resistentsete enterobakterite puhul. Tsefepiimi saab kliinikus kasutada rotatsiooniskeemides, st ajutiseks asendamiseks III põlvkonna tsefalosporiinide empiirilise ravi skeemides, kui nende suhtes on kõrge resistentsus. On näidatud, et kolmanda põlvkonna tsefalosporiinide perioodiline muutmine tsefepiimiks intensiivravi osakonnas (ICU) võib piirata resistentsete mikroorganismitüvede kasvu ja isegi taastada mikroobide tundlikkust kolmanda põlvkonna tsefalosporiinide suhtes.
Inhibiitoriga kaitstud tsefalosporiinid. Kolmanda põlvkonna antipseudomonase tsefalosporiini tsefoperasooni ja beeta-laktamaasi inhibiitori sulbaktaami kombinatsioon — tsefoperasoon/sulbaktaam (sulperasoon)— sellel on laiem toimespekter kui kolmanda põlvkonna CA-del, kuna säilib aktiivsus enterobakterite ja anaeroobide vastu, mis toodavad β-laktamaasi, sealhulgas laiendatud spektriga (ESBL) ja hävitavad teisi TC-sid. Ravimit kasutatakse erineva lokaliseerimisega raskete haiglanakkuste raviks ning aeroobsete-anaeroobsete segainfektsioonide korral võib seda kasutada monoteraapiana.
Karbapeneemid
Ukraina ravimiturgu esindavad peamiselt kaks antibiootikumi - imipeneem/tsilastatiin (tienaam) ja meropeneem (meroneem). Neid iseloomustab kõigi beetalaktaamantibiootikumide – grampositiivsete ja gramnegatiivsete aeroobsete bakterite, anaeroobide – hulgas kõige laiem antimikroobse toime spekter. Nosokomiaalsete infektsioonide tekitajatest on ainult kolmel mikroorganismil loomulik resistentsus karbapeneemide suhtes: Enterococcus faecium, Stenotrophomonas maltophilia, samuti metitsilliiniresistentsed tüved Stafülokokk spp. Kliiniliselt on oluline, et haiglas kasutatavate mikroorganismide tüvede sekundaarne resistentsus karbapeneemide suhtes areneb välja üliharva (erandiks on R. aeruginosa). vastupanu R. aeruginosa karbapeneemidele on kõrgem ja intensiivraviosakonnas võib see ulatuda 15-20%. Karbapeneemid jäävad tüvede vastu aktiivseks Enterobakterid resistentne III ja IV põlvkonna tsefalosporiinide, aminoglükosiidide ja fluorokinoloonide (FC) suhtes. Imipeneem on veidi aktiivsem in vitro grampositiivsete organismide vastu, meropeneem on aktiivsem gramnegatiivsete bakterite vastu (kliiniliselt ei ole need erinevused tõenäoliselt olulised); ravimite toime anaeroobide vastu on sama ja ületab metronidasooli ja linkosamiidide oma. Karbapeneeme kasutatakse raskete haiglanakkuste raviks, mis on põhjustatud multiresistentsest ja segamikrofloorast, eelkõige siis, kui esmavaliku ravimid – tsefalosporiinid või fluorokinoloonid – on ebaefektiivsed. Kontrollitud kliinilistes uuringutes on karbapeneemid olnud sama tõhusad või paremad kui tsefalosporiinidel (või poolsünteetilistel penitsilliinidel) ja aminoglükosiididel põhinevad standardsed kombineeritud antibiootikumirežiimid.
Karbapeneemide peamised näidustused: intraabdominaalsed infektsioonid, operatsioonijärgsed haavainfektsioonid, nosokomiaalne kopsupõletik, sealhulgas ventilaatoriga seotud kopsupõletik, kopsupõletik (abstsess, empüeem), vaagnapõletikud, komplitseeritud infektsioonid kuseteede sepsise, osteomüeliidi, meningiidiga (ainult meropeneem). Tuleb rõhutada, et eluohtlike infektsioonide korral tuleks karbapeneeme käsitleda mitte reservainetena, vaid esmavaliku antibiootikumidena, kuna raskelt haigete patsientide prognoosi saab parandada ainult siis, kui võimalikult varakult määratakse piisav antibiootikumravi. Need olukorrad peaksid eelkõige hõlmama nakkuslikke tüsistusi intensiivraviosakonnas mehaanilise ventilatsiooni saavatel patsientidel (eriti ARACH II > 20 korral), nakkusi, mille on põhjustanud R. aeruginosa ja Acinetobacter spp., gramnegatiivsed bakterid (peamiselt Klebsiella spp., P. vulgaris), mis toodab laia toimespektriga beetalaktamaasi, immuunpuudulikkusega patsientide infektsioonid (febriilne neutropeenia), gramnegatiivsete bakterite põhjustatud mädane postoperatiivne meningiit või R. aeruginosa.
Hiljuti on kliinilises praktikas ilmunud uus karbapeneem - ertapeneem, MSD (Invanz), mida iseloomustavad paranenud farmakokineetilised omadused ja mida on ette nähtud 1,0 grammi 1 kord päevas; manustamisviis: intramuskulaarne ja intravenoosne.
Aminoglükosiidid
Eraldage kolme põlvkonna ravimid. AG I põlvkonda (streptomütsiin, kanamütsiin) kasutatakse praegu eranditult ftisioloogias. AG II (gentamütsiin, tobramütsiin) ja III põlvkond (netilmitsiin, amikatsiin (amikiin, amitsiil)) kasutatakse laialdaselt kliinilises praktikas. AG-del on lai valik looduslikku antimikroobset toimet, kuid ravimitel on väike mõju streptokokkidele ja pneumokokkidele ning need ei ole aktiivsed anaeroobsete bakterite vastu. Enamik kõrged väärtused Amikatsiini kasutamisel täheldati gramnegatiivsete bakterite vastast in vitro MIC-d, kuid seda kompenseerivad amikatsiini suuremad annused võrreldes teiste aminoglükosiididega ja vastavalt kõrgemad seerumikontsentratsioonid. Gramnegatiivsete bakterite omandatud resistentsuse tase on väga erinev ja erineb erinevate aminoglükosiidide vahel. Resistentsus aminoglükosiidide suhtes suureneb järgmises järjekorras: amikatsiin< нетилмицин < гентамицин = тобрамицин, т.е. штаммы грамотрицательных бактерий, резистентные к амикацину, будут также резистентны к другим аминогликозидам, штаммы, резистентные к нетилмицину, могут сохранять чувствительность к амикацину, но всегда будут устойчивы к гентамицину и тобрамицину. В отношении стафилококков эталонным аминогликозидом является гентамицин: при устойчивости стафилококков к гентамицину другие АГ также будут не активны.
Aminoglükosiidide puudused, mis piiravad nende kasutamist, hõlmavad toksilisust (neurotoksilisus, ototoksilisus, nefrotoksilisus), halba tungimist kudedesse. bronhopulmonaalne süsteem, aktiivsuse vähenemine kell mädased protsessid. Nefrotoksiliste mõjude vähendamiseks on soovitatav manustada üks aminoglükosiidide ööpäevane annus (seda lähenemisviisi ei kasutata nakkusliku endokardiidi, neutropeenia ja vastsündinute puhul). Arvestades neid puudusi, tuleks haiglanakkuste hüpertensiooni kasutada ainult koos teiste antibiootikumidega. Haiglas on optimaalne kasutada kahte aminoglükosiidi - gentamütsiini ja amikatsiini. Esimest on ratsionaalsem kasutada osakondades üldine profiil; amikatsiin, mis on tingitud madal tase resistentsus selle suhtes - intensiivravi osakonnas, samuti pseudomonase infektsioonide korral. Netilmitsiinil ei ole amikatsiiniga võrreldes olulisi eeliseid, kuid selle maksumus on kõrgem.
AG-sid kasutatakse ka teatud infektsioonide etiotroopse ravi põhiskeemides: Enterococcus faecalis: gentamütsiin + ampitsilliin (bensüülpenitsilliin); Enterococcus faecium: gentamütsiin + vankomütsiin (teikoplaniin); Streptococcus viridans(endokardiit): gentamütsiin + bensüülpenitsilliin (tseftriaksoon); Pseudomonas aeruginosa: amikatsiin (gentamütsiin) + tseftasidiim (tsefoperasoon, tsefepiim).
Fluorokinoloonid
Neil on lai antimikroobse toime spekter. Suurim aktiivsus on näidatud gramnegatiivsete bakterite vastu, sealhulgas P.aeruginosa. Stafülokokkide vastane toime on vähem väljendunud, streptokokkide ja pneumokokkide vastu - nõrk. Viimastel aastatel on arvutid ilmunud koos suurenenud aktiivsus grampositiivsete bakterite vastu (moksifloksatsiin, aveloks). PC-sid iseloomustab madal loomulik aktiivsus anaeroobide vastu, seetõttu on segainfektsioonide korral soovitatav neid kombineerida linkosamiidide (linkomütsiin või dalatsiin C) või metronidasooliga.
Viimastel aastatel on suurenenud gramnegatiivsete bakterite haiglatüvede resistentsus fluorokinoloonide suhtes, eelkõige P.aeruginosa. Gramnegatiivsete bakterite resistentsuse taseme varajaste fluorokinoloonide suhtes saab tinglikult korraldada järgmises järjestuses: tsiprofloksatsiin (tsifran)< офлоксацин (заноцин) = пефлоксацин < ломефлоксацин.
PC-d peetakse praegu teise valiku ravimiteks (pärast tsefalosporiine) erinevate haiglanakkuste ravis. Mõnes olukorras võib FC-d kasutada esmavaliku agendina, näiteks siis, kui kõrge tase gramnegatiivsete bakterite resistentsus tsefalosporiinide suhtes haiglas.
Glükopeptiidid
Glükopeptiidid on looduslikud antibiootikumid vankomütsiin ja teikoplaniin. Vankomütsiini on kliinilises praktikas kasutatud alates 1958. aastast, teikoplaniini alates 1980. aastate keskpaigast. Viimastel aastatel on huvi glükopeptiidide vastu suurenenud grampositiivsete mikroorganismide põhjustatud haiglanakkuste sageduse suurenemise tõttu. Praegu on metitsilliiniresistentsete stafülokokkide ja ampitsilliini suhtes resistentsete enterokokkide põhjustatud infektsioonide puhul eelistatud ravimid glükopeptiidid. Glükopeptiide kasutatakse empiirilise ravina kateetriga seotud sepsise ja febriilse neutropeeniaga patsientidel (ravi teises etapis).
Glükopeptiididel on bakteritsiidne toime, kuid need toimivad bakteriostaatiliselt enterokokkide, mõnede streptokokkide ja koagulaasnegatiivsete stafülokokkide vastu. Glükopeptiididel on toime grampositiivsete aeroobsete ja anaeroobsete mikroorganismide vastu: stafülokokid (sh metitsilliiniresistentsed tüved), streptokokid, pneumokokid (sealhulgas penitsilliiniresistentsed tüved), enterokokid, peptostreptokokid, listeria, korünebakterid (sh. C.difficile). Gramnegatiivsete mikroorganismide suhtes ei ole glükopeptiidid aktiivsed, kuna nad ei tungi läbi nende rakuseina. Vankomütsiini ja teikoplaniini antimikroobse toime spekter on sarnane, kuid loomuliku aktiivsuse ja omandatud resistentsuse tasemes on mõningaid erinevusi. Teikoplaniin on in vitro vastu aktiivsem Staphylococcus aureus(kaasa arvatud metitsilliini suhtes resistentsed tüved), mitmesugused streptokokid (sh S.pneumoniae) ja enterokokid. Vankomütsiin on in vitro aktiivsem koagulaasnegatiivsete stafülokokkide vastu. Seoses anaeroobsete kokkide ja klostriididega on ravimite toime sama.
Grampositiivsetel bakteritel tekib harva omandatud resistentsus glükopeptiidide suhtes. Vaatamata 40-aastasele kasutamisele ei ole tekkinud vankomütsiini suhtes resistentseid stafülokoki tüvesid. Samal ajal võib teikoplaniini kasutamise käigus väheneda stafülokoki tundlikkus selle suhtes ja isegi tekkida resistentsus. Vankomütsiini poolväärtusaeg on 6-8 tundi, teikoplaniinil - 40 kuni 120 tundi, sõltuvalt selle määramismeetodist. Pikk poolväärtusaeg seletab teikoplaniini kord päevas väljakirjutamise võimalust. Vankomütsiin ja teikoplaniin erituvad neerude kaudu glomerulaarfiltratsiooni teel, mistõttu patsientidel neerupuudulikkus nende annustamisskeemi korrigeerimine on vajalik. Ravimeid hemodialüüsiga ei eemaldata. Glükopeptiidide terapeutiliste kontsentratsioonide vahemik veres:
- vankomütsiin: maksimaalne (pärast 0,5 tundi) - 20-50 mg / l, minimaalne (enne järgmist süsti) - 5-10 mg / l;
- teikoplaniin: maksimaalne - 20-40 mg / l, minimaalne - 5-15 mg / l.
Glükopeptiidide kõrvaltoimed. Nefrotoksilisus: vankomütsiini kasutamisel on 5% või enamal juhtudest täheldatud neerufunktsiooni pöörduvat kahjustust (kreatiniini ja uurea taseme tõus veres, anuuria); sagedus sõltub ravimi annusest ja kestusest, patsientide vanusest; risk suureneb, kui seda kombineeritakse aminoglükosiidide või lingudiureetikumidega ja kui vankomütsiini kontsentratsioon veres ületab 10 mg / l. Tekoplaniini kasutamisel esineb neerufunktsiooni häireid vähem. Ototoksilisus: kuulmislangus, vestibulaarsed häired(patsientidel, kellel täiustatud funktsioon neerud). Neurotoksilisus: pearinglus, peavalu.
Reaktsioonid kl intravenoosne manustamine: näo ja ülakeha punetus, kihelus, valu rinnus ja tahhükardia, mõnikord hüpotensioon, mis on tingitud histamiini vabanemisest nuumrakkudest, mida täheldati vankomütsiini kiirel intravenoossel manustamisel. Tekoplaniini kasutamise taustal neid reaktsioone praktiliselt ei täheldata.
Võimalikud on ka teised kõrvaltoimed: flebiit, valu, põletustunne süstekohal, pöörduv leukopeenia, trombotsütopeenia, transaminaaside aktiivsuse mööduv tõus, aluseline fosfataas. Kõige paremini uuritud ja laialdasemalt kasutatav on vankomütsiin. Vankomütsiini kasutatakse järgmistel juhtudel:
- dokumenteeritud erineva lokaliseerimisega metitsilliiniresistentsete stafülokokkide infektsioon (kopsupõletik, naha ja pehmete kudede, kuseteede, luude ja liigeste infektsioon, peritoniit, nakkav endokardiit, sepsis);
— stafülokoki infektsioonid erineva lokaliseerimisega penitsilliinide ja tsefalosporiinide allergia korral;
- vastuvõtlike tüvede põhjustatud rasked infektsioonid Enterococcus faecium, Enterococcus faecalis, Corynebacterium jejkeium;
- põhjustatud nakkuslik endokardiit Streptococcus viridans ja S. bovis(kui olete beetalaktaamantibiootikumide suhtes allergiline), E.faecalis(kombinatsioonis gentamütsiiniga);
- penitsilliiniresistentsete tüvede põhjustatud meningiit S.pneumoniae.
Stafülokoki etioloogia kahtlusega eluohtlike infektsioonide empiirilise ravi vahendina:
- trikuspidaalklapi või proteesklapi infektsioosne endokardiit (kombinatsioonis gentamütsiiniga);
— kateetriga seotud sepsis;
- posttraumaatiline või postoperatiivne meningiit (kombinatsioonis kolmanda põlvkonna tsefalosporiinide või fluorokinoloonidega);
- peritoniit peritoneaaldialüüsiga;
- febriilne neutropeenia (koos ravi alustamise ebaefektiivsusega).
Vankomütsiini manustatakse suukaudselt ka antibiootikumidega seotud kõhulahtisuse korral Clostridium difficile. Vankomütsiini manustatakse ainult intravenoosselt aeglase infusioonina 60-120 minuti jooksul. Täiskasvanutele määratakse vankomütsiini 1 g 12-tunniste intervallidega.Neerufunktsiooni kahjustusega patsientidel kohandatakse vankomütsiini annust vastavalt kreatiniini kliirensile. Terminaalse neerupuudulikkuse korral manustatakse ravimit 1 g annuses 7-10-päevase intervalliga. põhjustatud pseudomembranoosse koliidi ravis C.difficile, vankomütsiini manustatakse suukaudselt annuses 0,125 g iga 6 tunni järel (ravimi lahuse valmistamiseks lahjendatakse pulber 30 ml vees; maitse parandamiseks võib kasutada siirupeid või muid lisandeid).
Oksasolidinoonid
Linesoliid- uue sünteetilise klassi esimene esindaja antimikroobsed ained — oksasolidinoonid. Linesoliidi toimemehhanism on seotud valgusünteesi pärssimisega ribosoomides. bakterirakk. Erinevalt teistest valgusünteesi inhibeerivatest antibiootikumidest toimib linesoliid translatsiooni varases staadiumis (pöördumatu seondumine ribosoomi 30S ja 50S alaühikutega), mille tulemuseks on 70S kompleksi moodustumise ja peptiidahela moodustumise katkemine. Unikaalse toimemehhanismi tõttu puudub mikroorganismide ristresistentsus linesoliidi ja teiste ribosoomidele mõjutavate antibiootikumide suhtes (makroliidid, linkosamiidid, streptogramiinid, AG, tetratsükliinid ja klooramfenikool).
Linesoliidi määramise põhipunkt on stafülokokkide MKSA tüvede olemasolu osakonnas, resistentsus glükopeptiidide (vankomütsiini) suhtes, vankomütsiini suhtes resistentsete enterokokkide tüvede olemasolu. Linezolidi kasutatakse raske nosokomiaalse ja ventilaatoriga seotud kopsupõletiku korral.
Linesoliidi antibiootikumijärgne toime in vitro (PABE) jaoks Staphylococcus aureus on umbes 2 tundi. Loommudelites oli PABE in vivo 3,6–3,9 tundi Staphylococcus aureus ja Streptococcus pneumoniae vastavalt.
Linesoliidi suhtes tundlikud mikroorganismid:
—Grampositiivsed aeroobid: Corynebacterium jejkeium, Enterococcus faecalis(sealhulgas glükopeptiidiresistentsed tüved), Enterococcus faecium(glükopeptiidiresistentsed tüved), Enterococcus casseliflavus, Enterococcus gallinarum, Listeria monocytogenes, Staphylococcus aureus(kaasa arvatud MKSA tüved), Staphylococcus epidermidis, Staphylococcus haemolyticus, Streptococcus agalactiae, Streptococcus intermedius, Streptococcus pneumoniae(sealhulgas penitsilliini suhtes risttundlikud tüved ja penitsilliiniresistentsed tüved); Streptococcus pyogenes, rühma streptokokid viridanid, rühma C streptokokid;
— gramnegatiivneaeroobid: Pasteurella canis, Pasteurella multocida;
— grampositiivneanaeroobid: Clostridium perfingens, Peptostreptococcus anaerobius, Peptostreptococcus spp .;
— gramnegatiivneanaeroobid: Bacteroidas fragilis, Prevotella spp. ;
— muud: klamüüdiarpeitoniae.
Mõõdukalt tundlikud mikroorganismid:
— Legionella spp ., Moraxellasatarrhalis, mükoplasma spp .
takistuslikmikroorganismid:
— Neisseria spp ., Pseudomonas spp .
Praktiliselt on oluline, et linesoliid säilitaks aktiivsuse metitsilliiniresistentsete stafülokokkide vastu ning aktiivsuse raskusaste (vastavalt IPC väärtustele) ei erineks metitsilliinitundlike ja -resistentsete tüvede puhul. Linesoliidil on tugev toime S. peitoniae, mõlemad tüved on penitsilliini või erütromütsiini suhtes tundlikud ja resistentsed. Praegu pole tüvesid isoleeritud. S. peitoniae vähenenud tundlikkusega linesoliidi suhtes. Linesoliid on aktiivne ka tseftriaksooni, klindamütsiini, tetratsükliini, klooramfenikooli suhtes resistentsete pneumokokkide tüvede vastu. Linesoliidil on stabiilne toime E. faecalis, E. faecium. Kõrgelt oluline vara linesoliid säilitab aktiivsuse nende enterokokkide tüvede vastu, mis on resistentsed vankomütsiini ja teikoplaniini suhtes, ning ravim avaldab toimet glükopeptiidide suhtes resistentsuse erinevate fenotüüpide korral. Linesoliidil on vankomütsiiniga sarnane toime grampositiivsete anaeroobide vastu. Clostridium perfingens, C.difficile ja peptostreptokokid. Erinevalt vankomütsiinist toimib linesoliid ka eelkõige gramnegatiivsetele anaeroobsetele bakteritele Bacteroids fragilis, Fusobakterid spp., Prevotella spp.
Linesoliidi kasutatakse kui intravenoosne infusioon ja suukaudse ravimvormina. Suukaudsel manustamisel imendub linesoliid kiiresti ja täielikult, maksimaalne kontsentratsioon veres saabub 1-2 tunni pärast ja keskmiselt umbes 12 µg/ml. Ravimi absoluutne biosaadavus on 100%. Linesoliidi jaotusruumala on 50 liitrit, seos plasmavalkudega 31%, poolväärtusaeg 4,5-5,5 tundi.Linesoliid tungib hästi läbi naha ja pehmed koed, kopsud, süda, sooled, maks, neerud ja kesknärvisüsteem ning mõõdukalt - sisse sünoviaalvedelik, luud, sapp. Enamikus elundites on linesoliidi kontsentratsioon 60-70% seerumi kontsentratsioonist.
Linesoliid metaboliseerub maksas oksüdatsiooni teel kaheks väga nõrga antibakteriaalse toimega metaboliidiks. Linezolidi kasutatakse grampositiivsete mikroorganismide (stafülokokid, pneumokokid, enterokokid) põhjustatud erineva lokaliseerimisega infektsioonide raviks täiskasvanutel ja lastel:
- raske kogukonnas või haiglas omandatud kopsupõletik;
- Naha ja pehmete kudede tüsistunud infektsioonid;
tüsistusteta naha ja pehmete kudede infektsioonid ambulatoorne praktika;
- Tüsistunud kuseteede infektsioonid;
- baktereemia või sepsis;
- kõhuõõnesisesed infektsioonid;
- infektsioosne endokardiit.



Linesoliidil on väike toime Gramnegatiivsed bakterid seetõttu tuleks viimase eraldamisel ravile lisada III-IV põlvkonna tsefalosporiini või fluorokinolooni. Empiirilises ravis võib linesoliidi pidada valikravimiks raskete infektsioonide, nagu osteomüeliit, endokardiit või klapiasendus, kateetriga seotud baktereemia või sepsis ja peritoniit pideva ambulatoorse peritoneaaldialüüsi korral. Neutropeenilise palavikuga patsientidele võib linesoliidi manustada ravi teises etapis, kui esialgne ravi on ebaefektiivne. Haiglates koos kõrgsagedus MRSA linesoliidi võib pidada empiiriliseks teraapiaks kriitiliselt haigetele patsientidele (intensiivravi, ventileeritav kopsupõletik, hemodialüüs, põletusvigastus). Erinäidustused linesoliidi määramiseks etiotroopse ravi vahendina on järgmised:
- MRSA põhjustatud mis tahes lokalisatsiooniga infektsioonid;
- ampitsilliini suhtes resistentsete enterokokkide põhjustatud infektsioonid;
- põhjustatud infektsioonid E.faecium, resistentne vankomütsiini suhtes;
- põhjustatud rasketest infektsioonidest S. peitoniae resistentsed penitsilliini ja kolmanda põlvkonna tsefalosporiinide, peamiselt meningiidi ja sepsise suhtes.
Kõrvalmõjud. Valu, kõhukrambid, puhitus, hematoloogilised ja maksafunktsiooni häired, kõhulahtisus, peavalu, kandidoos, iiveldus, oksendamine, trombotsütopeenia, leukopeenia ja pantsütopeenia. neuropaatia (perifeerne oftalmiline närv) on täheldatud linesoliidi kasutamisel maksimaalsest soovitatavast 28-päevasest ravikestusest kauem.
Hemodialüüsi korral eritub ligikaudu 30% linesoliidi annusest.
Kasutusomadused. Mõnedel patsientidel võib tekkida müelosupressioon (aneemia, trombotsütopeenia, leukopeenia ja pantsütopeenia), mis sõltub täielikult ravi kestusest. Linesoliidi manustatakse kaks korda päevas intravenoosselt või suukaudselt. Suukaudsel manustamisel imendub see seedetraktist hästi, maksimaalne kontsentratsioon veres 2 tunni pärast.Infusioonilahus tuleb manustada 30-120 minuti jooksul.
Patsiendid, kes on alustanud ravi suukaudse ravimvormiga, võidakse üle minna süstitavale ravimvormile, kui see on kliiniliselt näidustatud, ja vastupidi. Sel juhul ei ole vaja täiendavat annust valida, kuna linesoliidi biosaadavus nii suukaudselt kui ka intravenoosselt on peaaegu 100%.
Kasutamine raseduse ja imetamise ajal. Piisavaid uuringuid linesoliidi ohutuse kohta raseduse ajal ei ole läbi viidud, seetõttu tuleks seda ravimit selle kategooria patsientide puhul kasutada ainult absoluutsetel tervislikel põhjustel. Ei ole teada, kas linesoliid eritub rinnapiima, seetõttu tuleb seda kasutada ettevaatusega.
Farmakokineetika in erinevad rühmad haige. Linesoliidi kliirens on lastel suurem ja väheneb koos vanusega. Üle 65-aastaste patsientide rühmas linesoliidi farmakokineetika oluliselt ei muutu. Naistel on täheldatud mõningaid farmakokineetilisi erinevusi, mis väljenduvad veidi väiksemas jaotusruumalas, kliirensi vähenemises ligikaudu 20%, mõnikord ka kõrgemate plasmakontsentratsioonide korral. Mõõduka, mõõduka ja raske neerupuudulikkusega patsientidel ei ole annuse kohandamine vajalik, kuna kreatiniini kliirensi ja ravimi neerude kaudu eritumise vahel puudub seos. Kuna 30% ravimi annusest eritub 3-tunnise hemodialüüsi ajal, saavad patsiendid sarnane ravi linesoliidi tuleb manustada pärast dialüüsi. Linesoliidi farmakokineetika ei muutu patsientidel, kellel on maksapuudulikkus Seetõttu ei ole vaja ravimi annust kohandada. Linesoliidi farmakokineetikat raske maksakahjustusega patsientidel ei ole uuritud. Kuna aga linesoliid metaboliseerub mitteensümaatilise protsessi kaudu, näib, et maksafunktsioon ei muuda oluliselt linesoliidi metabolismi.
Koostoimed teiste ravimitega.
Farmakoloogiline. Linezolid infusioonilahus sobib järgmiste lahustega: 5% dekstroosi lahus, 0,9% naatriumkloriidi lahus, ringeralaktaadi süstelahus. Ei tohiks sisestada lisakomponendid linesoliidi infusioonilahuses. Linezolid infusioonilahus on füüsikaliselt ja keemiliselt kokkusobimatu järgmiste ravimitega: amfoteritsiin B, kloorpromasiinvesinikkloriid, diasepaam, pentamidiinisetionaat, naatriumfenütoiin, erütromütsiinlaktobionaat ja trimetoprimsulfametoksasool. Lisaks ei pruugi lahus olla keemiliselt tseftriaksooniga kokkusobiv.
Farmakodünaamiline. Linesoliid on nõrk pöörd-mitteselektiivne monoamiini oksüdaasi (MAO) inhibiitor, seetõttu võib ravim mõnel patsiendil põhjustada pseudoefedriinvesinikkloriidi ja fenüülpropanoolamiinvesinikkloriidi survestava toime mõõdukat suurenemist. Soovitatav on vähendada adrenergiliste ravimite, nagu dopamiini (või selle agonistide) algannuseid ja seejärel annust tiitrida.
Farmakokineetiline. Astreonaami ja gentamütsiini samaaegsel kasutamisel linesoliidi farmakokineetika ei muutu.
Bakteritsiidsed makroliidid
Makroliidasoliidid - asitromütsiin(kõige vähem toksiline antibiootikum, toime grampositiivsete kokkide ja rakusiseste patogeenide vastu - klamüüdia, mükoplasma, kampülobakterid, legionellad).
Makroliid-ketoliidid - erütromütsiin-atsüstraat(kõrge aktiivsus enterokokkide vastu, sealhulgas nosokomiaalsed, vankomütsiiniresistentsed tüved, mükobakterid, bakteroidid).
Bakteriostaatilised makroliidid (laia toimespektriga ravimid, on pikk periood poolväärtusaeg, võib manustada 1-2 korda päevas, kasutatakse laialdaselt toksoplasmoosi ravis ja meningiidi profülaktikas, klamüüdia ja legionellavastane toime).
1. põlvkond erütromütsiin, oleandomütsiin.
2. põlvkond- spiromütsiin, roksitromütsiin, midekamütsiin, josamütsiin, diritromütsiin, klaritromütsiin, kitazamütsiin.
Makroliidide üldised omadused:
1. Peamiselt bakteriostaatiline toime.
2. Aktiivsus grampositiivsete kokkide (streptokokid, stafülokokid) ja rakusiseste patogeenide (mükoplasmad, klamüüdia, legionella) vastane.
3. Kõrged kontsentratsioonid kudedes (5-10-100 korda kõrgem kui plasma).
4. Madal toksilisus.
5. Puudumine ristallergiaβ-laktaamidega.
Makroliidide hulgas erilist tähelepanu väärib klaritromütsiin (klatsiid) kui ainuke uutest makroliididest, millel on intravenoosne manustamine. See asjaolu võimaldab seda kasutada tüsistusteta kogukonnas omandatud kopsupõletiku ravis või 2. rea ravimina haiglas omandatud kopsupõletiku ravis. Hiljutiste aruannete kohaselt väärib aga S. peutoniae resistentsuse probleem makroliidantibiootikumide suhtes üksikasjalikku käsitlemist. Pneumokokkide resistentsus makroliidide (nagu ka püogeensete streptokokkide) suhtes võib olla tingitud toime sihtmärgi ensümaatilisest muutmisest (ribosomaalse RNA metüülimine) või ravimite aktiivsest eemaldamisest mikroobirakust. Esimeses mehhanismis täheldatakse täielikku ristresistentsust kõigi makroliidide vahel; teises näitavad pneumokokid resistentsust 14- ja 15-liikmeliste makroliidide suhtes, olles samal ajal tundlikud 16-liikmeliste makroliidide suhtes. Kõigi Alexanderi projekti kaasatud makroliidide vahel täheldati täielikku ristresistentsust. Teine on praktiliselt oluline fakt on an seos penitsilliiniresistentsuse ja makroliidresistentsuse vahel. Seda tähelepanekut kinnitavad täielikult kõik pneumokokkide antibiootikumiresistentsuse uuringud. Murettekitav fakt on ka makroliidide suhtes resistentsuse pidev kasv (mõnes Euroopa riigis on resistentsus makroliidide suhtes kõrgem kui penitsilliini suhtes). Veelgi enam, resistentsuse suurenemine korreleerub kaasaegsete pikaajalise farmakokineetikaga makroliidide (asitromütsiin ja klaritromütsiin) tarbimise suurenemisega. Makroliidide puhul on traditsioonilised ja farmakodünaamiliselt kinnitatud tundlikkuse kriteeriumid samad. Seetõttu on põhjust eeldada, et neil antibiootikumidel on kõrge bakterioloogiline efektiivsus tundlike tüvede põhjustatud pneumokokkide infektsioonide korral. Olemasolevad kliinilised andmed on selle eeldusega täielikult kooskõlas. Samal ajal on lahendamata küsimus 14- ja 15-liikmeliste makroliidide kliinilisest efektiivsusest aktiivsest eritumisest tingitud resistentsusega pneumokokkide põhjustatud infektsioonide korral. Mitmed tähelepanekud näitavad, et selliste mikroorganismide põhjustatud kopsupõletiku korral säilib 14- ja 15-liikmeliste makroliidide kliiniline efektiivsus. Arutatakse ettepanekuid pneumokokkide tundlikkuse kriteeriumide ülevaatamiseks makroliidide suhtes (erütromütsiini MIC-i piirväärtuse suurendamine 1-lt 8-le või 16 μg / ml-le). Seega ei tähenda mikrobioloogiline resistentsus nii β-laktaamide kui ka makroliidide puhul alati ravi ebaõnnestumist.
Antibakteriaalsed ravimid - see on terve klastri ravimite nimi, millel on võime pärssida kahjulike mikroorganismide elusrakkude kasvu ja arengut või põhjustada nende surma. Seetõttu kasutatakse neid ravis põletikulised protsessid mis on põhjustatud bakteriaalsest mikrofloorast. Sellistel ravimitel on selektiivne toksilisus, mille puhul inimese rakud ei kahjustata.
Vastavalt toimele mikroorganismidele jagunevad ravimid kahte kategooriasse:
- bakteritsiidne toime. Sel juhul on häiritud rakumembraanide talitlus ja nende terviklikkus, mis põhjustab mikroorganismide surma. Sellise toimega ravimeid kasutatakse nakkushaiguste, nagu sepsis ja endokardiit, ravis, samuti patsientide ravis, kui organism on nõrgenenud ega suuda ohtliku infektsiooniga iseseisvalt võidelda.
- Bakteriostaatiline toime. Sellel põhimõttel põhinevad preparaadid häirivad valkude sünteesi ja selle tulemusena lakkab mikroorganismide areng ja kasv, kuid nende hävimist ei toimu. Nakkushaiguste ravis on ravimi selline toime koos immuunsussüsteem keha annab täielik taastumine haige.
Päritolu järgi jagunevad antibakteriaalsed ravimid kolme kategooriasse:
- juurvilja
- Loom
- mikroobne.
AT apteegid kõige sagedamini võite leida mikroobse päritoluga ravimeid. Siin on kõige populaarsemad:
- Tetratsükliin. Sellel on bakteriostaatiline toime. See on ette nähtud kurguvalu, bronhiidi ja kopsupõletiku korral. See aitab ka sooleinfektsioonide korral.
- Ampitsilliin. See on poolsünteetiline ravim, mis aitab sinusiidi, bronhiidi ja muude bakteriaalsete infektsioonide korral.
- Grammidiin. Seda kasutatakse laialdaselt neelu ja suuõõne haiguste - tonsilliit, tonsilliit ja teised - ravis.
- Lysobact. See on üsna universaalne ravim, mis on ette nähtud suu limaskesta, aga ka igemete ja kõri nakkushaiguste ennetamiseks ja raviks.
- Furatsiliin. Kõrgelt tõhus abinõu, mis aitab nahakahjustuste, konjunktiviidi, tonsilliidi, stomatiidi ja teiste nakkushaiguste korral.
Nende ja paljude teiste ravimite kohta on saidil palju kasutusjuhiseid, millel on kõik vajalikud selgitused.
Kuva kogu tekst