Tsiteerimiseks: Belousova T.A., Kayumova L.N., Goryachkina M.V. Süsteemsed antibiootikumid naha ja pehmete kudede bakteriaalsete infektsioonide ravis: keskenduge makroliididele // BC. 2011. nr 21. S. 1317
Epidemioloogia Bakteriaalsed infektsioonid naha, põhjustades selle mädapõletikku, tuvastas prantsuse teadlane H. Leloir 1891. aastal nakkuslike dermatooside rühmas püodermatiidi nime all (pyon - mäda, derma - nahk). Välismaal nimetatakse püodermat tavaliselt ulatuslikuks naha ja pehmete kudede infektsioonide rühmaks (SSTI), mis hõlmab lisaks naha ja selle adnexaalsete moodustiste infektsioonidele ka nahaaluse rasvkoe ja aluskudede infektsioone.
Naha bakteriaalsed infektsioonid, mis põhjustavad selle mädapõletikku, tuvastati nakkuslike dermatooside rühmas prantsuse teadlase H. Leloir poolt 1891. aastal püodermatiidi nime all (püon - mäda, derma - nahk). Välismaal nimetatakse püodermat tavaliselt ulatuslikuks naha ja pehmete kudede infektsioonide rühmaks (SSTI), mis hõlmab lisaks naha ja selle adnexaalsete moodustiste infektsioonidele ka nahaaluse rasvkoe ja aluskudede infektsioone.
Majanduslikult sisse arenenud riigid ICMT moodustavad 1/3 kõigist nakkushaigustest. Kodumaiste uuringute kohaselt moodustavad pustuloossed nahainfektsioonid tööealiste inimeste dermatoloogilisest patoloogiast 30–40%, sõjaväelastel ulatub see arv 60% -ni. Laste dermatoloogilises praktikas see patoloogia on üks sagedasemaid ja moodustab 30–50% kõigist arstikülastustest.
Etioloogia
ICMT peamine allikas on mikroorganismid, mis saastavad ja koloniseerivad nahapinda. Grampositiivsed kokid S. aureus ja S. Pyogenes, mis on võimelised tungima epidermise paksusesse selle kahjustuse korral, mängivad kahtlemata juhtivat rolli pustuloossete nahainfektsioonide etioloogias. Veelgi enam, S. aureus on kõige rohkem tavaline patogeen, S. pyogenes'e infektsioonid on mõnevõrra vähem levinud ja segainfektsioon mis hõlmavad mõlemat mikroorganismi. Välismaiste mitmekeskuseliste uuringute tulemuste kohaselt on lisaks S. aureusele S. pyogenes, Corynebacterium diphtheriae, P. aeruginosa, Enterobacteriaceae, Streptococcus spp. Väidetava patogeeni etioloogilise rolli määramisel on suur tähtsus infektsiooni tüübil (tabel 1). Erinevalt primaarsest püodermast on sekundaarsetel püodermadel, nagu enamikul nekrotiseerivatel ICMT infektsioonidel, polümikroobne etioloogia.
Nakkuse tekkes mängib olulist rolli mikroorganismi virulentsus ja bakteriaalse saastatuse määr. On näidatud, et nakkuse tekkimise tõenäosus on otseselt võrdeline mikroorganismi bakteriaalse saastumise ja virulentsuse astmega ning pöördvõrdeline mikroorganismi tugevusega. kaitsereaktsioon organism. Koloniseerimise tõenäosus suureneb allergiliste nahahaiguste esinemisel. Niisiis tuvastatakse atoopilise dermatiidiga patsientidel 90% juhtudest S. aureuse kahjustatud piirkondade koloniseerimine.
Patogenees
Selle või selle püoderma vormi esinemisel mängivad olulist rolli patogeeni tüüp, selle virulentsus, makroorganismi seisund, samuti mitmesugused endogeensed ja eksogeensed eelsoodumustegurid, mis vähendavad naha barjääri ja kaitsefunktsioone.
Stafülokokkide ja streptokokkide virulentsuse määravad mitmed patogeensed toksiinid ja ensüümid, mida nad eritavad (koagulaas, leukotsidiin, streptokinaas, hüaluronidaas, streptolüsiin, hemolüsiinid jne), mis hõlbustavad patogeenide tungimist nahka, põhjustavad kahjustusi ja koorumist. kõikidest epidermise kihtidest põhjustavad pärisnaha ja selle all olevate kudede hemolüüsi ja nekroosi, häirides nende normaalset ainevahetust.
ICMT tekkes ja arengus suur tähtsus omavad keha reaktsioonivõimet, selle resistentsuse mehhanisme mikroobide agressiooni suhtes. Immunokompetentse süsteemi puudulikkus on sel juhul reeglina sekundaarne (omandatud). See võib moodustuda premorbiidsel perioodil mineviku või kaasuva tausta tõttu rasked haigused. Haigused endokriinsüsteem(rasvumine, diabeet, hüpofüüsi-neerupealiste süsteemi, kilpnäärme, sugunäärmete ebapiisav aktiivsus) aitavad kaasa keha infektsioonivastase kaitse mehhanismide vähenemisele. Rohkem kui pooled kroonilise püodermaga patsientidest (52%) kuritarvitavad süsivesikuid (tavaliselt kergesti seeditavaid), mis põhjustab pankrease isolaarse aparatuuri pideva ülekoormuse ja võib kaasa aidata häirete tekkele. süsivesikute ainevahetus erineval määral süsivesikute kogunemine kudedesse, mis on püokokkidele soodsaks toitainekeskkonnaks. Märkimisväärne roll on ka naha seborroilisel seisundil. Sebumi hulga suurenemise ja selle muutumise tõttu keemiline koostis esineb naha steriliseerimisomaduste vähenemine ja püogeensete kokkide aktiveerumine.
Vähese tähtsusega pustuloossete nahahaiguste tekkes on kroonilised nakkushaigused erinevaid kehasid ja koed: periodontaalne haigus, kaaries, igemepõletik, tonsilliit, farüngiit, urogenitaaltrakti infektsioonid, düsbakterioos, soole mürgistus, mis vähendavad organismi üldist ja lokaalset antibakteriaalset resistentsust ning aitavad kaasa sellele järgneva spetsiifilise sensibilisatsiooni tekkele patsientidel, mis süvendavad kursust nakkusprotsess. Märkimisväärset rolli kroonilise püoderma kujunemisel mängivad kesk- ja vegetatiivsed haigused närvisüsteem, vaimne või füüsiline ülekoormus, "kurnavad haigused" - alkoholism, nälg, alatoitumus (valkude, vitamiinide, mineraalsoolad, hüpovitaminoos, eriti A ja C. A-vitamiin osaleb keratiini moodustumise protsessis, C-vitamiin reguleerib läbilaskvust veresoonte sein, on kortikosteroidide sünergist). Olulist rolli püoderma kujunemisel mängivad mitmesugused kaasasündinud või omandatud immuunpuudulikkusest tulenevad immuunpuudulikkuse seisundid (HIV-infektsioon, glükokortikosteroidide, tsütostaatikumide ja immunosupressantide võtmine). Raku antibakteriaalse kaitse defektid neutrofiilide fagotsüütilise aktiivsuse pärssimise, kemotaksise kahjustuse, samuti opsooniliste tegurite vähenemise näol vereseerumis ja immunoglobuliinides soodustavad kroonilist infektsiooni ja sagedasi retsidiive.
T-rakulise immuunsüsteemi rikkumised on ICMT patogeneesis ülimalt olulised. Immunoloogilise reaktiivsuse spetsiifiliste mehhanismide häired põhinevad T-lümfotsüütide arvu vähenemisel perifeerses veres, CD3 ja CD4 rakkude arvu vähenemisel ning nende suhete muutumisel monotsüütidega, mis viib nõrgenemiseni. T-raku immuunvastusest. Ebaõnnestumine immuunsussüsteem Patsiendi (immunoloogiline tasakaalustamatus) ja patogeeni antigeenne mimikri põhjustavad sageli kroonilist infektsiooni ja bakterikandja moodustumist ning antibiootikumide ebaratsionaalne kasutamine põhjustab patogeeni resistentsust.
Märkimisväärne tähtsus bakteriaalsete nahainfektsioonide tekkes on kahjulik mõju keskkond mis rikuvad terviklikkust nahka ja nakatumiseks "sissepääsuväravate" loomine. Need hõlmavad peamiselt kõrge või madala temperatuuri, kõrge õhuniiskuse mõju, mis põhjustab naha leotamist, suurenenud saastumist ja professionaalsete tegurite (õlid, tsement, söetolm) põhjustatud mikrotrauma. Nakatumise sissepääsuvärav tekib leibkonna mikrotraumade (lõiked, süstid), sügelevate dermatoosidega kriimustustega. Nahabarjääri rikkumine sarvkihi kuivuse ja hõrenemise näol aitab kaasa mikroorganismide tungimisele naha sügavatesse kihtidesse ja aluskudedesse, mis viib püoderma protsessi arenguni.
ICMT kliinilised sordid
ICMT-d on üsna arvukad ja heterogeensed kliiniline pilt rühm haigusi, mis põhjustavad erineva sügavuse, levimuse ja raskusastmega kahjustusi. Kõigile ühine, iseloomulik tunnus on kohaliku olemasolu mädane põletik, kell raske kurss millega kaasneb süsteemse väljatöötamine põletikuline reaktsioon. Kliinilised vormid sõltuvad tüübist etioloogiline tegur, anatoomiline lokaliseerimine, naha lisanditega suletus, kahjustuse sügavus ja pindala, protsessi kestus.
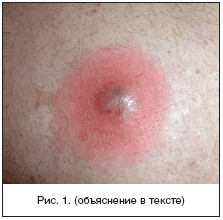
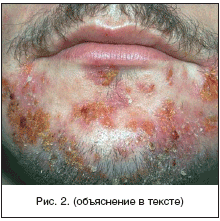
Kodumaises dermatoloogias aktsepteeritakse primaarse püoderma klassifikatsiooni, mille J. Jadasson pakkus välja juba 1934. aastal ja mis on ehitatud etioloogilisel põhimõttel. See eristab: stafüloderma, peamiselt mõjutades nahka lisandite ümber (rasulised juuksefolliiklid, higinäärmed); mõjutav streptoderma sile nahk valdavalt looduslike avade ja strepto-stafülokoki segainfektsioonide ümbruses. Igas kolmes rühmas eristatakse sõltuvalt kahjustuse sügavusest pindmised ja sügavad vormid. Enamgi veel, pustuloossed haigused nahk jaguneb primaarseks muutumatul nahal tekkivaks ja sekundaarseks, mis areneb tüsistustena juba olemasoleva dermatoosi taustal, tavaliselt sügelev (sügelised, ekseem, atoopiline dermatiit). Kursuse kestuse järgi eristatakse ägedat ja kroonilist püodermat. Stafülokoki püoderma on tavaliselt seotud naha lisanditega (juuksefolliiklid, apokriinnäärmed). Neid iseloomustab sügava pustuli moodustumine, mille keskele moodustub õõnsus, mis on täidetud mädane eksudaat. Perifeerias on erütematoosne-ödematoosne tsoon põletikuline nahk. Mädane protsess lõpeb armi moodustumisega (joonis 1). Streptokoki püoderma arenevad sagedamini siledale nahale, looduslike avade ümber (suuõõs, nina) ja algavad konfliktide tekkega - pindmiselt paiknev põis lõtv volditud rehviga, mille sees on seroosne-mädane sisu. Konflikti õhukesed seinad avanevad kiiresti ja sisu valgub naha pinnale, tõmbudes meekollasteks kihilisteks koorikuteks. Protsess kipub autoinkulatsiooni tulemusena levima piki perifeeriat (joonis 2). Mehed põevad sagedamini stafülodermat, naised ja lapsed streptodermat.
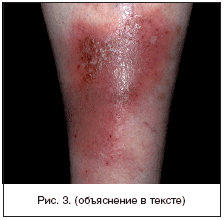
V väliskirjandus praktilisest vaatenurgast on kõik ICMTd jagatud kolme põhirühma: primaarne püoderma, mida valdavalt põhjustavad S. aureus ja püogeensed b-hemolüütilised streptokokid (peamiselt rühm A) ning arenevad muutumatul nahal (follikuliit, impetiigo, erüsiipel); sekundaarne püoderma, mis areneb nahakahjustuste või kaasneva somaatilise patoloogia taustal (näiteks lamatised, diabeetilised jalahaavandid, loomahammustuste järgsed infektsioonid, operatsioonijärgsed haavad ja traumajärgsed infektsioonid), samuti dermatooside taustal, millega kaasneb sügelus ja kriimustus (allergiline dermatiit, psoriaas, sügelised jne); nekrootilised infektsioonid, mis esindavad ICMT kõige raskemat vormi (polümikroobse etioloogiaga tselluliit – sünergiidne tselluliit, nekrotiseeriv fastsiit, münekroos – gaasigangreen) (joonis 3). Selle patoloogia puhul on kahjustuse sügavuse ja ulatuse kindlaksmääramine kirurgi prioriteet, sest ainult kirurgilise raviga saab kõige täpsemalt kindlaks teha nakkuse tõelise astme. Nende patsientide esialgne ravi on sama. See seisneb varases kirurgilises sekkumises ja piisava antimikroobse ravi määramises.
ICMT ravi
Bakteriaalsete nahainfektsioonidega patsientide ravi peab olema kompleksne (etiotroopne ja patogeneetiline) ning see tuleb läbi viia pärast põhjalikku anamnestilist, kliinilist ja kliinilist uurimist. laboratoorne uuring haige. Vajab tuvastada ja ravida kaasnevad haigused, fokaalse infektsiooni fookuste uurimine ja pikaajalise püsiva protsessi korral - immunostaadi uuringud. ICMT-ga patsientide etiotroopse ravi peamine ja ainus meetod on antibiootikumid. Ägedate pindmiste aeg-ajalt esinevate protsesside (impetiigo, follikuliit, paronühhia) korral võib ravi piirduda antibiootikumide ja antiseptikumide lokaalse kasutamisega. Kõigil muudel juhtudel süsteemne antibiootikumravi.
Süsteemse antibiootikumravi määramise näidustused on püoderma sügavad vormid: keeb (eriti lokaliseerimisega näol ja kaelal), karbunkel, hidradeniit, erüsiipel, tselluliit. Loetletud bakteriaalsete nahainfektsioonide vormidel on pikk, sageli krooniline retsidiveeruv kulg, protsessi kõrge levimus ja nendega kaasnevad sageli üldise mürgistuse sümptomid palaviku, peavalu, nõrkuse ja piirkondlike tüsistuste tekkega ( lümfadeniit, lümfangiit). Nagu etiotroopne aine antibiootikume kasutatakse bakteriaalse iseloomuga dermatoosi - Lyme'i tõve - ravis. Need on akne vulgarise ravis valitud ravimid. Dermatoveneroloogilises praktikas kasutatakse antibiootikume laialdaselt nii nakkuslike dermatooside kui ka sugulisel teel levivate infektsioonide (STI-de) põhjustatud haiguste raviks.
Enne antibakteriaalse ravimi väljakirjutamist on soovitav nakatada mäda, et määrata isoleeritud mikroorganismi tundlikkus. mitmesugused antibiootikumid ja vastavalt uuringu tulemustele määrake sobiv ravim. Kuid see ei ole alati teostatav, eriti kui esineb nakkusoht või selle tüsistused. Nagu analüüs näitab kaasaegne kirjandus ja oma kliiniline kogemus Tänapäeval kasutatakse naha bakteriaalsete infektsioonide ravis kõige sagedamini järgmisi antibiootikumide rühmi: 1. β-laktaamid: a) looduslik penitsilliin, selle durantsed vormid ja poolsünteetilised penitsilliinid; b) tsefalosporiinid (1-4 põlvkonda). 2. Makroliidid. 3. Tetratsükliinid. 4. Fluorokinoloonid.
V viimased aastad penitsilliini ja selle durantseid preparaate kasutatakse ICMT ravis harva, kuna valdav enamus püokoki tüvedest on omandanud võime toota ensüümi b-laktamaasi (penitsillinaasi), mis pärsib penitsilliini antibakteriaalset toimet. Lisaks on β-laktaamid ravimid, millel on kõrgsagedus allergilised reaktsioonid.
Tetratsükliine, aminoglükosiide kasutatakse praegu palju harvemini. See on seotud suur kogus nende antibiootikumide suhtes resistentsed mikroorganismitüved (mis tähendab nende madalat terapeutilist aktiivsust), samuti tõsiste kõrvalmõjud. Tuleb meeles pidada, et tetratsükliinid on vastunäidustatud rasedusele, lastele ja maksapuudulikkusega patsientidele.
Fluorokinoloone on ette nähtud peamiselt sugulisel teel levivate haiguste raviks, kuna kõrge tundlikkus nende jaoks urogenitaalsete infektsioonide patogeenid ja püoderma puhul kasutatakse ainult siis, kui teised antibiootikumide rühmad on ebaefektiivsed. Kesknärvisüsteemi haiguste, rasedate naiste, aga ka pediaatriliste haiguste korral on nende kasutusala piiratud - neid määratakse peamiselt tervislikel põhjustel. Arvesse tuleks võtta ka fluorokinoloonide valgustundlikkust suurendavat toimet ja sellega seotud ettevaatusabinõusid, eriti kevadel ja suvel.
Kaasaegne meditsiinipraktika seab teatud nõuded antibiootikumi valikule. Esiteks peab ravimil olema lai spekter antimikroobne toime ja minimaalselt väljendatud antibiootikumiresistentsus mikroobsete ainete suhtes, ei ole raske kõrvalmõjud, neil on minimaalne allergiliste reaktsioonide tekkerisk, patsiendile mugav kasutada (suukaudse vormi olemasolu, mugav annustamisrežiim) ja taskukohane. Lisaks on väga oluline, et antibiootikumil ei oleks kliiniliselt olulisi koostoimeid teiste antibiootikumidega ravimid. Praeguseks vastavad antibiootikumid - makroliidid - täielikult nendele nõuetele.
Klassifikatsioon ja mehhanismid
farmakoterapeutiline toime
makroliidid
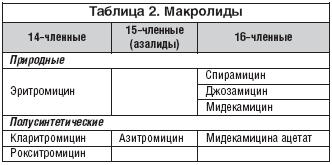
Makroliide on laialdaselt kasutatud üle 50 aasta kliiniline praktika. Esiteks looduslik antibiootikum sellest rühmast - erütromütsiin (Streptomyces erythreuse metaboliit) saadi 1952. aastal. Makroliide saab klassifitseerida nende keemilise struktuuri ja päritolu järgi. alus keemiline struktuur selle antibiootikumide klassi puhul on makrotsükliline laktoonitsükkel. Sõltuvalt süsinikuaatomite arvust tsüklis jagatakse makroliidid 14-, 15- ja 16-liikmelisteks (tabel 2).
Makroliide on 3 põlvkonda:
a) esimene põlvkond: erütromütsiin, oleandomütsiin;
b) teine põlvkond: spiramütsiin, roksitromütsiin, josamütsiin, klaritromütsiin jne;
c) kolmas põlvkond: asitromütsiin (Azitral).
Makroliidide antibakteriaalne toime põhineb mikroobirakkude ribosomaalsete valkude sünteesi katkemisel ja seeläbi patogeeni paljunemisprotsessi pärssimisel. Peamiselt on neil bakteriostaatiline toime, mistõttu on soovitav neid välja kirjutada põletiku ägedas faasis. Makroliide nimetatakse "koe antibiootikumideks", st. kehas levides kogunevad nad peamiselt mitte vereringesse, vaid nendesse elunditesse ja kudedesse, kus esineb põletik, tekitades seeläbi kõrged kontsentratsioonid ravim. Organismis hästi jaotunud makroliidid suudavad ületada histohematoloogilised barjäärid (välja arvatud hematoentsefaalbarjäär), ületades selles oluliselt β-laktaamantibiootikume. Kuid laialdane (ja sageli põhjendamatu) kasutamine tõi kiiresti kaasa erütromütsiini suhtes resistentsete patogeenide, eriti stafülokokkide tüvede suure protsendi. See omakorda vähendas oluliselt erütromütsiini kasutamist kliinilises praktikas.
Huvi makroliidide vastu tekkis taas 1980. aastate alguses, pärast seda, kui sellesse rühma ilmusid uued antibiootikumide põlvkonnad - asaliidid (eriti asitromütsiin). Asitromütsiin sünteesiti 1983. aastal erütromütsiinist. Oma farmakokineetiliste omaduste poolest ületas ravim kõiki oma eelkäija näitajaid ja sai esimeseks esindajaks. uus grupp antibiootikumid - asaliidid. Asitromütsiini ainulaadsus põhineb selle erakordsel farmakokineetikal. Asitromütsiin on stabiilne happeline keskkond tänu sellele imendub see pärast suukaudset manustamist hästi. Samaaegne tarbimine toiduga vähendab imendumist 50%, seega võetakse ravimit 1 tund enne või 2 tundi pärast sööki. Asitromütsiini molekuli lipofiilsus annab lisaks kõrge tase imendumine soolestikus ja ka ravimi suurepärane tungimine kudedesse. Samuti on tagatud asitromütsiini kiire tungimine verest kudedesse madal tase asitromütsiini seondumine verevalkudega, mis võimaldab saavutada kiiret ravitoimet infektsioonide korral, mis mõjutavad rakke ja kudesid. Ravimi kõrge kontsentratsioon kahjustatud piirkonnas, mis on 10-100 korda kõrgem kui kontsentratsioon vereringes, võimaldab teil aktiivselt mõjutada patogeenset fookust, tagades seeläbi kiire kliinilise toime ja kiiret paranemist. Kaasaegsed makroliidid (eriti asitromütsiin) on kõige tõhusamad selliste patogeenide nagu S. pyogenus, S. aureus, S. pneumoniae, mõnede gramnegatiivsete mikroorganismide (gonokokkide) ja ka rakusiseste patogeenide (eelkõige Chlamidia trachomatis ja Ureaplas) vastu. ma urealyticum), mis määrab nende suure nõudluse dermatoveneroloogilises praktikas.
Tähtsus Teise põlvkonna makroliidide antibakteriaalsel toimel on nende koostoime neutrofiilidega. Tänu oma võimele tungida neutrofiilidesse ja tekitada neis kõrgeid kontsentratsioone, muudavad paljud makroliidid positiivselt nende rakkude funktsioone, mõjutades eelkõige kemotaksist, fagotsütoosi ja tapmisaktiivsust. Sama hästi kui antimikroobne toime neil antibiootikumidel on mõõdukas põletikuvastane toime. Aktiveerides makrofaagide seeria rakke, suudavad nad neisse tungida ja kui fagotsüütrakud migreeruvad põletikukoldesse, sisenevad sinna koos nendega. Nende ravimite ainulaadsus seisneb ka selles, et neil on väljendunud antibiootikumijärgne toime, see tähendab, et nad säilitavad kõrge kontsentratsiooni põletikukoldes 5-7 päeva pärast ärajätmist. See sanogeneetiline toime võimaldas välja töötada lühikesed ravikuurid, mis ei ületa 3-5 päeva, ja mugava annustamisskeemi (1 kord päevas). See omakorda tagab ravile vastavuse ja parandab patsiendi elukvaliteeti. Asitromütsiini postbiootiline toime on kõige tugevam, mis võimaldab nii ägedate kui ka krooniliste infektsioonide ravis tekitada infektsioonikoldes antibiootikumi kontsentratsiooni, mis ületab mitu korda MIC-i aktiivsete patogeenide suhtes. V Hiljuti tõendeid asitromütsiini immunomoduleeriva toime kohta saadi tervetel vabatahtlikel tehtud katses. Immunomoduleeriva toime esimene faas seisneb neutrofiilide degranulatsioonis ja oksüdatiivses plahvatuses, mis aitas kaasa kaitsemehhanismide aktiveerimisele. Patogeenide likvideerimiseni jõudmisel vähenes IL-8 tootmine ja neutrofiilide apoptoosi stimuleerimine, mis minimeeris põletikulise vastuse raskust.
Makroliidid, nii looduslikud kui ka poolsünteetilised, avaldavad minimaalset mõju normaalne mikrofloora Inimkeha ja ei põhjusta düsbioosi. Seetõttu peetakse asitromütsiini mitte ainult väga tõhusaks, vaid ka kõige tõhusamaks ohutu antibiootikum minimaalse arvu vastunäidustustega kohtumisel. Kõrvaltoimed tervikuna võttes on need äärmiselt haruldased ja ei ületa 5%. Kõige sagedasemad kõrvaltoimed on kõrvaltoimed seedetrakti(iiveldus, raskustunne epigastimaalses piirkonnas), mis reeglina on mõõdukad, ei nõua ravimi ärajätmist ja mööduvad pärast sööki ravimite võtmisel kiiresti.
Asitromütsiini kliiniline efektiivsus
Nagu näitavad võrdlevad uuringud, on ICMT-s kasutatud antibiootikumide hulgas ambulatoorne praktika, uue põlvkonna kõige tõhusamad makroliidid, peamiselt 15- ja 16-liikmelised (asitromütsiin, josamütsiin, roksitromütsiin). Meil on juba kogunenud 20 aastat positiivset kogemust asitromütsiini kasutamisest kodumaises dermatoveneroloogilises praktikas. Dermatoloogias on need stafülokokkide ja streptokokkide naha ja pehmete kudede kahjustuste (furunkel, impetiigo, tselluliit) põhiraviks ning venereoloogilises praktikas - STI-de ravis. Erinevalt enamikust makroliididest ei ole asitromütsiinil kliiniliselt olulisi ravimite koostoimeid. See ei seondu tsütokroom P450 kompleksi ensüümidega, mistõttu see ei reageeri ravimite koostoime seda rada mööda metaboliseeruvate ravimitega. See omadus on oluline, sest reaalses kliinilises praktikas on enamikul ICMT-ga haigetel tausta- või kaasuvad haigused, mille puhul nad saavad asjakohast ravi. Samuti tuleb rõhutada, et koos hea tolerantsuse ja väljendunud puudumisega kõrvaltoimed makroliididel (asitromütsiinil) on teiste antibiootikumide rühmade ees veel üks kindel eelis - see on see, et seda saab määrata rasedatele ja lastele.
Praegu on kliinilises praktikas üks enim kasutatavaid ravimeid ravim Azitral (asitromütsiin), mida toodab ravimifirma Shreya bioteadused. Azitraal (asitromütsiin) sarnaneb algse asitromütsiiniga, mis on asaliidide alarühma esimene esindaja ICMT ja urogenitaalsete infektsioonide ravis kasutatavate makroliidantibiootikumide rühmast. Uuringud on näidanud, et ravimi kliiniline efektiivsus, manustatuna ühekordse annusena 500 mg 3 päeva jooksul, on võrreldav enamkasutatavate ravimite omaga. antibakteriaalsed ained. See võimaldab vähendada tavalist antibiootikumravi kulgu 2-3 korda ja Azitrali ainulaadne farmakokineetiline profiil tagab ühekordse ravi. päevane tarbimine ja kõrge vastavus ravile.
Farmakokineetika iseärasuste ja omapärase antimikroobse toimespektri tõttu, mis hõlmab peamisi kuseteede infektsioonide patogeene, on asitromütsiin esmavaliku ravim kaasuvate STI-de, sealhulgas kroonilise tüsistunud urogenitaalse klamüüdia ja PID ravis. mitterasedad naised, ja alternatiivne abinõu selle haiguse raviks raseduse ajal. 1 g asitromütsiini (Azitral) ühekordse annuse korral ületab selle kontsentratsioon nädala jooksul eesnäärme ja emaka kudedes C. trachomatise MIC (0,125 μg / ml) 42,5 korda ja emakakaela kanal- 12 korda, mis on terapeutiline kontsentratsioon selle infektsiooni raviks. Veelgi enam, isegi 2 nädala pärast ületab asitromütsiini terapeutiline kontsentratsioon eesnäärmekoes C. trachomatise MIC-i 13,6 korda. Autorid tõestasid, et just sellise sissevõtmisega kudedes, kus C. trachomatis vegeteerub, säilib ravimi kõrge terapeutiline kontsentratsioon 6-8 arengutsükli jooksul. Saadud andmed viitavad Azitrali pulssteraapia kõrgele efektiivsusele (1 g üks kord nädalas, kuuri annus 3 g). v kompleksne ravi krooniline klamüüdia uretroprostatiit ja sellega seotud mükoureaplasma ja gardnerella infektsioon. Oluline on märkida, et Azitral on patsientidele hästi talutav, taskukohane ja seetõttu saab seda laialdaselt kasutada tüsistunud urogenitaalse klamüüdia ja PID ravis.
Asitromütsiini efektiivsuse, ohutuse ja talutavuse uurimine 30 lapsel vanuses 6 kuud kuni 3 aastat stafülokoki infektsioonid erinev lokaliseerimine ENT organid ja nahk näitasid, et asitromütsiin (Azitral) ei ole efektiivsuselt madalam kui antistafülokoki penitsilliinid. Sama hästi kui kõrge efektiivsusega, mida iseloomustab peamise kiire ja püsiv pöörddünaamika kliinilised sümptomid ja kohalik põletikulised muutused 100% juhtudest oli ravim hästi talutav ja puudus kõrvalmõjud kõigil lastel. Lai valik antimikroobset aktiivsust, farmakokineetilised omadused, kõrvalnähtude väike protsent ja mitmed eelised teiste makroliidide ees määravad ravimi kasutamise prioriteedi mitmesugustes nahainfektsiooniprotsessides (impetiigo, furunkuloos, follikuliit, tselluliit, paronühhia) lastel. Asitromütsiini efektiivsus pediaatriline praktika, tõestatud Kliinilistes uuringutes, võimaldab meil seda soovitada alternatiivina b-laktaamantibiootikumidele ja lastele, kellel on raske allergiline ajalugu - valikravimina.
Üks olulisemaid farmakoökonoomilisi näitajaid, mis määrab antibiootikumi valiku, on kulu/efektiivsuse suhe. Seda määratletakse kulude suhtena uimastiravi(suukaudsete ravimite puhul võrdub see kursuse annuse maksumusega) edukalt ravitud patsientide osakaalu. Tuleb märkida, et Azitral on üks olemasolevad ravimid asitromütsiin näitab optimaalset hinna ja kvaliteedi suhet.
On teada, et antibiootikumravi ebaefektiivsuse määrab suuresti tundlikkuse vähenemine kasutatava ravimi suhtes. Praegu puudub asitromütsiini suhtes kliiniliselt oluline resistentsus. Antibiootikumiresistentsuse, asitromütsiini ja teiste makroliidide suhtes resistentsuse jälgimise järgi uusim põlvkond patogeenide hulgas ei ületa ICMT 2-10%. Venemaal isoleeritud S. pyogenes'e tüvede tundlikkus antibiootikumi asitromütsiini suhtes on 92%. Nagu on näidanud mitmed uuringud, on asitromütsiini kliiniline efektiivsus suurem kui tetratsükliinidel ja b-laktaamantibiootikumidel. Kliiniline ja mikrobioloogiline võrdlev uuring 5-päevase asitromütsiini ja 10-päevase tsefaleksiini kuuri efektiivsuse kohta sügava stafülodermia korral näitas makroliidi kõrgemat terapeutilist aktiivsust. Patogeeni likvideerimist asitromütsiini kasutamisega täheldati 94%, tsefaleksiiniga 90% juhtudest, kliinilist paranemist - vastavalt 56 ja 53% juhtudest. Samal ajal ei ületa kõrvaltoimete sagedus, mis tavaliselt ei nõua ravimi kasutamise katkestamist, 5%, mis on oluliselt madalam võrreldes erütromütsiini (kuni 14%) või b-laktaamide suukaudsete vormidega.
Seega on asitromütsiinil lai antimikroobse toime spekter, kõrge bakteriostaatiline toime selle suhtes tundlike infektsioonide vastu, kõrge biosaadavus koos selektiivse toimega põletikukoldes, sellel on madal toksilisus, minimaalsed kõrvaltoimed ja mugav manustamisviis. Seetõttu vastutab ravim kaasaegsed nõuded ratsionaalne antibiootikumravi ja seda võib soovitada tõhus rakendus dermatoveneroloogilises praktikas.
Kirjandus
1. Jones M.E., Karlowsky J.A., Draghi D.C, Thornsberry C., Sahm D.F., Nathwani D. Epidemioloogia ja tundlikkus antibiootikumide suhtes Naha ja pehmete kudede infektsioone põhjustavate bakterite kohta USA-s ja Euroopas: sobiva antimikroobse ravi juhend. Int J Antimicrob Agent 2003; 22:406-19.
2. N.N. Muraškin, M.N. Gluzmina, L.S. Galustyan. Pustuloossed nahakahjustused praktikas laste dermatoloog: uus pilk vanale probleemile. RZhKVB: Teaduslik ja praktiline ajakiri, 2008, nr 4, lk. 67-71.
3. Belkova Yu.A. Püoderma ambulatoorses praktikas. Haigused ja patogeenid. Kliiniline mikrobioloogia ja antimikroobne keemiaravi: nr 3, 7. köide, lk. 255-270, 2005.
4. T.A. Belousova, M.V. Gorjatškin. Bakteriaalsed nahainfektsioonid: optimaalse antibiootikumi valimise probleem. RMJ 2005, 13. köide, nr 16, lk. 1086-1089.
5. Takha T.V., Nazhmutdinova D.K. Püoderma antibiootikumiravi ratsionaalne valik. RMJ 2008, 16. köide, nr 8, lk. 552-555.
6. Novoselov V.S., Plieva L.R. Püoderma. RMJ 2004, 12. köide, nr 5, lk. 327-335.
7. Masjukova S.A., Gladko V.V., Ustinov M.V., Vladimirova E.V., Tarasenko G.N., Sorokina E.V. Bakteriaalsed nahainfektsioonid ja nende tähendus dermatoloogi kliinilises praktikas. Consilium medicum 2004, 6. köide, nr 3, lk. 180-185.
8. T.Fail. Naha ja pehmete kudede infektsioonide diagnoosimine ja antimikroobne ravi. Ohio, USA. Kliiniline mikrobioloogia ja antimikroobne keemiaravi: nr 2, 5. köide, lk. 119-125, 2003
9. Shlyapnikov S.A., Fedorova V.V. Makroliidide kasutamine naha ja pehmete kudede kirurgiliste infektsioonide korral. GRM, 2004.-kd.12, nr 4, s204-207
10. Guchev I.A., Sidorenko S.V., Frantsuzov V.N. Ratsionaalne antimikroobne kemoteraapia naha ja pehmete kudede infektsioonide korral. Antibiootikumid ja keemiaravi. 2003, v.48, 10, lk 25-31
11. Parsad D., Pandhi R., Dogras S. Juhend makroliidide valikuks ja sobivaks kasutamiseks nahainfektsiooni korral Am J Clin Dermatol 2003; 4:389-97
12. Jakovlev S.V., Ukhtin S.A. Asitromütsiin: põhiomadused, manustamisrežiimide optimeerimine farmakokineetika ja parameetrite põhjal. Antibiootikumid ja keemiaravi. 2003 v. 48, nr 2. - Koos. 22-27
13. Turovsky A.B., Kolbanova I.G. Makroliidid infektsioonide ravis hingamisteed kõrva-nina-kurguarsti seisukohast: “poolt” ja “vastu” Consilium medicum, 2010, nr 4, köide 12, lk 11-14.
14. Prokhorovich E.A. Asitromütsiin. Alates kliiniline farmakoloogia kliinilisse praktikasse. RMJ 2006, 14. köide, nr 7, lk. 567-572
15. Berdnikova N.G. Asitromütsiini (Azitral) ravis kasutamise praegused aspektid kogukonnas omandatud kopsupõletik täiskasvanutel. RMJ 2006, 14. köide, nr 22, lk. 1625-1628.
16. Hrjanin A.A., Reshetnikov O.V. Makroliidid klamüüdiainfektsiooni ravis rasedatel naistel (tõhusus, ohutus, tasuvus). RMJ 2008, 16. köide, nr 1, lk. 23-27.
17. Serov V.N., Dubnitskaja L.V., Tjutjunnik V.L. Põletikulised haigused vaagnaelundid: diagnostilised kriteeriumid ja ravi põhimõtted. RMJ 2011, 19. köide, nr 1, lk. 46-50.
18. Talašova S.V. Mõned rakenduse aspektid antibakteriaalsed ravimid pediaatrias makroliidide näitel. RMJ 2009, 17. köide, nr 7, lk. 464-466
19. Mazankova L.N., Iljina N.O. Asaliidide koht pediaatrilises praktikas. RMJ 2008, 16. köide, nr 3, lk. 121-125.
20. Solovjov A.M., Pozdnjakov O.L., Tereštšenko A.V. Miks peetakse asitromütsiini urogenitaalse klamüüdiainfektsiooni raviks valitud ravimiks. RMJ 2006, 14. köide, nr 15, lk. 1160-1164.
21. Gurov A.V., Izotova G.N., Juškina M.A. Ravimi Azitrali kasutamise võimalused ülemiste hingamisteede mäda-põletikuliste haiguste ravis. RMJ 2011, 19. köide, nr 6, lk. 405.
22. Klani R. Asitromütsiini ja tsefaleksiini topeltpime topeltnäiv võrdlus naha ja nahastruktuuri infektsioonide ravis. Eur.J. Clin. mikrobiol. Infect.Dis. 1999 okt. 10 (10) – lk 880-84
Neid kasutatakse laialdaselt nahahaiguste ravis. Nende toimemehhanism on keeruline, see sõltub ravimi keemilisest struktuurist ja selle rühma olemusest, kuhu see kuulub.
Enamik praegu kasutusel olevatest antibiootikumidest on poolsünteetilised või täissünteetilised ühendid, mis on mõnikord oluliselt aktiivsemad kui nende looduslikud analoogid. Antibiootikumid on aktiivsed peamiselt paljunevate bakterite vastu.
Suhteliselt kiiresti pärast antibiootikumide kasutuselevõttu praktikas hakkasid mikroorganismides ilmuma teated nende suhtes resistentsuse tekkimise juhtudest. Sel põhjusel tehti ettepanek kasutada praktiline töö antibiogrammid, st tundlikkuse määramine erinevad antibiootikumid patsientidelt eraldatud mikroorganismide tüved.
Samas leiti, et vaatamata patogeenide in vitro resistentsusele antibiootikumide suhtes on mõnikord võimalik nakkusprotsessi ravida. Antibiootikumidel on muidugi mittespetsiifiline toime. Ilmselt on see nende terapeutilise efektiivsuse üks põhjusi juhtudel, kui patogeenid on resistentsed see antibiootikum. Lisaks on võimatu täielikult kindlaks teha mikroorganismide suhtumist antibiootikumidesse in vitro ja in vivo.
Kõigi antibiootikumide rühmade esindajad on leidnud rakenduse dermatoloogilises praktikas. Alguses kasutati püoderma ravis kõige sagedamini antibiootikume. Siis aga selgus, et nende kasutusala dermatoloogias on palju laiem. Antibiootikumide väga laialdane kasutamine ei ole aga kaasa toonud mitte ainult tekkimist resistentsed tüved mikroorganismide, vaid ka kõrvaltoimete, enamasti allergilise iseloomuga, olulise suurenemiseni.
Penitsilliini rühm. Penitsilliin on aktiivne raviaine paljude nahahaiguste, eelkõige enamiku nahahaiguste korral kliinilised vormid nii stafülokoki kui streptokoki päritolu püoderma, sh epideemiline pemfigus vastsündinutel, vastsündinute eksfoliatiivne dermatiit, erüsiipel. See on efektiivne ka siberi katk, Simanovsky-Plaut-Vincenti stenokardia, krooniline migransi erüteem jne. Lisaks on penitsilliinil kasulik terapeutiline toime kroonilise atroofilise akrodermatiidi, lümfotsütoomi, impetiigo herpetiformis jne korral. Penitsilliini kasutatakse sageli kompleksne teraapia ja mitmed muud haigused - äge ja alaäge erütematoosluupus, difuusne ja piiratud sklerodermia, punane lichen planus ja teised.Penitsilliini kasutatakse ka juhtudel, kui mitmesugused nahahaigused komplitseeritud püokoki infektsiooniga. Seda täheldatakse sageli ekseemi, sügeluse, herpetiformne dermatiit ja jne.
Beisilpenitsilliini kaalium või naatriumsool manustatakse intramuskulaarselt 250 000-500 000 RÜ iga 3-4 tunni järel või 300 000-500 000 RÜ 2 korda päevas. Lahustina on parem kasutada 1–2 ml 0,5% novokaiini lahust. Penitsilliini ravikuuri annus määratakse sõltuvalt patsiendi vanusest, haiguse olemusest ja raskusastmest ning, mis kõige tähtsam, antibiootikumi terapeutilise efektiivsuse astmest igal üksikjuhul.
Võite kasutada ka novoksiini, mis on bensüülnenitsilliini novokaiini soola suspensioon isotoonilises naatriumkloriidi lahuses. Novocini manustatakse intramuskulaarselt 300 000 RÜ 3-4 korda päevas.
Nahahaiguste ravis kasutatakse palju harvemini fenoksümetüllenitsilliini ja bitsilliini.
Poolsünteetilised penitsilliinid on väga tõhusad stafülokokkide ja streptokokkide põhjustatud nakkuslike dermatooside korral, samuti juhtudel, kui viimased raskendavad mitteinfektsioossete dermatooside kulgu. Spektri järgi antibakteriaalne toime poolsünteetilised penitsilliinid on sarnased bensüülpenitsilliiniga, kuid need on tõhusad penitsilliini suhtes resistentsete mikroorganismide tüvede vastu, mis on seotud nende resistentsusega penitsillinaasi suhtes.
Oksatsilliin imendub seedetraktist hästi ja jääb aktiivseks mao happelises keskkonnas, seetõttu määratakse seda mitte ainult intramuskulaarselt, vaid ka tund enne sööki või 2-3 tundi pärast sööki, 0,25-0,5 g iga 4-6 tunni järel. Ravi kestus varieerub 7 kuni 20 päeva. Oksatsilliin, nagu ka metitsilliin, on väga efektiivne furunkuloosi ja vulgaarse sükoosi korral, ületades efektiivsuse poolest erütromütsiini ja oleandomütsiini.
Ampitsilliin võtta suu kaudu, olenemata söömise ajast, 0,5 g 4-6 korda päevas. Kuna ampitsilliin mõjutab ka mitmeid gramnegatiivseid mikroobe, peetakse seda antibiootikumiks. lai valik toimingud.
Kui võrrelda ravi tulemusi vinnid oksatsilliin ja ampitsilliin näitasid oksatsilliini mõningaid eeliseid. Ampiox, mis on ampitsilliini ja oksatsilliini kombinatsioon vahekorras 2:1, omab stafülokoki dermatoosi korral head ravitoimet, kuna ravim on oksatsilliini sisalduse tõttu aktiivne penitsillinaasi moodustavate stafülokokkide vastu.
Penitsilliini rühma ravimid võivad põhjustada mitmesuguseid kõrvaltoimeid. Kõige tavalisemad on allergilised nahalööbed- urtikaaria, leetrite, sarlakite, punetiste jms lööve. Nende ravimite paiksel kasutamisel tekivad sageli allergilised reaktsioonid kontaktdermatiit, mis mõnikord esinevad ka penitsilliinilahuseid valmistavatel inimestel. Võib esineda penitsilliinist põhjustatud fikseeritud lööbeid. Samuti on vaja meeles pidada esinemise tõttu nahalööbete võimalust ülitundlikkus mitte penitsilliinile, vaid lahustitele.
Penitsilliin ei pruugi mitte ainult põhjustada sensibiliseerimist, vaid olla ka sekundaarsete häirete teket lahendav tegur nahareaktsioonid seen- ja püodermahaigustega. Eriti sageli täheldatakse penitsilliini löövet jalgade epidermofütoosiga patsientidel. Isikutele, kes on altid allergilised reaktsioonid, eriti neil, kellel esineb perioodiliselt urtikaariat, Quincke turset, krampe bronhiaalastma jne, tuleb ravi penitsilliiniga läbi viia äärmise ettevaatusega. Kell pikaajaline ravi penitsilliin ja mõned teised antibiootikumid võivad tekitada kandidoos.
Esinemise korral allergilised lööbed penitsilliiniga ravimisel tuleb selle manustamine täielikult lõpetada, määrata üks antihistamiinikumidest, kaltsiumkloriid ja kortikosteroidravim.
Penitsilliinist põhjustatud raskete allergiliste ja toksiliste nähtuste korral on viimasel ajal kasutatud spetsiifilist ensüümi - penitsillinaas, mis hävitab penitsilliini, mille tagajärjel kaotab see oma antigeensed ja allergeensed omadused. Esinemise korral anafülaktiline šokk epinefriini ja intravenoosseid kortikosteroide tuleb manustada kohe. Kell pikaajaline kasutamine pentsilliin sees suured annused soovitav on samaaegselt määrata B1 ja B2, samuti kaltsiumkloriid.
Tsefalosporiinide rühm. Dermatoloogilises praktikas kasutatakse tsefaloridiini, tsefasoliini ja tsefaleksiini. Nendel ravimitel on bakteritsiidne toime grampositiivsetele ja gramnegatiivsetele kokkide mikroorganismidele, sealhulgas penitsilliiniresistentsetele streptokokkidele, samuti siberi katkule. Sel juhul manustatakse tsefaloridiini intramuskulaarselt annuses 20-30 mg/kg päevas 2-3 annusena. Ravimit võib kasutada, kui patsient on penitsilliini suhtes allergiline. Tsefaleksiin on aktiivne teist tüüpi antibiootikumide suhtes resistentse grampositiivse taimestiku vastu, seda määratakse 500 mg iga 12 tunni järel 7-14 päeva jooksul.
Tetratsükliinid- laia toimespektriga antibiootikumid Toimivad grampositiivsete ja gramnegatiivsete bakterite, treponema, riketsia, klamüüdia vastu ning mõjuvad nõrgalt happekindlatele bakteritele. Nende antibakteriaalne toime põhineb mikroobirakkude valkude biosünteesi pärssimisel ribosoomide tasemel. Samal ajal on ühe tetratsükliini suhtes resistentsed mikroorganismid resistentsed ka teiste selle rühma ravimite suhtes. Tuleb meeles pidada, et tetratsükliinid moodustavad kaltsiumi, raua ja teiste ioonidega raskesti lahustuvaid komplekse. raskemetallid seetõttu ei tohi tetratsükliinravi ajal piimatooteid tarbida. Tetratsükliine ei soovitata kasutada raseduse ajal ja alla 8-aastastel lastel, kuna on võimalik tetratsükliini lahustumatute komplekside moodustumine kaltsiumiga ja nende ladestumine luudesse, samuti hammaste emaili ja dentiini.
Dermatoloogias kasutatakse selle rühma ravimitest sagedamini tetratsükliini. Tetratsükliin on näidustatud samade seisundite korral nagu penitsilliin. Kandidaasi tekke vältimiseks on soovitatav seda kasutada koos nüstatiiniga. Tetratsükliin on end akne ravis tõestanud. Kirjutame selle välja aknega patsientidele pikk periood, samas kui esimese 20 päeva jooksul 1 000 000 RÜ päevas ja seejärel 10 päeva jooksul 800 000 RÜ / päevas. Tetratsükliini efektiivsuse kohta süsteemse sklerodermia korral on eraldi teateid.
Tuleb märkida tetratsükliinide, eriti doksütsükliinvesinikkloriidi, efektiivsust klamüüdiainfektsioonist põhjustatud Reiteri sündroomiga patsientidel. Doksütsükliinvesinikkloriid, samuti metatsükliinvesinikkloriid ja kloortetratsükliinvesinikkloriid on mõnikord tõhusad aktinomükoosi, vöötohatise, akne ja raske multiformse haiguse korral. eksudatiivne erüteem ja teised.Doksütsükliinvesinikkloriidil on väljendunud tegevus, eriti kombinatsioonis levamisooliga, naha leishmaniaasiga patsientidel. Ravimite annused ja ravi kestus sõltuvad haiguse olemusest, ravi talutavusest, samuti nende ravitoime raskusastmest.
Pindmise püoderma korral kasutatakse laialdaselt tetratsükliine sisaldavaid salve ja aerosoole, samuti tetratsükliine ja kortikosteroide. Tetratsükliinide kasutamisel tekkivatest kõrvaltoimetest tuleb märkida fikseeritud ravimist põhjustatud erüteem, lihhenoidne reaktsioon, kandidoos, düspeptilised sümptomid jne. Pikaajalise tetratsükliinravi korral peaksid patsiendid võtma nüstatiini, vitamiine B1 ja B2.
streptomütsiini rühm. Sellesse rühma kuuluvad mitmed ravimid, millest peamine on streptomütsiinsulfaat. Seda manustatakse intramuskulaarselt. Süstelahus valmistatakse vahetult enne manustamist kiirusega 1 000 000 RÜ 2–5 ml steriilse isotoonilise naatriumkloriidi lahuse, süstevee või 0,25–0,5% novokaiinilahuse kohta. Ravimi ööpäevane annus on 0,5-1 g.Selle manustamise kestus sõltub haiguse vormist ja raskusastmest.
Streptomütsiinil on tugev toime mõnedele gramnegatiivsetele ja grampositiivsetele bakteritele, samuti happekindlatele bakteritele ja treponeemile. Kõrgeim väärtus meditsiinipraktikas avaldab see streptomütsiini mõju Mycobacterium tuberculosis'ele ja Pseudomonas aeruginosale.
Dermatoloogias kasutatakse streptomütsiini intramuskulaarselt ja paikselt. See osutus tõhusaks parenteraalsel kasutamisel tuberkuloossete nahahaiguste, peamiselt tuberkuloosse luupuse, naha kollikatiivse ja induratiivse tuberkuloosiga patsientidel. Märgitud väga toredaid tulemusi streptomütsiini lahuse sisseviimisega kahjustustesse ja fistuloossetesse käikudesse. Mõnede ägeda erütematoosluupusega patsientide kliinilist paranemist on täheldatud pärast korduvat ravi parenteraalne kasutamine streptomütsiin.
Streptomütsiin võib põhjustada kõrvaltoimeid. Enamik tõsine komplikatsioon on toksiline toime kuulmisnärv, mis võib kaasa tuua suurema või väiksema kurtuse. Selle tüsistuse tekkimise tõenäosus on otseselt võrdeline patsiendile manustatud streptomütsiini koguannusega. Lisaks võib streptomütsiin põhjustada toksidermiat ja kontakti allergiline dermatiit kuna ta on ilus tugev allergeen. Sellega seoses soovitatakse streptomütsiini lahuse valmistamisega seotud isikutel töötada kummikinnastega.
Aminoglükosiidide antibiootikumid. Selle rühma antibiootikumid on struktuurilt sarnased streptomütsiiniga. Nende toimespekter on lai, neil on bakteritsiidne toime, eriti gramnegatiivsetele bakteritele. Nende antibiootikumide hulka kuuluvad neomütsiinsulfaat, monomütsiin, kanamütsiin, gentamütsiinsulfaat.
Neomütsiinsulfaati kasutatakse dermatoloogias peamiselt lokaalselt; see lisatakse kortikosteroide sisaldavate salvide, kreemide, aerosoolide koostisesse. Tuleb märkida, et neomütsiin on stafülokokkide vastu väga efektiivne ja streptokokkide suhtes inaktiivne, seetõttu on neomütsiini sisaldavate väliste ainete kasutamine näidustatud pindmiste stafülokoki nahahaiguste, samuti sügeluse ja allergiliste dermatooside korral, mida põhjustab stafülokokkinfektsioon.
Monomütsiini kasutatakse dermatoloogilises praktikas peamiselt naha leishmaniaasi raviks. Ravimit võetakse suu kaudu annuses 0,25 g 4-6 korda päevas, samal ajal määratakse väliselt 2-3% monomütsiini salvi. Intramuskulaarselt manustatakse monomütsiini annuses 0,25 g 3 korda päevas. Ma kasutan seda 10-12 päeva. Sarnaselt teistele selle rühma antibiootikumidele on monomütsiinil nefrotoksiline toime, seega ravi naha leishmaniaas monomütsium viiakse läbi patsiendi uriini seisundi kontrolli all.
Dermatoloogias kasutatakse kanamütsiini naha tuberkuloosi raviks, eriti kui Mycobacterium tuberculosis on streptomütsiini suhtes resistentne.
Gentamütsiinsulfaat mõjub grampositiivsele ja eriti gramnegatiivsele taimestikule. Dermatoloogilises praktikas kasutatakse seda paikselt püoderma korral 0,1% salvi kujul.
Nagu streptomütsiini rühma ravimid, on aminoglükosiidide antibiootikumidel väljendunud ototoksiline toime, mistõttu nende ravimite kontrollimatu kasutamine võib põhjustada kuulmislangust.
makroliidantibiootikumid. Sellesse rühma kuulub erütromütsiin, mis on oma toimespektri poolest lähedane penitsilliinile. Omades väljendunud mõju grampositiivsele taimestikule, omab see vähe või üldse mitte mõju gramnegatiivsetele bakteritele. Ravim on hästi talutav, sealhulgas patsientidel, kes kannatavad allergilised haigused ja penitsilliini talumatuse korral. Näidustused selle kasutamiseks on stafülokoki nahahaigused. Erütromütsiini manustatakse suu kaudu 0,25 g 3-4 korda päevas, samuti paikselt erütromütsiini salvi kujul.
Viimastel aastatel on dermatoloogilises praktikas edukalt kasutatud erütromütsiini ja oksütetratsükliindihüdraadi võrdses koguses segu sisaldavat preparaati erütsükliini. Kõrge terapeutilise aktiivsuse põhjus kombineeritud rakendus antibiootikumid on komponentide samaaegne toime üksikutele struktuurielementidele, ensüümsüsteemid ja biokeemilised protsessid patogeensete mikroobide rakkudes. Lisaks pärsib erineva toimesuunaga antibiootikumide kombinatsiooni kasutamine mikroorganismide antibiootikumiresistentsuse teket, aitab kaasa nende tundlikkuse taastamisele antibiootikumi suhtes. See seletab head terapeutiline toime eritsükliin, määratud 0,25 g 4 korda päevas 16-20 päeva koos kroonilised vormid püoderma, sealhulgas kombinatsioonis immunomodulaatoritega.
Oleandomütsiinfosfaat mõjutab mõnikord haigusi, mille patogeenid on erütromütsiini suhtes resistentsed. Tavaliselt kasutatakse seda kombinatsioonis tetratsükliiniga oletetriini kujul. Lisaks kokkide taimestikule toimib ravim klamüüdia, treponema, Mycobacterium tuberculosis'e vastu. Sellega seoses on oletetriin näidustatud mitte ainult tuberkuloosi, vaid ka püoderma kõigi vormide, klamüüdia etioloogiaga Reiteri tõve, naha tuberkuloosi, haavandilise nekrootilise stomatiidi jne korral. Oletetrin salvi kasutatakse edukalt pindmise püoderma korral.
Kloramfenikooli rühma kuuluvad klooramfenikool ja süntomütsiin. Levomütsetiin on sünteetiline antibiootikum. Seda määratakse suu kaudu 0,5 g 4 korda päevas pindmise püoderma, akne vulgaris'e korral, et kõrvaldada haiguspuhang, sealhulgas juhul, kui haiguse põhjustaja on resistentne penitsilliini streptomütsiini, sulfanilamiidi preparaatide suhtes.
Levomütsetiini ravis võivad tekkida kõrvaltoimed, peamiselt allergilised: urtikaaria, urtikaaria, sarlakid ja varnolikujulised lööbed. See võib põhjustada ekseemi ägenemist, millega kaasneb eksematiidide moodustumine; mõnikord on täheldatud klooramfenikooli kasutamist seedetrakti häired ja jne.
Süntomidiini kasutatakse kõrvaltoimete tekkimise võimaluse tõttu praegu ainult pindmise püoderma, nibulõhede jms väliseks raviks.
Rifamütsiinid poolsünteetilised ühendid, mida mõnikord kasutatakse kroonilise püoderma raviks. Rifampitsiini kombinatsioonis diafenüülsulfooni ja diutsifooniga on edukalt kasutatud lepromatoosse pidalitõve ravis.
Kinoliini rühma uued antibiootikumid on laia toimespektriga ravimid, mis on väga aktiivsed grampositiivse ja gramnegatiivse taimestiku vastu. Need on näidustatud kõikidel dermajuhtumitel, samas kui enoksatsiinil on parem toime gramnegatiivsetele bakteritele, mis on resistentsed teiste antibiootikumide suhtes. Enoksaniin püoderma jaoks määratakse suu kaudu 400 mg. 12 tunni pärast 7-14 päeva.
Kõik need antibiootikumid, eriti laia toimespektriga antibiootikumid, võivad pikaajalisel kasutamisel põhjustada erineva lokaliseerimisega kandidoosi. Sel juhul esineb pärmitaoliste seente aktiveerumine sagedamini suuõõne limaskestal ja välissuguelunditel, harvemini tekib kandidoos kõri, neelu, söögitoru, pärasoole limaskestal, aga ka suuõõne limaskestal. bronhid ja kopsud. Kandidoos siseorganid võib põhjustada patsientide surma.
Antibiootikumide ravis kandidoosi tekke peamiseks põhjuseks on düsbakterioos, mis tekib nende soolestiku mikroorganismide - pärmitaoliste seente konkurentide - allasurumise tagajärjel, mille tulemusena moodustuvad nende poolt B-kompleksi vitamiinid. bakterid, peamiselt B1 ja B2, on häiritud. Samas on antibiootikumidel ergutav toime pärmseenelaadsete seente kasvule nii seedekulglas kui ka mujal. See ei välista võimalust toksiline toime limaskestade antibiootikumid seedetrakt, mis hõlbustab resistentsete seente sissetoomist ja arengut.
Kui kahtlustate kandidoosi arengut, peaksite seda tegema laboriuuringud ja kui diagnoos on kinnitatud, lõpetage kasutatav ravim ja määrake nüstatiin, antihistamiinikumid, samuti kaltsiumipreparaadid, vitamiinid B1, B2, C. Pikaajalisel ravil laia toimespektriga antibiootikumidega tuleb kandidoosi ennetamiseks võtta nüstatiini, B- ja B2-vitamiini.
Grampositiivse taimestiku põhjustatud infektsioonist põhjustatud püoderma või dermatooside tüsistuste korral täheldasime linkomütsiinvesinikkloriidi ja fusidiinnaatriumi kasutamisel head ravitoimet. Samuti kasutasime neid ravimeid nende dermatoosidega patsientide keha taastusraviks, kellel oli fokaalne infektsioon, näiteks Melkerson-Roseitali sündroom, eksudatiivne multiformne erüteem jne. Linkomütsiini efektiivsuse kohta akne korral on eraldi aruanded.
Linkomütsiinvesinikkloriidi võetakse suu kaudu 1-2 tundi enne sööki, 0,5 g 3 korda päevas või süstitakse intramuskulaarselt 0,6 g 2 korda päevas ning seda kasutatakse ka välise vahendina salvi ja pasta kujul.
Fusidiin-naatriumi võetakse suu kaudu 0,5 g 3 korda päevas.
Gramitsidiin on paikne antibiootikum. See antakse välja 2% kujul alkoholi lahus ja seda kasutatakse edukalt impetiigo, ecthyma vulgaris'e, krooniliste püokokihaavandite, nahalõhede jne raviks.
Pseudomonas aeruginosa põhjustatud haiguste korral on näidustatud polümüksiinsalvi kasutamine, mis sisaldab 20 000 ühikut polümüksiin M sulfaati 1 g aluse kohta.
Seenevastased antibiootikumid on aktiivsed erinevat tüüpi patogeensed seened.
Nüstatiin ja levorium toimivad Candida ja Aspergillus perekonna pärmilaadsetele seentele. Sellega seoses on need tõhusad mis tahes lokaliseerimise kandidoosi korral. Neid ravimeid kasutatakse ka koos ennetav eesmärk et vältida kandidoosi teket pikaajalise antibiootikumravi ajal. KOOS terapeutiline eesmärk nüstatiini võetakse suu kaudu 5 000 000-6 000 000 RÜ / päevas, profülaktiliselt - 1 500 000 - 2 000 000 RÜ / päevas. Kandidaasi lokaalseks raviks kasutatakse nüstatiini salvi, millest 1 g sisaldab 100 000 RÜ nüstatiini. Levoriini annused on ligikaudu 2 korda väiksemad kui nüstatiini näidatud annused, seda on ette nähtud 500 000 RÜ 3 korda päevas. Levorini salvi kasutatakse lokaalselt.
Suu limaskesta kandidoosi ravis võib soovitada lokaalset loputamist levoriini vesisuspensiooniga. Seda suspensiooni võib kasutada ka naiste suguelundite limaskestade kandidoosi raviks. Nüstatiin põhjustab väga harva kõrvaltoimeid iivelduse ja soolehäirete kujul.
Polüeenantibiootikumil amfoteritsiip B on kõrge antimükootiline toime pärmseente ja pärmitaoliste seente vastu. Ravimit manustatakse ravis intravenoosselt. rasked vormid teiste ravimeetodite suhtes resistentne kapidoos. Kell intravenoosne manustamine Amfoteritsiin B põhjustab sageli kõrvaltoimeid, mõnikord raskeid. Kandidaasi väliseks raviks kasutatakse amfoteritsiini salvi, mis sisaldab 30 000 ühikut 1 g aluse kohta.
Amfoglükamiin on ka pärmivastane polüeenantibiootikum. Erinevalt amfoteritsiin B-st võetakse seda suu kaudu 400 000–600 000 RÜ päevas 10 päeva jooksul. Siiski põhjustab see samu kõrvaltoimeid kui amfoteritsiin B.
Sügavate mükooside ja pärmilaadsete seente patogeenide vastane mükogentiin on lähedane amfoteritsiin B-le ja sellel on kõrge aktiivsus. Ravim on ette nähtud suukaudseks manustamiseks kandidoosi korral, 250 000 RÜ 2 korda päevas 10-14 päeva jooksul. Mükoheptiini salvi kasutatakse kandidoosi väliseks raviks.
Griseofulviin on seenevastane antibiootikum, millel on fungistaatiline toime erinevad tüübid dermatofüüdid, millega seoses kasutatakse seda edukalt trikhofütoosi, mikrospooria, favuse, jalamükooside jne raviks. Griseofulviini võetakse suu kaudu koos toiduga. Täiskasvanutele määratakse ravim 0,5-2 g päevas, laste ravimisel sõltub ühekordne ja päevane annus haiguse olemusest, lapse vanusest ja kehakaalust. Trihhomükoosi, küünte kahjustusega jalgade mükoosi ravi viiakse läbi pikka aega. Samaaegselt griseofulviiniga on soovitatav võtta vitamiine C, B1, B2, nikotiinhapet.
Griseofulviin on madala toksilisusega antibiootikum. Valdav enamus selle põhjustatud kõrvaltoimetest on klassifitseeritud kergeteks: peavalu, pearinglus, väsimus, paresteesia, iiveldus ja väikesed seedetrakti häired, raskustunne rinnus jne. Vere muutused esinevad harva. Mõnel juhul on nahal lööve, enamasti allergilise iseloomuga. Pärast griseofulviini kasutamise lõpetamist kõrvaltoimed tavaliselt kaovad ja enamikul juhtudel võib ravi selle antibiootikumiga jätkata. Kergete kõrvaltoimete tekkimisel piisab reeglina ainult vähesest vähendamisest päevane annus ravimit ilma selle kasutamist lõpetamata.
Uuringud Zh. V. Stepanova jt. näitas, et mikrosporiaga laste pikaajalisel ravimisel griseofulviiniga pärsib see kaitseväed organismi, põhjustades fookuste ägenemist krooniline infektsioon, eriti krooniline tonsilliit. Sellega seoses, kui sellistel lastel ilmnevad kroonilise tonsilliidi ja muude ülemiste hingamisteede haiguste tunnused, peaksid nad ninaneelu võimalikult kiiresti desinfitseerima.
Tsüklosporiin A, uus immunosupressiivne antibiootikum, vastavalt H. Zachariae ja K. Thestrup-Pedersen. tõhusam psoriaasi põdevatel patsientidel selle selektiivse toime tõttu T-abistajatele, sealhulgas pustuloosse psoriaasi, nagu pustuloosne akrodermagiit, korral. Algselt määrati tsüklosporiin A annuses 14 mg/kg päevas ja seejärel vähendati annust 5 mg/kg-ni.
N. Kato jt. märkis, et tsüklosporiin A annab häid tulemusi psoriaasi ja ihtüoosi ravis.
C. Frances et al. teatasid tsüklosporiin A edukast paiksest kasutamisest 4-l suu limaskesta lame lihheniga patsiendil. Ravim lahustati taimeõli, manustati 4 korda päevas, milleks kasutati 25 mg tsüklosporiini A. M. Pilgrim teatas Kaposi sarkoomi esinemisest 40-aastasel patsiendil 3 kuu pärast. pärast neeru siirdamist immunosupressiivse ravi taustal tsüklosporiin A-ga.
Dotsenko N.Ya.
arstiteaduste doktor, professor
Naha ja pehmete kudede infektsioonide (SSTI) terminoloogia ei ole ühtne. Praktilisest aspektist on need jagatud kolme rühma (tabel). ICMT peamiseks allikaks on streptokokid aureus ja püogeensed streptokokid, mis koloniseerivad naha pinda, tungides kahjustuse korral läbi epidermise.
ICMT olemuse kindlakstegemine läbiviimisega bakterioloogiline kultuur tingimata rasketel juhtudel, nagu mitu s ja asukoht näol, sekundaarsed ja nekrotiseerivad infektsioonid. SIMT-i ravi sisaldab kolme põhikomponenti - lokaalne ravi, kirurgiline sekkumine ja antibiootikumravi. Primaarne püoderma
tselluliit - äge põletik nahk ja/või nahaalune kude nende tihenemine, hüperemia, tursed ilma raku nekroosi või mädanemiseta, millega sageli kaasneb lümfangiit ja piirkondlik lümfadenopaatia. Furunkel - äge perifokaalne põletik juuksefolliikul, esineb sagedamini näol, kaelal, rinnal ja tuharatel. Kordumist raskendab EZA areng.
Enne mädast sulandumist on soovitatav puhata, antiseptilised sidemed (ihtiool ei ole näidustatud - soodustab infiltraadi abstsessi teket). Kui aga protsess on lokaliseeritud, näiteks nina eelõhtul, asetatakse ninna 10% süntomütsiini emulsioon. Pindmise asukoha korral saab eemaldada nekrootiline varras. Näo furunkel ähvardab meningeaalsete tüsistustega, seega on kõik manipulatsioonid selles piirkonnas piiratud. Selle lokaliseerimisega on kõne ja närimine piiratud. Süsteemne antibiootikumravi on näidustatud ainult siis, kui munasarjad asuvad näol. Karbunkel - s-i konglomeraat, mis moodustub infektsiooni subkutaanse leviku tagajärjel koos naha sügavate kihtide mädase-nekrootilise põletiku tekkega, sageli koos nekrootiliste masside tagasilükkamisega. Ravi on tavaliselt kirurgiline. Kui põletik progresseerub hoolimata piisavast sisselõikest, on näidustatud antibiootikumravi.
Hüdradeniit (" emase udara") - lokaalne valulik apokriinsete näärmete põletik, tavaliselt lokaliseeritud kaenlaaluses või kubemes.
Ravi infiltratsiooni staadiumis on konservatiivne (puhkus, kahjustuse pesemine on välistatud, antibiootikumravi, ultraviolettkiirgus, naha töötlemine alkoholi või antiseptikumidega), kui ilmneb kõikumine - avamine a. Seega viiakse süsteemne antibiootikumravi läbi lokalisatsiooniga a näol (ja kaelal), kusjuures e. e puhul on eelistatud kirurgiline sekkumine. Kergetel juhtudel on ette nähtud fenoksümetüülpenitsilliin, amoksitsilliin või makroliidid. Lammaste puhul määratakse kergetel juhtudel suukaudselt tsefaleksiin, amoksitsilliin/klavulanaat, raskematel juhtudel teise põlvkonna tsefalosporiine (tsefamandool, tsefuroksiim), mille kliiniline efektiivsus on tõestatud. Korduva ah-ga viiakse läbi pidev antibiootikumravi 1-2 kuud. (bitsilliin või makroliidid 1 nädala jooksul iga kuu).
Viimasel ajal on metitsilliiniresistentsete S. aureus'e (MRSA) tüvede arv suurenenud. Hoolimata selliste juhtumite harvaesinemisest ambulatoorsete patsientide seas (1%), võib ICMT kõrge levimuse ja nende edasise suurenemise tõttu tekkida probleeme raviga, kuna MRSA-vastaste ravimite arsenal piirdub kotrimoksasooliga (trimetoprim / sulfametoksasool). , tetratsükliinid ja oksasolidinoonide rühma kuuluv ravim (linesoliid). On näidatud, et S.aureus'e tüved, mis on eraldatud pindmiste STI-dega hospitaliseeritud patsientidelt, on väga resistentsed tetratsükliini, gentamütsiini, tsiprofloksatsiini, klindamütsiini, klooramfenikooli, erütromütsiini suhtes, säilitades samas tundlikkuse fusidiinhappe ja mupirotsiini suhtes.
Sekundaarne ICMT, mis tekkis kaasuvate haiguste taustal
Lamatised - isheemiline nekroos ja kudede haavandumine luu eendi kohal, mis on pikka aega olnud pideva välissurve all. Kokkfloora esinemisel patoloogilises materjalis määratakse antibiootikumid, nagu streptokoki või munarakkude puhul, e. Gramnegatiivse infektsiooni või e korral kasutatakse amoksitsilliini / klavulanaati, imipeneemi / tsilastatiini, IV põlvkonna tsefalosporiini tsefepiimi.
Sündroomne jala sündroom (SFS) on ic neuropaatia, mikro- ja makroangiopaatia, osteoartropaatia põhjustatud anatoomiliste ja funktsionaalsete muutuste kompleks, mis viib jala pehmete kudede nakatumiseni koos mädase-põletikulise protsessi tekkega, mis lõpuks lõpeb jäseme amputatsioon. Mõjutatud piirkondadest külvatakse sageli aeroobset taimestikku, sageli polümikroobset.
Nakatunud ja nakatumata jalahaavandeid on raske eristada, sest isegi sügava infektsiooni korral ei esine enamikul patsientidest kehatemperatuuri tõusu ja ESR-i suurenemist. Ühelt poolt ei välista nende märkide puudumine nakatumise võimalust, teisalt viitab nende olemasolu haavandi juuresolekul alati märkimisväärsele kahjustusele.
SDS-i ravi põhimõtted: metaboolne kontroll,
A moodustamisel näidatakse seda kirurgiline sekkumine. Raskeid infektsioone iseloomustab massiivne OM, lümfadeniit koos septilise seisundi tekkega. Valitud antibiootikumid - imipeneem / tsilastatiin, efektiivne ampitsilliin / sulbaktaam kombinatsioonis aminoglükosiididega, III-IV põlvkonna tsefalosporiinid.
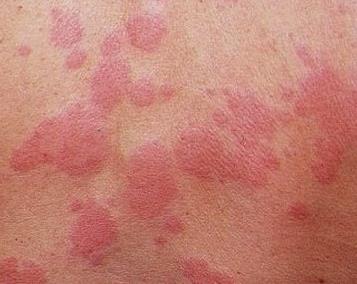
2002. aastal tehti süstemaatiline ülevaade 25 randomiseeritud kontrollitud uuringust, milles hinnati paiksete ja süsteemne ravi troofilised haavandid alajäsemed, lamatised ja jalajälg. Allopurinooli ja dimetüülsulfoksiidi kasutamine, sidemed alates aktiveeritud süsinik hõbedaga, vaske sisaldav tripeptiid ja hõbesulfadiasiin suurendas alajäsemete troofiliste haavandite paranemise tõenäosust võrreldes platseebo ja teiste paiksete preparaatidega. Oksükinoloonsalvi määrimine aitas kaasa lamatiste paranemisele. Autorid jõudsid järeldusele, et kohalik rakendus mõned antibakteriaalsed ained soodustavad krooniliste paranemist haavandilised kahjustused nahka. Nad soovitavad süsteemse infektsiooni nähtude korral ravi süsteemsete antibiootikumidega. Erysipelas(RV), - nakkushaigus põhjustatud b-hemolüütilisest streptokokist (rasketel juhtudel - polümikroobsed ühendused). Iseloomulik on naha, limaskestade fokaalne seroosne või seroos-hemorraagiline põletik, palavik, mürgistus.
Lokaalsete ilmingute olemuse järgi eristatakse toonilisi, toonilis-bulloosse, toonilis-hemorraagilisi ja bulloosseid-hemorraagilisi vorme; vastavalt kulgemise paljususele - esmane, korduv, korduv; vastavalt kohalike ilmingute levimusele - lokaliseeritud, laialt levinud, ekslemine, metastaatiline; vastavalt kursuse raskusastmele - kerge, mõõdukas ja raske.
Raske RV korral, millega kaasneb mürgistus või laialdased nahakahjustused (eriti bulloos-hemorraagilise vormi korral) ja sagedased retsidiivid, olenemata joobeastmest ja lokaalse protsessi iseloomust,
Antibiootikumide kohalik kasutamine RV-s ei ole soovitatav, kuna selle kasutusviisiga nad ei hävita mikrofloorat, vaid muudavad selle koostist.
RV süsteemne antibiootikumravi on kohustuslik ja seda viiakse läbi ambulatoorselt uute makroliidide või tsefaklooriga 7-10 päeva jooksul. Võib-olla doksütsükliini kasutamine talumatusega - furazolidoon. Haiglas kasutatakse bensüülpenitsilliini, tsefasoliini või linkomütsiini 7-10 päeva. Rasketel juhtudel on ette nähtud a, flegmooni, tsefalosporiinide areng II- III põlvkond kaitstud penitsilliinid, sealhulgas kombinatsioonis teise põlvkonna fluorokinoloonidega (tsiprofloksatsiin, ofloksatsiin) või monoteraapia III-IV põlvkonna fluorokinoloonidega. Korduva RV ravi viiakse läbi kaitstud penitsilliinide, III-IV põlvkonna fluorokinoloonidega.
Bitsilliini profülaktika (bensatiini bensüülpenitsilliin 2,4 miljonit ühikut) hoiab ära streptokoki L-vormide taastumise bakteriaalsed vormid. Kolme või enama ägenemise korral aastas viiakse bitsilliini profülaktika läbi aastaringselt 2-3 aastat 3-4-nädalase intervalliga. (esimestel kuudel on vahe 2 nädalat). Hooajaliste ägenemiste korral alustatakse antibiootikumravi kuu aega enne haigestumuse hooaja algust 3-4-nädalase intervalliga. kuni 3-4 kuud aastas.
Nekrotiseeriv ICMT
Iseärasused:
- letaalsus - kuni 50%;
- reeglina polümikroobne etioloogia koos toksiinide tootmisega, mis pärsivad makroorganismi immuunsust;
- infektsiooni lokaliseerimine tüüpilistel juhtudel - perineum ja alajäsemed;
- kudede kiire levik (sh subfastsiaalne) ja sageli mädane lagunemine koos gaaside moodustumisega, mädase eksudaadi puudumine;
- nakkuse tegelik leviku aste määratakse alles kirurgilise ravi käigus.
Seega koosneb ICMT ravi kirurgilisest sekkumisest, lokaalsest ravist ja antibiootikumravist. ECMT patogeenide koostise ja tundlikkuse muutumise tõttu antimikroobne ravi tuleks läbi viia, võttes arvesse nende seiret. ICMT süsteemsete antibiootikumide määramise näidustused on kliiniliselt väljendunud üldise põletikulise reaktsiooni olemasolu või protsessi ohtlik lokaliseerimine. Antibiootikumide valikul lähtutakse nende mõistliku kasutamise põhimõtetest: kergetel juhtudel - b-laktaamid, makroliidid suu kaudu, infektsiooniga mõõdukas- kaitstud penitsilliinid, tsefalosporiinid II-III põlvkond, fluorokinoloonid, eluohtlike infektsioonidega - karbapeneemid, tsefalosporiinid või fluorokinoloonid III-IV põlvkond.
Kirjandus
1. Bereznjakov I.G. Antibiootikumide mõistliku kasutamise põhimõtted. Clinical Antibiotic Therapy, nr 1 (2004).
2. Tutchenko M.I., Ignatovsky Yu.V., Schastniy V.M. Beshikhovi põletiku medikamentoosne ravi raske kaasuva patoloogiaga vaevuste korral. Clinical Antibiotic Therapy, nr 4 (2002).
3. Toimik T. Naha ja pehmete kudede infektsioonide diagnoosimine ja antimikroobne ravi. Clinical Microbiology and Antimicrobial Chemotherapy, nr 2 (2003).
4. Shapiro A.V. Antibiootikumid ja nende kasutamine mäda-põletikuliste haiguste korral. Likuvannya ta diagnostika, nr 1 (1999).
5. Leibovici L. Ülevaade: mõne aktuaalne rakendamine antimikroobsed ained soodustab krooniliste haavandiliste nahakahjustuste paranemist. Rahvusvaheline ajakiri meditsiinipraktika, №3 (2002).
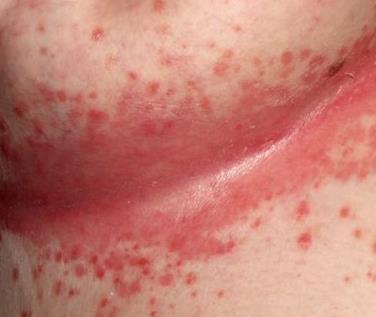
Kell atoopiline dermatiit soodsad tingimused nakkuse tekkeks nahal. Sageli kasvatatakse nahalt või ninaneelu limaskestalt Staphylococcus aureus(Staphylococcus aureus), Staphylococcus epidermalis (Staphylococcus epidermalis) ja oportunistlikud seened (Malassezia furfur, Candida, Rhodotomla rubra). Mikroobsed toksiinid toetavad allergilist põletikku. Sellist dermatiiti ravitakse halvasti.
Mis on nahainfektsioonid?
Stafülokokid põhjustavad stafülodermat, streptokokid streptodermat. Kõige sagedasem nahainfektsioon on segatüüpi - streptostafüloderma.
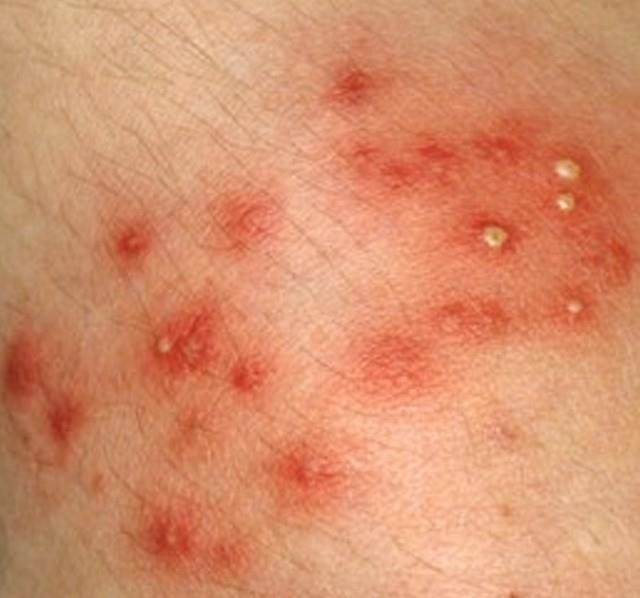
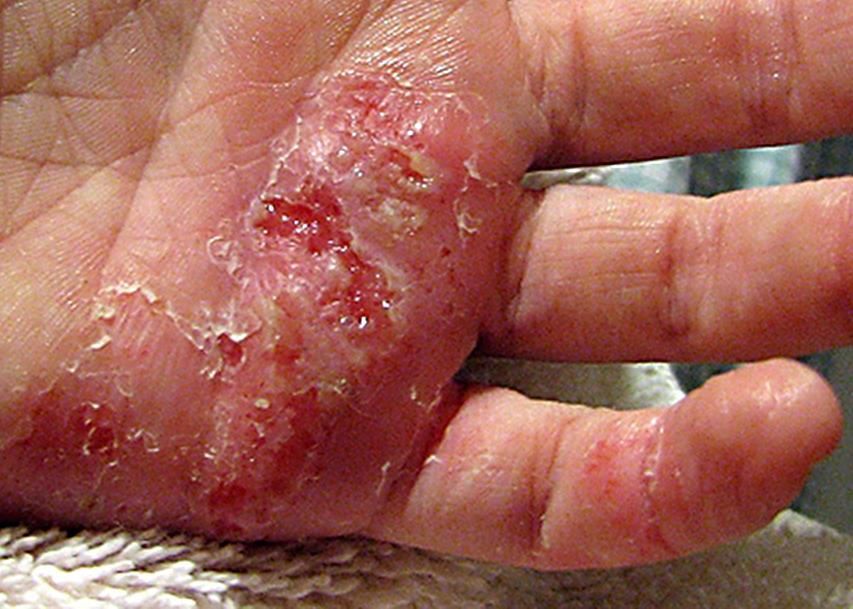
Pindmine stafüloderma- need on väikesed vesiikulid, millel on punasel taustal verine-mädane eritis, valged pustulid karvade ümber, näärmepõletik kaenlaalustes, kuulmekäikudes, päraku ümbruses ja suguelundites.
 |
 |
||
| Foto. Pindmise stafüloderma erinevad etapid. Kõik saab alguse ühest väikesest tuberkuloosist, mille ümber tärgavad ahelas uued elemendid. Muhud muutuvad mullideks ja mullid muutuvad koorikuteks. | |||
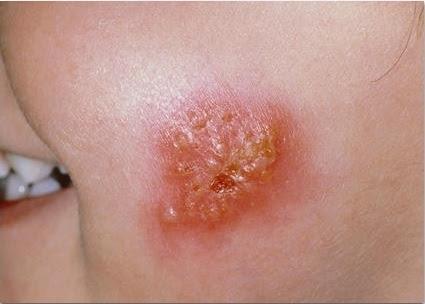
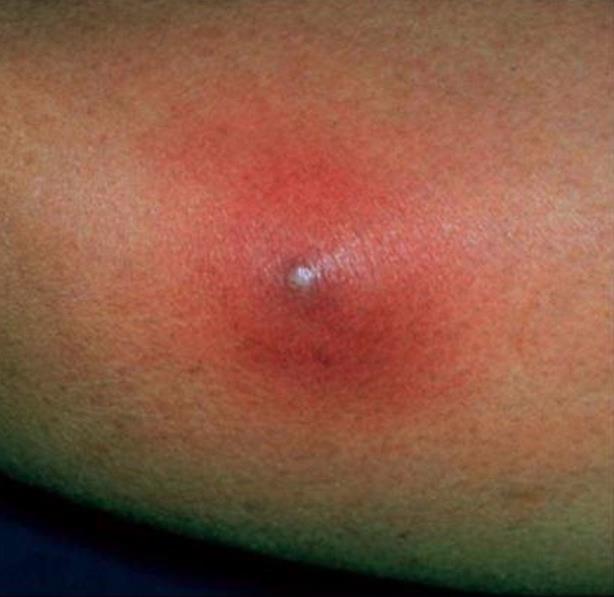
Sügav stafüloderma- need on keemised, karbunklid, nahaabstsessid.
 |
 |
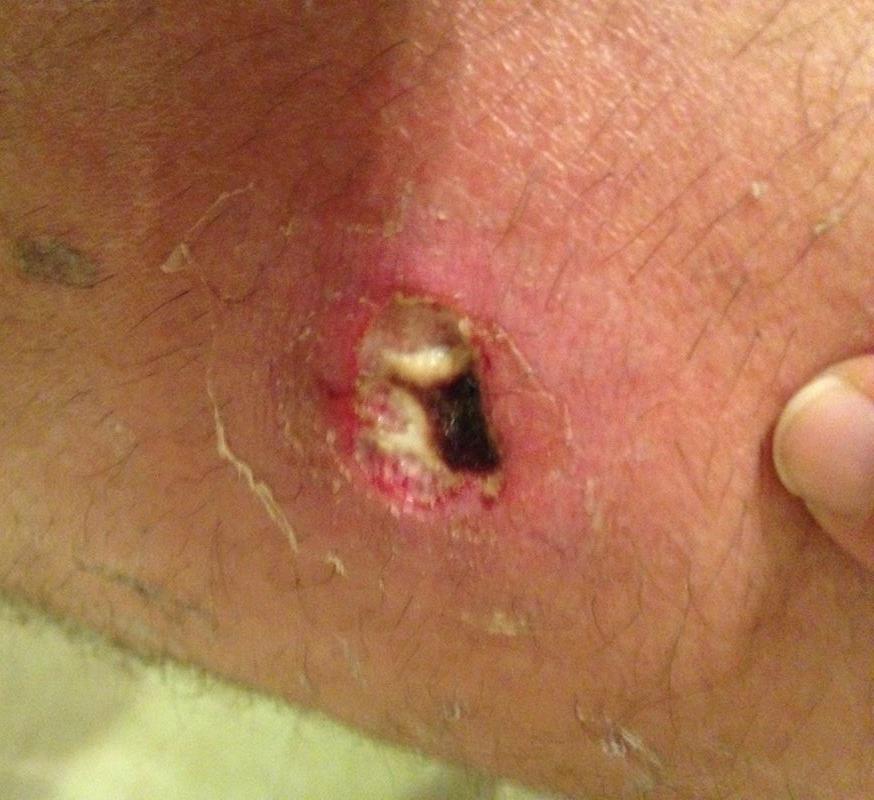 |
|
| Foto. A on follikuliit. B, C - furunkel. | |||
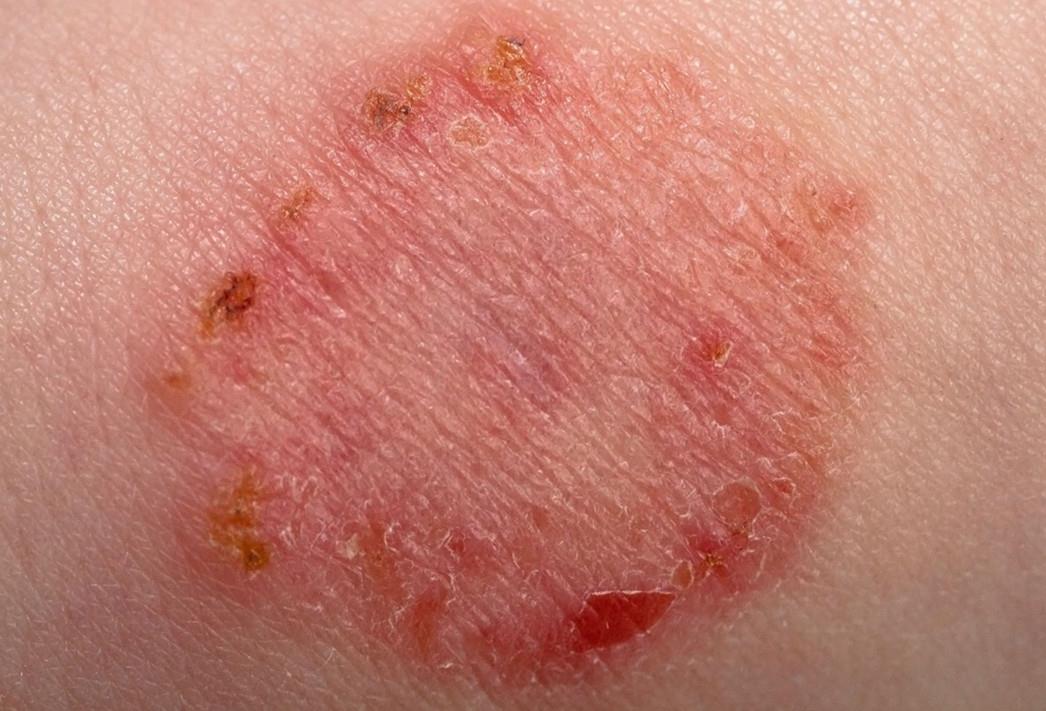
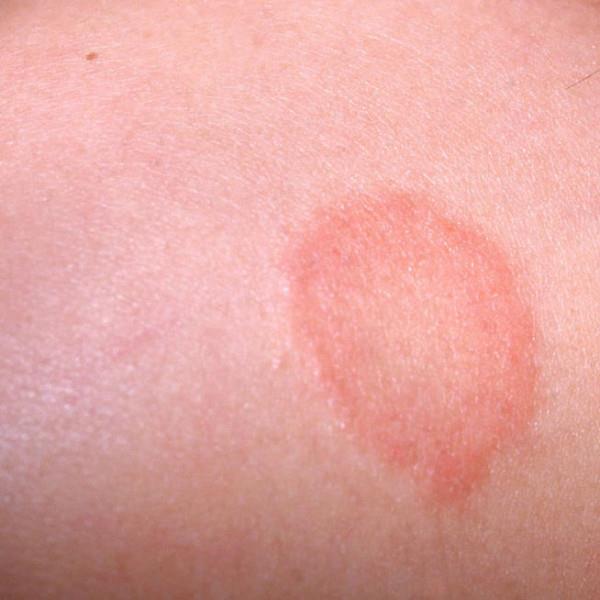
streptoderma- need on punasel taustal lõdvad villid, mis avanevad kiiresti ja moodustavad pruuni koorikuga haavandeid.
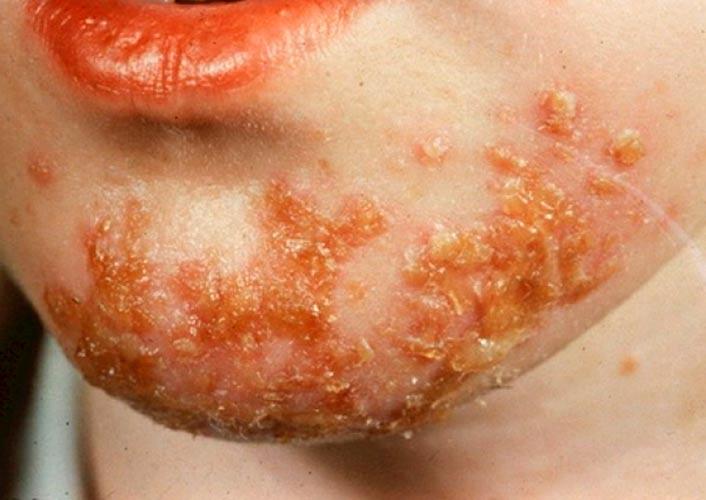 |
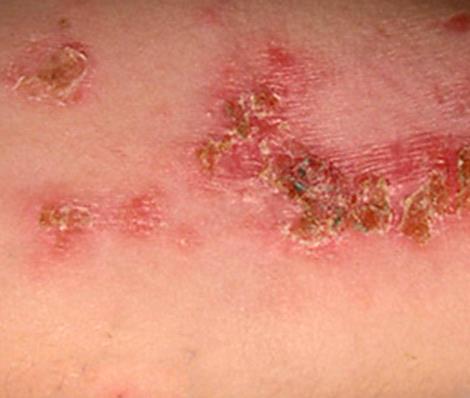 |
 |
|
| Foto. Naha streptoderma. | |||
Naha seeninfektsioon- Need on erkpunased laigud, millel on selged kõrgendatud servad ja väga väikesed täpid-mullid; praod ja ärritus valgete laikudega; krambid suunurkades, lõhed ja põletik huultel valge kattega.
 |
 |
 |
|
| Foto. Naha seeninfektsioon. | |||
Kreemid, salvid, pihustid nahainfektsioonide raviks
Ravi jaoks nakkuslikud tüsistused atoopilise dermatiidi korral kasutatakse Tridermi kreemi (odavad analoogid - Akriderm, Candiderm, Kanizon plus), Pimafukorti (sarnased ravimid, ainult ilma seenevastase komponendita - Cortomycetin, Hyoxysone, Oxycort), Skin-cap (odavad analoogid - Zinocap, Desetin, tsingi salv, Sudocrem).
Triderm sisaldab hormooni (beetametasoondipropionaat 0,05%), antibiootikumi (gentamütsiinsulfaat 0,1%) ja seenevastast ainet (klotrimasool). Hormoonil on põletikuvastane ja sügelemisvastane toime. Antibiootikum tapab baktereid, sealhulgas Staphylococcus aureust. seenevastane aine pärsib seente kasvu. Tridermi kantakse lööbekolletele lastele alates 2. eluaastast ja täiskasvanutest 2-3 korda päevas 7-14 päeva jooksul.
Esimese eluaasta lastele on ravim soovitatav Pimafukort mis sisaldab hormooni hüdrokortisooni, seenevastane ravim natamütsiin, aga ka antibiootikum neomütsiin. Vahendit kantakse kahjustatud nahapiirkondadele 2-4 korda päevas mitte rohkem kui 10-14 päeva jooksul.
Pärast ravi tridermi või pimafukortiga saate üle minna pikaajaline ravi kreem Nahakate. Mittehormonaalne ravim Nahakate sisaldab aktiveeritud tsinki. Sellel on põletikuvastane, antimikroobne ja seenevastane toime (vt.).
Tähtis!!! Ravi viiakse läbi kuni infektsioonikolde täieliku kadumiseni.
Atoopilise dermatiidi ravikosmeetika
Pärast nakkuskollete eemaldamist viiakse läbi kohalik hooldusravi meditsiinilise kosmeetikaga.
DARDIA (lipo-piim, lipo-kreem, lipo-palsam), Mustela Stell Atopia, A-Derma liin, Aven (Derma-libur, Sicalfate), Vichy (lipidioos, nutrilozhi), Laboratoires Nygy-Charlieu (topikrem), Avene ( Trixera), Uriage (Cu-Zn-kreem, sprei), La Roche-Posay (Lipikar, Hydranorm) jne.
Pärast suplemist on vaja peale kanda niisutajaid ja pehmendavaid aineid, järgides “3 minuti reeglit” – kanda märjale nahale niisutajat 3 minuti jooksul pärast suplemist.
Antibiootikumid nahainfektsioonide jaoks
- kui tekib nahainfektsioon koos palaviku ja joobeseisundiga;
- kui sisse üldine analüüs vere põletikulised muutused;
- juures sügav stafüloderma- furunkuloos, karbunklid, abstsessid;
- kui 3-5 päeva jooksul välistest ainetest mõju ei ilmne.
Nahapõletike raviks sobivad makroliidid (Sumamed, Vilprafen, Klacid) või II ja III põlvkonna tsefalosporiinid (Supraks, Zinnat, raskematel juhtudel - Tseftriaksoon intravenoosselt). Ravikuur on 5-7 päeva.
Antibiootikumravi kombineeritakse väliste ainetega. Nahka töödeldakse Miramistiini, Kloorheksidiini, Fukortsini, briljantrohelise, sinise, Chlorfilipti, Bactrobani, süntüümilise emulsiooni, Levomikoliga.
Tähtis!!! Stafülokokk nahalt kaapimisel kaebuste puudumisel, samuti pindmine stafüloderma ei ole näidustus antibiootikumide võtmiseks. Ravi piirdub välise raviga.
Määrake seenevastased pillid
- kandidoosi invasiivsete vormidega (CKA määramine vereseerumis);
- dermatomütseedide nahast külvamisel mis tahes kontsentratsioonis;
- kui välise seenevastase ravi mõju puudub 3-5 päeva jooksul.
Flukonasooli (Diflucan, Flucostat, Mycosyst jt) kasutatakse kandidooside raviks. See on lubatud lastele alates sünnist. Flukonasool on aktiivne perekonna Candida, Rhodotorula ja Malassezia furfur pärmilaadsete seente, samuti ravimi suhtes tundlike dermatomütseedide vastu. Flukonasooli määratakse 3-5 mg / kg päevas 7-14 päeva jooksul (kapslid või suspensioon).
Terbinafiin (Lamisil jt) on ette nähtud dermatomütseedide ja hallitusseente (Aspergillus, Penicillium) nakatumiseks, samuti flukonasooli suhtes resistentsete kandidoossete infektsioonide korral. Ravim on lubatud alates 2 aastast. Annused: 2-5 aastat - 62,5 mg päevas; 5-12 aastat - 125 mg päevas; 12-15 aastat - 250 mg päevas. Kursus on 10-14 päeva - kerge kuuriga, 2-3 nädalat - mõõduka kuuriga, 3-4 nädalat - raske kuuriga.





