Tere kõigile! Tüdrukud, kes olid sees sarnased olukorrad, vastake! Esimene linastus toimus 27. mail. Ultrahelis oli kõik normaalne. Nad kirjutasid igaks juhuks telefoninumbri üles, aga ma ei oodanud, et nad võivad tagasi helistada ja nüüd nädala pärast helistatakse - tule CPSIR-i saatekirja, sul on oht suur. Ise ei mäleta, pisarais, sõitsin vatijalgadel, võtsin kõik paberid. Risk 1:53. Järgmisel päeval läksin lisauuringule. Uzist vaatas väga pikka aega nii kõhult kui ka vaginaalselt, mitu korda lülitas Doppleri sisse ja kõik tundus olevat korras, kuid talle ei meeldinud TRISCUPIDAL VALVE DOPPLEROMEETRIA: REGULATION. Sisestasin programmi uue ultraheliuuringu andmed ja nädal tagasi sõeluuringu tulemused, arvuti väljastas diabeediriski 1:6. Saadetud geneetiku juurde. Pärast järelduse vaatamist selgitas ta mulle, et see regurgitatsioon võib olla lihtsalt loote tunnus, kuid koos alahinnatud PAPP-A väärtusega 0,232 MoM on see kromosomaalsete kõrvalekallete marker. Kõik muu on normi piires. Nad tegid ettepaneku teha koorioni villi biopsia. Olen siiani keeldunud, õde oleks peaaegu toolilt kukkunud, nagu risk on nii suur ja HA-d ei ravita ja minu asemel poleks ta hetkekski mõelnud. Küsisin geneetiku käest Panorama analüüsi kohta (õudselt kallis geenianalüüs emavere jaoks), ta vastas mulle, et loomulikult saab seda teha, aga see välistab ainult 5 põhilist CA-d ja mitu väga haruldast, see ei saa täielikult välistada anomaaliaid. ja minu puhul on soovitatav invasioon. Olen sellel teemal juba palju artikleid, küsimusi ja kõike muud sellist lugenud ja ma ei saa kuidagi aru, mida nad minu analüüsides nii kohutavat leidsid? Regurgitatsioon, nagu selgus, on sel ajal füsioloogiline ja möödub 18-20 nädala pärast (kui see ei taandu, näitab see südamedefektide riski, paljudel möödub see pärast sünnitust ja mõned elavad sellega endiselt kaasa ja ei mõjuta midagi.mintraalklapp,mis sain emalt ehk on kuidagi omavahel seotud). Hormoonid ei pruugi üldse olla indikatiivsed, sest Olen seda võtnud raseduse algusest peale, sõin 2 tundi enne analüüsi (selgub, et enne 4 tundi ei saa süüa, mulle ei räägitud sellest), jõin kohvi, olin närvis ja mures ultraheli pärast ja ma ma kardan verd annetada ja Hiljuti krooniline väsimus, väsin vanema lapsega. Ja kõik see mõjutab tulemusi. Geneetik ei küsinud midagi sellist, ei huvitanud, neil on seal mingi konveier ja mind justkui suruti sinna statistika pärast. Kuid nad istutasid minusse natuke kahtlust, ma olin mures, mitte ei muretsenud järgmise aasta pärast. Abikaasa veenab biopsiat tegema. Ma kardan kohutavalt tagajärgi, kardan oma last kaotada või haiget teha, eriti kui ta on terve. Ühest küljest, kui kõik on hästi, siis hingan kergendatult ja saadan kõik arstid minema. Teisest küljest, kui kõik on halvasti, mida teha? Kas ma suudan raseduse katkestada, lasta enda sees lapsel lõhki lõigata, eriti praegu, kui mulle tundub, et hakkan seda tundma. Aga teine variant on see, et kas ma suudan kasvatada last, kes vajab erilist lähenemist ja palju tähelepanu, kui vahel tahaks täiesti terve tütre eest põgeneda... Kurat, kõik need mõtted söövad mind ära. Ma ei tea, mida teha... Igaks juhuks annan sõeluuringu andmed:
Tähtaeg: 13 nädalat
HR 161 lööki minutis
Ductus venoosne PI 1.160
Chorion / Planet madalal esiseinal
Nabanöör 3 anumat
Loote anatoomia: kõik on määratud, kõik on normaalne
b-hCG 1,091 MoM
PAPP-A 0,232 MoM
Emakaarter PI 1240 MoM
Trisoomia 21 1:6
Trisoomia 18 1:311
Trisoomia 13 1:205
Preeklampsia kuni 34 nädalat b-t 1: 529
Preeklampsia kuni 37 nädalat, b-t 1: 524
Päriliku eelsoodumusega multifaktoriaalsete haiguste, sealhulgas IDDM-i ennetamisel on vajalik seos.meditsiiniline geneetiline nõustamine. Meditsiinilise geeninõustamise põhiülesanne on haiguse geneetilise riski väljaselgitamine ja selle tähenduse selgitamine kättesaadaval kujul. Diabeedi korral pöörduvad abikaasad kõige sagedamini meditsiinilise geneetilise nõustamise poole, et hinnata haigusriski tulevastel lastel, mis on tingitud selle haiguse esinemisest eelmistel lastel või abikaasadelt endilt ja/või nende sugulastelt. Populatsioonigeneetilised uuringud võimaldasid seda välja arvutada geneetiliste tegurite panus diabeedi tekkessepaneb 60-80%. Sellega seoses on erakordselt oluline ja perspektiivikas diabeedihaigete lähedaste meditsiiniline ja geneetiline nõustamine.
Peamised küsimused, millega arst tavaliselt tegelema peab, on diabeedi tekkerisk. teil on lapsi või õdesid-vendihaige, võime seda klassifitseerida ja prognoos seosestulevased (planeeritud) pereliikmed.
I tüüpi diabeediga patsientide perenõustamine koosneb mitmest üldtunnustatud etapist, millel on selle kontingendi jaoks oma eripärad.
11.1. Nõustamise etapid
Nõustamise esimene etapp - haiguse diagnoosi täpsustamine.
Tavaliselt ei ole I tüüpi diabeedi diagnoosimine lapsepõlves ja noorukieas keeruline. Siiski, kui teistel pereliikmetel on diabeet, on vajalik nende diabeeditüübi kindlakstegemine, mis võib mõnel juhul olla keeruline ülesanne ja nõuab arstilt haige sugulase põhjaliku anamneesi võtmist. Diabeedi kahe peamise tüübi (1 ja 2) diferentsiaaldiagnoos tehakse üldtunnustatud kriteeriumide alusel.
Populatsioonigeneetiliste uuringute käigus tõestatud kahe peamise diabeeditüübi geneetiline heterogeensus näitab nende nosoloogilist sõltumatust ja pärilikkuse sõltumatust. See tähendab, et 2. tüüpi diabeedi juhtumid üksikute patsientide sugupuus on juhuslikud ja neid ei tohiks pereriski hindamisel arvesse võtta.
Meditsiinilise geneetilise nõustamise läbiviimisel on vaja välja jätta ka geneetilised sündroomid, sealhulgas suhkurtõbi, kuna neid iseloomustab monogeenne pärilikkus.
Nõustamise teine etapp - haigestumise riski määramine olemasolevate pereliikmete ja kavandatavate järglaste suhtes.
Saadi empiirilised hinnangud I tüüpi diabeeti põdevate pereliikmete diabeedi tekkeriski kohta. Suurim risk on 1. sugulusastme sugulastel (lapsed, vanemad, vennad-õed) - keskmiselt 2,5-3% kuni 5-6%. Selgus, et diabeedi esinemissagedus aastal I tüüpi diabeediga isade lapsed on 1-2% kõrgemad kui 1. tüüpi diabeeti põdevatel emadel.
Igas konkreetses peres sõltub haigestumise risk paljudest teguritest: haigete ja tervete sugulaste arvust, pereliikmete diabeeti haigestumise vanusest, konsulteeritava isiku vanusest jne.
Tabel 8
Empiiriline risk I tüüpi diabeediga patsientide sugulastele
Spetsiaalse metoodika järgi on arenguriski tabelidSD 1 tüüp olenevalt haigete ja tervete sugulaste arvust ning konsulteeritavate vanusest jaoks erinevat tüüpi perekonnad... Perekondade tüübid, vanemlik seis ja haigete õdede-vendade arv on toodud tabelis 9.
7.1. DIABEEDI KLASSIFIKATSIOON
Diabeet(DM) - metaboolsete haiguste rühm, mida iseloomustab hüperglükeemia, mis on tingitud sekretsiooni ja/või insuliini toime efektiivsuse häiretest. Suhkurtõve korral areneva kroonilise hüperglükeemiaga kaasneb tüsistuste tekkimine paljudest elunditest ja süsteemidest, eelkõige südamest. veresooned, silmad, neerud ja närvid. Diabeedi all kannatab kokku 5-6% elanikkonnast. Maailma majanduslikult arenenud riikides suureneb diabeedihaigete arv iga 10-15 aasta järel 2 korda. Diabeedi oodatav eluiga väheneb 10-15%.
Diabeedi põhjused on väga erinevad. Enamikul juhtudest areneb diabeet kas absoluutse insuliinipuuduse tõttu (I tüüpi suhkurtõbi -. CD-1) või perifeersete kudede insuliinitundlikkuse vähenemise tõttu koos kõhunäärme β-rakkude sekretoorse düsfunktsiooniga. ( II tüüpi suhkurtõbi -. SD-2). Paljudel juhtudel on raske klassifitseerida patsienti SD-1 või SD-2 kategooriasse, kuid praktikas on siiski olulisem diabeedi kompenseerimine, mitte selle tüübi täpne määramine. Etioloogiline klassifikatsioon eristab nelja peamist diabeedi kliinilist klassi (tabel 7.1).
Enimlevinud CD-1 (jaotis 7.5), CD-2 (jaotis 7.6) ja rasedusdiabeet (jaotis 7.9) on käsitletud eraldi peatükkides. peal muud spetsiifilised tüübid moodustab vaid umbes 1% diabeedi juhtudest. Seda tüüpi suhkurtõve etioloogiat ja patogeneesi näib olevat rohkem uuritud kui CD-1 ja eriti CD-2. Paljud diabeedi variandid on tingitud monogeensest pärilikkusest funktsiooni geneetilised defektidβ -rakud. See hõlmab autosomaalse domineerivalt päriliku MODY sündroomi erinevaid variante (ingl. küpses eas noorte diabeet- täiskasvanute tüüpi diabeet noortel), mida iseloomustab rikkumine, kuid mitte insuliini sekretsiooni puudumine, perifeersete kudede normaalne tundlikkus selle suhtes.
Tab. 7.1. Klassifikatsioon suhkurtõbi
Kasuistlikult haruldane insuliini toime geneetilised defektid, seotud insuliiniretseptori mutatsiooniga (leprechaunism, Rabson-Mandecholli sündroom). Suhkurtõbi areneb loomulikul teel, kui eksokriinse pankrease haigused, mis põhjustab β-rakkude hävimist (pankreatiit, pankreatektoomia, tsüstiline fibroos, hemokromatoos), samuti mitmetes endokriinsed haigused, mille puhul esineb ülemäärane kontrainsulaarsete hormoonide tootmine (akromegaalia, Cushingi sündroom). Ravimid ja kemikaalid(vakor, pentamidiin, nikotiinhape, diasoksiid jne) põhjustavad harva diabeeti, kuid võivad insuliiniresistentsusega inimestel kaasa aidata haiguse avaldumisele ja dekompensatsioonile. Rida nakkushaigused(punetised, tsütomegaalia, Coxsackiev ja adenoviiruse infektsioon) võib kaasneda β-rakkude hävimine, samas kui enamikul patsientidest määratakse CD-1 immunogeneetilised markerid. TO haruldased vormid immuunvahendatud diabeet Nende hulka kuuluvad diabeet, mis areneb "jäik-rnan"-sündroomiga (autoimmuunne neuroloogiline haigus) patsientidel, aga ka diabeet, mis on tingitud kokkupuutest insuliiniretseptorite vastaste autoantikehadega. Erinevad valikud Sagedamini esineb suhkurtõbi,
paljud geneetilised sündroomid, eriti Downi sündroomiga, Klinefelteri, Turneri, Wolframi, Prader-Willi ja paljude teistega.
7.2. SÜSIVESIKUTE VAHETUSE FÜSIOLOOGIA KLIINILISED ASPEKTID
Insuliin sünteesitakse ja sekreteeritakse pankrease Langerhansi saarekeste (PZH) β-rakkude poolt. Lisaks eritavad Langerhansi saarekesed glükagooni (α-rakud), somatostatiini (δ-rakud) ja pankrease polüpeptiidi (PP-rakud). Hormoonid saarerakud toimivad üksteisega: glükagoon stimuleerib tavaliselt insuliini sekretsiooni ja somatostatiin pärsib insuliini ja glükagooni sekretsiooni. Insuliini molekul koosneb kahest polüpeptiidahelast (A-ahel - 21 aminohapet; B-ahel - 30 aminohapet) (joon. 7.1). Insuliini süntees algab preproinsuliini moodustumisega, mida proteaas lõhustab, moodustades proinsuliin. Golgi aparaadi sekretoorsetes graanulites lagundatakse proinsuliin insuliiniks ja C-peptiid, mis vabanevad eksotsütoosi käigus vereringesse (joon. 7.2).
Insuliini sekretsiooni peamine stimulaator on glükoos. Insuliin vabaneb vastusena vere glükoosisisalduse suurenemisele kahefaasiline(joon. 7.3). Esimene ehk äge faas kestab mitu minutit ja see on seotud kogunenud vabanemisega
 Riis. 7.1. Skeem esmane struktuur insuliini molekulid
Riis. 7.1. Skeem esmane struktuur insuliini molekulid
 Riis. 7.2. Insuliini biosünteesi skeem
Riis. 7.2. Insuliini biosünteesi skeem
insuliin β-rakkudes söögikordade vahel. Teine faas jätkub, kuni glükeemiline tase saavutab normaalse tühja kõhuga (3,3-5,5 mmol / l). Sulfonüüluurea preparaadid toimivad sarnaselt β-rakkudele.
Portaalisüsteemi kaudu jõuab insuliin maks- selle peamine sihtorgan. Maksa retseptorid seovad poole eritatavast hormoonist. Teine pool, sisenemine süsteemne verevool, jõuab lihastesse ja rasvkoesse. Suurem osa insuliinist (80%) läbib proteolüütilise lagunemise maksas, ülejäänu neerudes ja ainult väike kogus metaboliseeritakse otse lihas- ja rasvarakkude poolt. Tavaline eluiga
 Riis. 7.3. Kahefaasiline insuliini vabanemine glükoosiga
Riis. 7.3. Kahefaasiline insuliini vabanemine glükoosiga
täiskasvanu eritab 35-50 U insuliini ööpäevas, mis on 0,6-1,2 U 1 kg kehakaalu kohta. See sekretsioon jaguneb toiduks ja basaaliks. Toidu sekretsioon insuliin vastab söögijärgsele glükoositaseme tõusule, st. tänu sellele on tagatud toidu hüperglükeemilise toime neutraliseerimine. Toiduinsuliini kogus vastab ligikaudu sissevõetud süsivesikute kogusele - umbes 1-2,5 U
10-12 g süsivesikute kohta (1 leivaühik - XE). Basaalinsuliini sekretsioon tagab optimaalse glükeemia ja anabolismi taseme söögikordade vaheaegadel ja une ajal. Basaalinsuliini eritub kiirusega umbes 1 U / h; pikaajalise füüsilise aktiivsuse või pikaajalise tühja kõhuga väheneb see oluliselt. Toiduinsuliin moodustab vähemalt 50–70% päevasest insuliinitoodangust (joonis 7.4).
Insuliini sekretsiooni ei mõjuta mitte ainult toit, vaid ka iga päev
 Riis. 7 .4.
Igapäevase insuliini tootmise skeem on normaalne
Riis. 7 .4.
Igapäevase insuliini tootmise skeem on normaalne
kõikumised: insuliinivajadus suureneb varajastel hommikutundidel ja väheneb seejärel järk-järgult päeva jooksul. Nii eritub hommikusöögiks 1 XE jaoks 2,0-2,5 U insuliini, lõunasöögiks - 1,0-1,5 U ja õhtusöögiks - 1,0 U. Insuliinitundlikkuse muutuse üheks põhjuseks on mitmete vastuinsulaarsete hormoonide (peamiselt kortisooli) kõrge tase hommikul, mis langeb öö hakul järk-järgult miinimumini.
Peamine füsioloogilised mõjud insuliini on glükoosi ülekande stimuleerimine insuliinist sõltuvate kudede rakumembraanide kaudu. Insuliini peamised sihtorganid on maks, rasvkude ja lihased. Insuliinist sõltumatud kuded, mille varustamine glükoosiga ei sõltu insuliini toimest, hõlmavad peamiselt tsentraalseid ja perifeerseid kudesid. närvisüsteem, veresoonte endoteel, vererakud jne Insuliin stimuleerib glükogeeni sünteesi maksas ja lihastes, rasvade sünteesi maksas ja rasvkoes, valkude sünteesi maksas, lihastes ja teistes organites. Kõik need muutused on suunatud glükoosi ärakasutamisele, mis viib selle taseme languseni veres. Füsioloogiline insuliini antagonist on glükagoon, mis stimuleerib glükogeeni ja rasva mobiliseerimist depoost; Tavaliselt on glükagooni tase insuliini tootmisega vastastikune.
Insuliini bioloogilist toimet vahendavad retseptorid, mis paiknevad sihtrakkudel. Insuliiniretseptor on neljast subühikust koosnev glükoproteiin. Kõrge insuliinitasemega veres väheneb selle retseptorite arv vastavalt allareguleerimise põhimõttele, millega kaasneb raku tundlikkuse vähenemine insuliini suhtes. Pärast insuliini seondumist rakuretseptoriga siseneb moodustunud kompleks rakku. Lisaks põhjustab insuliin lihas- ja rasvarakkudes intratsellulaarsete vesiikulite mobilisatsiooni, mis sisaldavad glükoosi transportija GLUT-4. Selle tulemusena liiguvad vesiikulid raku pinnale, kus GLUT-4 toimib glükoosi sisselaskeavana. Sarnane tegevus füüsiline aktiivsus mõjutab GLUT-4.
7.3. DIABEEDI LABORATOORNE DIAGNOSTIKA JA HÜVITAMISKRITEERIUMID
Diabeedi laboratoorne diagnostika põhineb vere glükoosisisalduse määramisel, samas kui diagnostilised kriteeriumid on kõigile ühesugused.
DM tüübid ja variandid (tabel 7.2). Muude laboratoorsete analüüside (glükosuuria tase, glükeeritud hemoglobiini taseme määramine) andmeid ei tohi kasutada suhkurtõve diagnoosimiseks. Diabeedi diagnoosi saab panna kahe avastamise põhjal, millest üks kolm kriteeriumi:
1. Kell ilmsed sümptomid Suhkurtõbi (polüuuria, polüdipsia) ja glükoosisisaldus kapillaaride täisveres üle 11,1 mmol / l, olenemata kellaajast ja eelmisest söögikorrast.
2. Kui glükoosisisaldus kapillaari täisveres on tühja kõhuga üle 6,1 mmol / l.
3. Kapillaari täisvere glükoosisisaldusega 2 tundi pärast 75 grammi glükoosi allaneelamist (suukaudne glükoositaluvuse test) üle 11,1 mmol / l.
Tab. 7.2. Diabeedi diagnoosimise kriteeriumid
 Kõige olulisem ja oluline test Diabeedi diagnoosimisel on tühja kõhuga glükoosisisalduse määramine (vähemalt 8 tundi tühja kõhuga). Vene Föderatsioonis mõõdetakse glükeemilist taset tavaliselt täisveres. Glükoosi testimist kasutatakse laialdaselt paljudes riikides
Kõige olulisem ja oluline test Diabeedi diagnoosimisel on tühja kõhuga glükoosisisalduse määramine (vähemalt 8 tundi tühja kõhuga). Vene Föderatsioonis mõõdetakse glükeemilist taset tavaliselt täisveres. Glükoosi testimist kasutatakse laialdaselt paljudes riikides
vereplasmas. Suukaudne glükoositaluvuse test(OGTT; glükoositaseme määramine 2 tundi pärast 75 grammi vees lahustatud glükoosi sissevõtmist) omistatakse sellega seoses vähem tähtsust. Sellegipoolest diagnoositakse see OGTT põhjal halvenenud glükoositaluvus(NTG). IGT diagnoositakse, kui tühja kõhu täisvere kapillaarvere glükoosisisaldus ei ületa 6,1 mmol / l ja 2 tundi pärast glükoosi laadimist on see kõrgem kui 7,8 mmol / l, kuid alla 11,1 mmol / l. Teine võimalus süsivesikute ainevahetuse rikkumiseks on tühja kõhu glükeemia halvenemine(NGNT). Viimane tuvastatakse, kui kapillaaride täisvere glükeemiline tase tühja kõhuga on vahemikus 5,6-6,0 mmol / l ja 2 tundi pärast glükoosi laadimist on alla 7,8 mmol / l). NTG ja NGNT on praegu terminiga ühendatud prediabeet, kuna mõlemal patsientide kategoorial on kõrge risk suhkurtõve avaldumiseks ja diabeetilise makroangiopaatia tekkeks.
Diabeedi diagnoosimiseks tuleb glükeemia tase määrata standardsete laboratoorsete meetoditega. Glükeemiliste näitajate tõlgendamisel tuleb meeles pidada, et tühja kõhuga glükoosisisaldus tervikuna venoosne veri vastab selle tasemele kogu kapillaartorus. Pärast sööki või OGTT-d on selle tase venoosses veres ligikaudu 1,1 mmol / L madalam kui kapillaarveres. Plasma glükoosisisaldus on ligikaudu 0,84 mmol/l kõrgem kui täisveres. Diabeediravi kompenseerimise ja adekvaatsuse hindamiseks hinnatakse kaasaskantava kapillaarvere glükeemilist taset. glükomeetrid patsiendid ise, nende sugulased või meditsiinitöötajad.
Mis tahes tüüpi diabeediga, samuti olulise glükoosikoormusega, glükosuuria, mis on primaarsest uriinist glükoosi reabsorptsiooni läve ületamise tagajärg. Glükoosi reabsorptsiooni lävi varieerub oluliselt individuaalselt (≈ 9-10 mmol / l). Glükosuuriat ei tohi kasutada iseseisva indikaatorina suhkurtõve diagnoosimisel. Tavaliselt glükosuuriat ei esine, välja arvatud rafineeritud süsivesikute olulise toidukoormuse korral.
Tooted ketoonkehad(atsetoon, atsetoatsetaat, β-hüdroksübutüraat) intensiivistub oluliselt absoluutse insuliinipuuduse korral. SD-1 dekompensatsiooniga on väljendunud ketonuuria(uuritud uriiniga kastetavate testribadega). Kerge (jälg)ketonuuria võib tuvastada terved inimesed paastu ja süsivesikutevaba dieediga.
Tähtis labori näitaja, mida kasutatakse diabeeditüüpide diferentsiaaldiagnostikaks, samuti insuliinipuuduse tekke tuvastamiseks suhkurtõve-2-ga patsientidel, on tase. C-peptiid. C-peptiidi taseme järgi veres saab kaudselt hinnata kõhunäärme β-rakkude insuliini sekretsioonivõimet. Viimased toodavad proinsuliini, millest enne sekretsiooni eraldatakse C-peptiid, mis siseneb vereringesse võrdsetes kogustes insuliiniga. Insuliin seondub 50% ulatuses maksas ja selle poolväärtusaeg perifeerses veres on umbes 4 minutit. Maks ei eemalda C-peptiidi vereringest ja selle poolväärtusaeg veres on umbes 30 minutit. Lisaks ei seondu see perifeeria raku retseptoritega. Seetõttu on C-peptiidi taseme määramine usaldusväärsem test saareaparaadi funktsioonide hindamiseks. C-peptiidi taset on kõige informatiivsem uurida stimulatsioonitestide taustal (pärast sööki või glükagooni manustamist). Test ei ole informatiivne, kui see viiakse läbi suhkurtõve raske dekompensatsiooni taustal, kuna esineb raske hüperglükeemia. toksiline toimeβ-rakkudele (glükoosi toksilisus). Insuliinravi eelnevatel päevadel ei mõjuta testi tulemusi.
Põhiline ravi eesmärk mis tahes tüüpi suhkurtõbi on selle hiliste tüsistuste ennetamine, mida on võimalik saavutada mitmete parameetrite stabiilse kompenseerimise taustal (tabel 7.3). Diabeedi süsivesikute ainevahetuse kompenseerimise kvaliteedi peamine kriteerium on tase glükeeritud (glükosüülitud) hemoglobiin (HbA1c). Viimane on hemoglobiin, mis on glükoosiga mittekovalentselt seotud. Glükoos siseneb erütrotsüütidesse insuliinist sõltumatult ja hemoglobiini glükosüülimine on pöördumatu protsess ning selle aste on otseselt võrdeline glükoosi kontsentratsiooniga, millega see 120 päeva jooksul kokku puutus. Väike osa hemoglobiinist on glükosüülitud ja normaalne; diabeedi korral võib see oluliselt suureneda. HbA1c tase, erinevalt pidevalt muutuvast glükoositasemest, peegeldab lahutamatult glükeemiat viimase 3-4 kuu jooksul. Just sellise intervalliga on soovitatav määrata HbA1c tase, et hinnata suhkurtõve kompensatsiooni.
Krooniline hüperglükeemia ei ole kaugeltki ainus riskitegur diabeedi hiliste tüsistuste tekkeks ja progresseerumiseks. Mis puudutab SD hüvitise hindamine kompleksi põhjal
laboratoorsed ja instrumentaalsed uurimismeetodid (tabel 7.3). Lisaks süsivesikute ainevahetuse seisundit iseloomustavatele näitajatele, tase vererõhk ja vere lipiidide spekter.
Tab. 7.3. Diabeedi hüvitamise kriteeriumid
 Lisaks ülaltoodud kompensatsioonikriteeriumidele on diabeedi ravi eesmärkide kavandamisel vajalik individuaalne lähenemine... Diabeedi hiliste tüsistuste (eriti mikroangiopaatia) tekke ja progresseerumise tõenäosus suureneb koos haiguse kestusega. Seega, kui lastel ja noortel patsientidel, kelle diabeedikogemus võib tulevikus ulatuda mitmekümne aastani, on vaja saavutada optimaalsed glükeemilised parameetrid, siis patsientidel, kellel diabeet ilmnes vanemas ja vanemas eas, raske euglükeemiline kompensatsioon, mis oluliselt suurendab. hüpoglükeemia oht, mis ei ole alati asjakohane.
Lisaks ülaltoodud kompensatsioonikriteeriumidele on diabeedi ravi eesmärkide kavandamisel vajalik individuaalne lähenemine... Diabeedi hiliste tüsistuste (eriti mikroangiopaatia) tekke ja progresseerumise tõenäosus suureneb koos haiguse kestusega. Seega, kui lastel ja noortel patsientidel, kelle diabeedikogemus võib tulevikus ulatuda mitmekümne aastani, on vaja saavutada optimaalsed glükeemilised parameetrid, siis patsientidel, kellel diabeet ilmnes vanemas ja vanemas eas, raske euglükeemiline kompensatsioon, mis oluliselt suurendab. hüpoglükeemia oht, mis ei ole alati asjakohane.
7.4. INSULIINIPRREPARAADID JA INSULIINTERAVI
Insuliinipreparaadid on suhkurtõve-1 patsientide jaoks üliolulised; lisaks saavad neid kuni 40% suhkurtõvega patsientidest. Üldise juurde näidustused diabeedi insuliinravi määramiseks, millest paljud tegelikult kattuvad, hõlmavad järgmist:
1. 1. tüüpi suhkurtõbi
2. Pankreatektoomia
3. Ketoatsidootiline ja hüperosmolaarne kooma
4. II tüüpi diabeediga:
Ilmsed insuliinipuuduse tunnused, nagu progresseeruv kaalulangus ja ketoos, raske hüperglükeemia;
Suured kirurgilised sekkumised;
Ägedad makrovaskulaarsed tüsistused (insult, müokardiinfarkt, gangreen jne) ja rasked nakkushaigused, millega kaasneb süsivesikute metabolismi dekompensatsioon;
tühja kõhu glükeemia tase on üle 15-18 mmol / l;
Stabiilse hüvitise puudumine, vaatamata erinevate tablettidega antihüperglükeemiliste ravimite maksimaalsete ööpäevaste annuste määramisele;
Diabeedi hiliste komplikatsioonide hilised staadiumid (raske polüneuropaatia ja retinopaatia, krooniline neerupuudulikkus).
5. Rasedusdiabeedi hüvitamise ebaõnnestumine dieediteraapia abil.
Päritolu järgi Insuliinipreparaadid võib jagada kolme rühma:
loomsed insuliinid (sealiha);
Inimese insuliinid (poolsünteetilised, geneetiliselt muundatud);
Insuliini analoogid (lispro, aspart, glargiin, detemiir).
Iniminsuliini tootmise tehnoloogia areng on viinud selleni, et kasutatakse sealiha insuliin(erineb inimesest ühe aminohappe poolest) on viimasel ajal oluliselt vähenenud. Seainsuliini saab kasutada iniminsuliini valmistamiseks poolsünteetiline meetod, mis tähendab ühe erineva aminohappe asendamist selle molekulis. Enamik kõrge kvaliteet erinevad geenitehnoloogia iniminsuliinid. Nende saamiseks seostatakse osa inimese genoomist, mis vastutab insuliini sünteesi eest, genoomiga E. coli või pärmikultuuri, mille tulemusena hakkavad viimased tootma humaaninsuliini. Loomine insuliini analoogid erinevate aminohapete permutatsioonide abil oli eesmärgiks saada etteantud ja soodsaima farmakokineetikaga ravimeid. Niisiis, insuliin lispro (Humalog) on analoog
insuliin ultra lühinäitlemine, samas kui selle hüpoglükeemiline toime avaldub juba 15 minutit pärast süstimist. Insuliini analoog glargiini (Lantus) seevastu iseloomustab pikaajaline toime, mis kestab kogu päeva, samas kui ravimi kineetika eripära on plasmakontsentratsiooni väljendunud piikide puudumine. Enamik praegu kasutatavaid insuliinipreparaate ja selle analooge on toodetud aastal kontsentratsioon 100 U / ml. Kõrval toime kestus insuliinid on jagatud 4 põhirühma (tabel 7.4):
Tab. 7.4. Ravimite ja insuliini analoogide farmakokineetika
 1.
Väga lühikese toimeajaga (lispro, aspart).
1.
Väga lühikese toimeajaga (lispro, aspart).
2. Lühitoimeline (lihtne humaaninsuliin).
3. Keskmine toimeaeg (insuliinid Hagedorni neutraalsel protamiinil).
4. Pikatoimeline (glargiin, detemiir).
5. Erineva toimeajaga insuliinide segud (Novomix-30, Humulin-MZ, Humalog-Mix-25).
Narkootikumid ülilühike tegevus[lispro (Humalog), aspart (Novorapid)] on insuliini analoogid. Nende eelised on kiire areng hüpoglükeemiline toime pärast süstimist (15 minuti pärast), mis võimaldab teil süstida vahetult enne sööki või isegi vahetult pärast sööki, samuti lühike toimeaeg (alla 3 tunni), mis vähendab hüpoglükeemia riski. Narkootikumid lühinäitlemine(lihtinsuliin, tavaline insuliin) on lahus, mis sisaldab insuliini kontsentratsioonis 100 U / ml. Lihtne insuliinisüst tehakse 30 minutit enne sööki; toime kestus on umbes 4-6 tundi. Ülilühikese ja lühitoimelise toimega ravimeid võib manustada subkutaanselt, intramuskulaarselt ja intravenoosselt.
Narkootikumide hulgas keskmine kestus toimingud kõige sagedamini kasutatavad ravimid on Hagedorni neutraalne protamiin (NPH). NPH on valk, mis adsorbeerib insuliini mittekovalentselt, aeglustades selle imendumist nahaalusest depoost. NPH-insuliinide efektiivne toimeaeg on tavaliselt umbes 12 tundi; neid süstitakse ainult subkutaanselt. Insuliin NPH on suspensioon ja seetõttu erinevalt viaalis olevast lihtinsuliinist on see hägune ja pikaajalisel seismisel moodustub suspensioon, mida tuleb enne süstimist põhjalikult segada. Erinevalt teistest toimeainet prolongeeritult vabastavatest ravimitest võib NPH-insuliine segada mis tahes vahekorras lühitoimelise insuliiniga (lihtinsuliin), samas kui segu komponentide farmakokineetika ei muutu, kuna NPH ei seo täiendavaid koguseid lihtinsuliini (joonis 1). 7.5). Lisaks kasutatakse protamiini standardsete insuliini analoogide segude valmistamiseks (Novomix-30, Humalog-Mix-25).
Narkootikumide hulgas pika näitlejatööga kasutavad praegu aktiivselt insuliini analooge glargiin(Lantus) ja detemir(Levemir). Nende ravimite farmakokineetika eeliseks on see, et erinevalt NPH-insuliinidest tagavad nad ühtlasema ja pikemaajalisema ravimi sissevõtmise nahaalusest depoost. Sellega seoses võib glargiini määrata ainult üks kord päevas ja praktiliselt sõltumata kellaajast.
 Riis. 7.5. Farmakokineetika erinevad ravimid insuliin:
Riis. 7.5. Farmakokineetika erinevad ravimid insuliin:
a) ühekomponentne; b) insuliini standardsed segud
Lisaks ühekomponentsetele insuliinipreparaatidele kliiniline praktika laialdaselt kasutatud standardsed segud. Tavaliselt, see tuleb lühikese või ülilühikese insuliini segude kohta keskmise toimeajaga insuliiniga. Näiteks ravim "Humulin-MZ" sisaldab ühes pudelis 30% lihtsat insuliini ja 70% NPH insuliini; ravim "Novomix-30" sisaldab 30% aspartinsuliini ja 70% aspartinsuliini kristalset protamiini suspensiooni; ravim "Humalog-Mix-25" sisaldab 25% insuliini lispro ja 75% protamiini suspensiooni insuliini lispro. Eelis
standardsed insuliinisegud on kahe ühe süsti asendamine ja segu komponentide annuste pisut suurem täpsus; puuduseks on segu üksikute komponentide individuaalse doseerimise võimatus. See määrab eelistuse kasutada DM-2 raviks insuliini standardseid segusid või nn traditsiooniline insuliinravi(insuliini fikseeritud annuste määramine), samas kui intensiivne insuliinravi(paindlik annuse valik sõltuvalt glükeemilistest näitajatest ja süsivesikute hulgast toidus), eelistatav on ühekomponentsete preparaatide kasutamine.
Eduka insuliinravi võti on selle range järgimine süstimistehnikad. Insuliini manustamiseks on mitu võimalust. Lihtsaim ja usaldusväärseim meetod on insuliini süstimine. süstal. Rohkem mugaval viisil insuliini süstid on süstid kasutades süstla pliiatsid, mis on kombineeritud seade, mis sisaldab insuliinimahutit (padrunit), doseerimissüsteemi ja süstlanõela.
Säilitusraviks (kui me ei räägi diabeedi raskest dekompensatsioonist või kriitilistest seisunditest) süstitakse insuliini subkutaanselt. Lühitoimelise insuliini süstimine on soovitatav kõhupiirkonna nahaalusesse rasvkoesse, pikaajalise toimega insuliini süstimine aga reie- või õlakudedesse (joonis 7.6 a). Süstid tehakse sügavale nahaalusesse koesse läbi laialt kokkusurutud naha 45° nurga all (joonis 7.6 b). Patsienti tuleb soovitada vahetada insuliini süstekohti iga päev samas piirkonnas, et vältida lipodüstroofia teket.
TO tegurid, mis mõjutavad insuliini imendumise kiirust subkutaansest depoost tuleb määrata insuliini annus (annuse suurendamine pikendab imendumise kestust), süstekoht (kõhukoest kiirem imendumine), temperatuur keskkond(soojendamine ja süstekoha masseerimine kiirendab imendumist).
Keerulisem manustamisviis, mis paljudel patsientidel siiski võimaldab saavutada häid tulemusi ravi on kasutamine insuliini dosaator, või süsteem insuliini pidevaks subkutaanseks manustamiseks. Dosaator on kaasaskantav seade, mis koosneb arvutist, mis määrab insuliini manustamise režiimi, samuti insuliini manustamissüsteemist, mida juhitakse läbi kateetri ja miniatuurse hüpodermilise nõela.
 Riis. 7.6. Insuliini süstid: a) tüüpilised süstekohad; b) insuliinisüstla nõela asukoht süstimise ajal
Riis. 7.6. Insuliini süstid: a) tüüpilised süstekohad; b) insuliinisüstla nõela asukoht süstimise ajal
rasvkude. Dosaatori abil viiakse läbi lühitoimelise või ülilühitoimelise insuliini pidev basaalmanustamine (kiirus on umbes 0,5-1 U / tund) ja enne sööki, olenevalt süsivesikute sisaldusest ja glükeemia tasemeni, manustab patsient sama lühitoimelise insuliini vajaliku boolusannuse. Dosaatoriga insuliinravi eeliseks on ainult lühikese (või isegi ülilühikese) insuliini manustamine, mis iseenesest on mõnevõrra füsioloogilisem, kuna pikaajaliste insuliinipreparaatide imendumine on suur kõikumine; sellega seoses näib lühitoimelise insuliini pidev manustamine olevat paremini juhitav protsess. Dosaatoriga insuliinravi miinuseks on aparaadi pideva kandmise vajadus, samuti pikka viibimist süstenõel sisse nahaalune kude mis nõuavad insuliini manustamisprotsessi perioodilist jälgimist. Insuliinravi dosaatoriga on näidustatud peamiselt suhkurtõve-1 patsientidele, kes on valmis selle manustamistehnikat valdama. Eriti tuleks sellega seoses tähelepanu pöörata patsientidele, kellel on väljendunud "hommikuse koidiku" nähtus, samuti rasedatele ja rasedust planeerivatele suhkurtõvega patsientidele ning patsientidele.
häiritud eluviisiga inimesed (paindlikuma toitumise võimalus).
7.5. 1. TÜÜP DIABEEDI
SD-1 - elundispetsiifiline autoimmuunne haigus, mis põhjustab pankrease saarekeste insuliini tootvate β-rakkude hävimist, mis väljendub absoluutses insuliinipuuduses. Mõnel juhul puuduvad ilmse CD-1-ga patsientidel autoimmuunse β-rakkude kahjustuse markerid (idiopaatiline CD-1).
Etioloogia
CD-1 on haigus, millel on pärilik eelsoodumus, kuid selle panus haiguse arengusse on väike (määrab selle arengu umbes 1 / h võrra). SD-1 identsete kaksikute vastavus on vaid 36%. Tõenäosus haige emaga lapsel haigestuda DM-1 on 1-2%, isal - 3-6%, vennal või õel - 6%. Üks või mitu β-rakkude autoimmuunse kahjustuse humoraalset markerit, mis hõlmavad pankrease saarekeste antikehi, glutamaadi dekarboksülaasi (GAD65) ja türosiinfosfataasi (IA-2 ja ΙΑ-2β) vastaseid antikehi, on leitud 85-st. 90% patsientidest... Sellegipoolest on β-rakkude hävitamisel peamine roll rakulise immuunsuse teguritel. CD-1 on seotud selliste HLA haplotüüpidega nagu DQA ja DQB, mõne alleeliga HLA-DR / DQ võivad soodustada haiguse arengut, samas kui teised on kaitsvad. Suurenenud sagedusega kombineeritakse CD-1 teiste autoimmuunsete endokriinsete (autoimmuunne türeoidiit, Addisoni tõbi) ja mitte-endokriinsete haigustega, nagu alopeetsia, vitiliigo, Crohni tõbi, reumaatilised haigused (tabel 7.5).
Patogenees
CD-1 avaldub siis, kui autoimmuunprotsessi käigus hävib 80-90% β-rakkudest. Selle protsessi kiirus ja intensiivsus võivad oluliselt erineda. Kõige sagedamini koos tüüpiline kursus laste ja noorte haiguste puhul kulgeb see protsess üsna kiiresti, millele järgneb haiguse äge ilming, mille puhul võib esimeste kliiniliste sümptomite ilmnemisest ketoatsidoosi tekkeni (kuni ketoatsidootilise koomani) mööduda vaid mõni nädal.
Tab. 7.5. 1. tüüpi suhkurtõbi
 Tabeli jätk. 7.5
Tabeli jätk. 7.5
 Teistes palju rohkem harvad juhud tavaliselt üle 40-aastastel täiskasvanutel võib haigus olla varjatud (latentne autoimmuunne diabeet täiskasvanutel – LADA), Samal ajal diagnoositakse sellistel patsientidel sageli haiguse alguses suhkurtõbi-2 ja mitme aasta jooksul on võimalik diabeedi kompenseerida sulfonüüluureate määramisega. Kuid tulevikus, tavaliselt 3 aasta pärast, ilmnevad absoluutse insuliinipuuduse tunnused (kaalulangus, ketonuuria, raske hüperglükeemia, hoolimata tablettide võtmisest diabeediravimitest).
Teistes palju rohkem harvad juhud tavaliselt üle 40-aastastel täiskasvanutel võib haigus olla varjatud (latentne autoimmuunne diabeet täiskasvanutel – LADA), Samal ajal diagnoositakse sellistel patsientidel sageli haiguse alguses suhkurtõbi-2 ja mitme aasta jooksul on võimalik diabeedi kompenseerida sulfonüüluureate määramisega. Kuid tulevikus, tavaliselt 3 aasta pärast, ilmnevad absoluutse insuliinipuuduse tunnused (kaalulangus, ketonuuria, raske hüperglükeemia, hoolimata tablettide võtmisest diabeediravimitest).
CD-1 patogenees, nagu näidatud, põhineb absoluutsel insuliinipuudusel. Glükoosi võimetus siseneda insuliinist sõltuvatesse kudedesse (rasv ja lihased) põhjustab energiapuudust, mille tulemusena intensiivistuvad lipolüüs ja proteolüüs, mis on seotud kehakaalu langusega. Glükeemia taseme tõus põhjustab hüperosmolaarsust, millega kaasneb osmootne diurees ja tõsine dehüdratsioon. Insuliinipuuduse ja energiapuuduse tingimustes on kontrainsulaarsete hormoonide (glükagoon, kortisool, kasvuhormoon) tootmine inhibeeritud, mis vaatamata suurenevale glükeemiale põhjustab glükoneogeneesi stimuleerimist. Suurenenud lipolüüs rasvkoes põhjustab vabade ainete kontsentratsiooni märkimisväärset suurenemist rasvhapped... Insuliinipuuduse korral on maksa liposünteesivõime pärsitud ja
rasvhapped hakkavad ketogeneesis osalema. Ketoonkehade kuhjumine põhjustab diabeetilise ketoosi ja tulevikus ketoatsidoosi arengut. Dehüdratsiooni ja atsidoosi progresseeruva suurenemisega tekib kooma (vt p 7.7.1), mis insuliinravi ja rehüdratsiooni puudumisel lõppeb paratamatult surmaga.
Epidemioloogia
DM-1 moodustab ligikaudu 1,5-2% kõigist diabeedijuhtudest ja see suhteline näitaja väheneb veelgi tänu DM-2 esinemissageduse kiirele kasvule. Eluaegne risk haigestuda CD-1 valge rassi puhul on umbes 0,4%. DM-1 esinemissagedus suureneb 3% aastas: 1,5% - uute juhtumite tõttu ja veel 1,5% - patsientide oodatava eluea pikenemise tõttu. CD-1 levimus varieerub sõltuvalt elanikkonna etnilisest koosseisust. 2000. aastal oli see Aafrikas 0,02%, Lõuna-Aasias, aga ka Lõuna- ja Kesk-Ameerikas 0,1% ning Euroopas ja Põhja-Ameerikas 0,2%. Kõige suurem on DM-1 esinemissagedus Soomes ja Rootsis (30-35 juhtu 100 tuhande elaniku kohta aastas), madalaim Jaapanis, Hiinas ja Koreas (vastavalt 0,5-2,0 juhtu). SD-1 manifestatsiooni vanuse tippaeg vastab ligikaudu 10-13 eluaastale. Enamikul juhtudest avaldub CD-1 enne 40. eluaastat.
Kliinilised ilmingud
V tüüpilised juhtumid, eriti lastel ja noortel debüteerib CD-1 ereda kliinilise pildiga, mis areneb mitme kuu või isegi nädala jooksul. CD-1 manifestatsiooni võivad provotseerida nakkus- ja muud kaasuvad haigused. On iseloomulikud kõikidele diabeeditüüpidele omased sümptomid, seotud hüperglükeemiaga: polüdipsia, polüuuria, sügelev nahk, kuid SD-1 puhul on need väga väljendunud. Seega saavad patsiendid kogu päeva jooksul juua ja eritada kuni 5-10 liitrit vedelikku. Konkreetne CD-1 puhul on absoluutsest insuliinipuudusest tingitud sümptomiks kaalulangus, mis jõuab 1-2 kuu jooksul 10-15 kg-ni. Iseloomustab väljendunud üldine ja lihaste nõrkus, vähenenud jõudlus, unisus. Haiguse alguses võib mõnel patsiendil tekkida söögiisu suurenemine, mis ketoatsidoosi tekkimisel asendub anoreksiaga. Viimast iseloomustab atsetoonilõhna (või puuviljalõhna) ilmumine suust,
märkus, oksendamine, sageli kõhuvalu (pseudoperitoniit), tõsine dehüdratsioon ja lõpeb arenguga kooma(vt p 7.7.1). Mõnel juhul on CD-1 esimene ilming lastel taustal progresseeruv teadvuse kahjustus kuni koomani. kaasnevad haigused tavaliselt nakkuslik või äge kirurgiline patoloogia.
Suhteliselt harvadel juhtudel on CD-1 väljakujunemine üle 35-40-aastastel inimestel (varjatud autoimmuunne diabeet täiskasvanutel) haigus võib avalduda vähem erksalt (mõõdukas polüdipsia ja polüuuria, kaalulangus puudub) ja avastada isegi juhuslikult rutiinse glükeemilise taseme määramise käigus. Nendel juhtudel diagnoositakse patsiendil sageli alguses suhkurtõbi-2 ja määratakse tablettidena antihüperglükeemilised ravimid (TSP), mis mõneks ajaks pakuvad diabeedi vastuvõetavat kompensatsiooni. Sellegipoolest tekivad patsiendil mitme aasta jooksul (sageli aasta jooksul) kasvavast absoluutsest insuliinipuudusest tingitud sümptomid: kehakaalu langus, võimetus säilitada normaalset glükeemiat TSP taustal, ketoos ja ketoatsidoos.
Diagnostika
Arvestades, et CD-1-l on ere kliiniline pilt ja ka suhteliselt haruldane haigus, ei ole näidatud glükeemia taseme sõeluuringut DM-1 diagnoosimiseks. Patsientide lähimate sugulaste haigestumise tõenäosus on väike, mis koos tõhusate meetodite puudumisega esmane ennetus CD-1 määrab neis haiguse immunogeneetiliste markerite uurimise ebaotstarbekuse. CD-1 diagnoos põhineb valdaval enamusel juhtudest olulise hüperglükeemia tuvastamisel patsientidel, kellel on absoluutse insuliinipuuduse rasked kliinilised ilmingud. OGTT-d T1DM diagnoosimiseks tuleb teha väga harva.
Kahtlastel juhtudel (keskmise raskusega hüperglükeemia tuvastamine ilmsete kliiniliste ilmingute puudumisel, manifestatsioon suhteliselt keskeas), samuti diferentsiaaldiagnostika eesmärgil teiste diabeeditüüpide korral on veresuhkru tase. C-peptiid(basaal ja 2 tundi pärast söömist). Kahtlastel juhtudel võib kaudne diagnostiline väärtus omada määratlust immunoloogilised markerid CD-1 - saarekeste antikehad
PLL, glutamaadi dekarboksülaasiks (GAD65) ja türosiinfosfataasiks (IA-2 ja IA-2β). CD-1 ja CD-2 diferentsiaaldiagnoos on esitatud tabelis. 7.6.
Tab. 7.6. Diferentsiaaldiagnoos ja erinevused CD-1 ja CD-2 vahel
 Ravi
Ravi
Mis tahes tüüpi diabeedi ravi põhineb kolmel põhiprintsiibil: glükoosisisaldust langetav ravi (diabeediga-1 - insuliinravi), dieet ja patsiendi koolitus. Insuliinravi SD-1 kuludega asenduslik iseloom ja selle eesmärk on maksimeerida hormooni füsioloogilise tootmise imiteerimist, et saavutada aktsepteeritud kompensatsioonikriteeriumid (tabel 7.3). Insuliini füsioloogiline sekretsioon on kõige lähemal intensiivne insuliinravi. Temale vastav insuliinivajadus basaalsekretsioon, varustatud kahe keskmise toimeajaga insuliini süstiga (hommikul ja õhtul) või ühe pikatoimelise insuliini (glargiini) süstiga. Basaalinsuliini koguannus
lina ei tohiks ületada poolt ravimi ööpäevasest koguvajadusest. Toitumis- või boolusinsuliini sekretsioon asendatakse lühi- või ülilühitoimelise insuliini süstimisega enne iga sööki, samas kui selle annus arvutatakse eelseisva söögikorra ajal tarbitava süsivesikute koguse ja glükeemia hetketaseme alusel, mille määrab patsient kasutab glükomeetrit enne iga insuliinisüsti (joonis 7.7).
Soovituslik intensiivne insuliinravi režiim, mis muutub peaaegu iga päev, võib kujutada järgmiselt. Lähtuge sellest, et igapäevane vajadus insuliinis on umbes 0,5-0,7 U 1 kg kehakaalu kohta (70 kg kaaluval patsiendil umbes 35-50 U). Umbes 1/3–1/2 sellest annusest moodustab pikatoimeline insuliin (20–25 U), 1/2–2/3 lühitoimelist või ülilühitoimelist insuliini. NPH-insuliini annus jagatakse 2 süstiks: hommikul 2/3 annusest (12 U), õhtul - 1/3 (8-10 U).
Eesmärk esimene aste Insuliinravi valik on tühja kõhuga glükoositaseme normaliseerimine. NPH-insuliini õhtune annus manustatakse tavaliselt kell 10–23 hommikul koos lühitoimelise insuliinisüstiga enne hommikusööki. NPH-insuliini õhtuse annuse valimisel tuleb silmas pidada võimalust mitmete
 Riis. 7.7. Intensiivne insuliinravi režiim
Riis. 7.7. Intensiivne insuliinravi režiim
piisavalt tüüpilisi nähtusi. Hommikuse hüperglükeemia põhjuseks võib olla pikaajalise toimeajaga insuliini ebapiisav annus, kuna hommikuks suureneb insuliinivajadus märkimisväärselt ("hommiku koidu" fenomen). Lisaks ebapiisavale annusele võib selle liig põhjustada hommikust hüperglükeemiat - Somoji fenomen(Somogyi), hüpoglükeemiline hüperglükeemia. Seda nähtust seletatakse asjaoluga, et kudede maksimaalset tundlikkust insuliini suhtes täheldatakse kella 2.–4. Just sel ajal on peamiste saarevastaste hormoonide (kortisool, kasvuhormoon jne) tase tavaliselt madalaim. Kui prolongeeritult vabastava insuliini õhtune annus on ülemäärane, tekib sel ajal hüpoglükeemia. Kliiniliselt võib see väljenduda halva unena koos õudusunenägudega, teadvuseta tegudega une ajal, hommikuse peavalu ja väsimusena. Hüpoglükeemia areng põhjustab sel ajal glükagooni ja teiste saarevastaste hormoonide märkimisväärset kompenseerivat vabanemist, millele järgneb hüperglükeemia hommikul. Kui sellises olukorras, mitte vähendada, vaid suurendada õhtul manustatava pikaajalise toimeajaga insuliini annust, süvenevad öine hüpoglükeemia ja hommikune hüperglükeemia, mis võib lõpuks viia kroonilise insuliini üleannustamise sündroomini (Somoji sündroom), mis on kombinatsioon rasvumine koos suhkurtõve kroonilise dekompensatsiooniga, sagedane hüpoglükeemia ja progresseeruvad hilised tüsistused. Somoji fenomeni diagnoosimiseks on vaja uurida glükeemia taset umbes kell 3 öösel, mis on insuliinravi valiku lahutamatu osa. Kui õhtuse NPH annuse vähendamisega öise hüpoglükeemia tekke seisukohalt ohutuks kaasneb hommikune hüperglükeemia (koidiku nähtus), tuleb patsiendil soovitada tõusta varem (kell 6-7). öösel manustatud insuliin säilitab endiselt normaalse glükeemilise taseme.
Teine NPH-insuliini süst tehakse tavaliselt enne hommikusööki koos hommikuse lühitoimelise (ülilühikese) insuliini süstimisega. Sel juhul valitakse annus peamiselt glükeemia taseme näitajate põhjal enne peamisi igapäevaseid söögikordi (lõunasöök, õhtusöök); lisaks võib seda piirata hüpoglükeemia tekkimine söögikordade vaheaegadel, näiteks keskpäeval, hommiku- ja lõunasöögi vahel.
Terve insuliini annus pikaajaline tegevus(glargiini) manustatakse üks kord päevas, pole vahet, mis kell. Kineetika
glargiininsuliin ja detemir on hüpoglükeemia, sealhulgas öise hüpoglükeemia riski seisukohalt soodsamad.
Lühi- või ülilühitoimelise insuliini annus isegi patsiendi esimesel insuliini manustamispäeval sõltub tarbitud süsivesikute kogusest ( teraviljaühikud) ja vere glükoosisisaldust enne süstimist. Tavapäraselt võetakse insuliini sekretsiooni normaalse ööpäevase rütmi alusel umbes 1/4 lühitoimelise insuliini annusest (6-8 U) õhtusöögiks, ülejäänud annus jagatakse ligikaudu võrdselt hommiku- ja lõunasöögiks (10-12 U). ). Mida kõrgem on algne glükeemiline tase, seda vähem see langeb manustatud insuliiniühiku kohta. Lühitoimelist insuliini süstitakse 30 minutit enne sööki, ülilühitoimelist insuliini vahetult enne sööki või isegi vahetult pärast sööki. Lühitoimelise insuliini annuse piisavust hinnatakse glükeemiliste näitajate järgi 2 tundi pärast sööki ja enne järgmist söögikorda.
Insuliini annuse arvutamiseks intensiivse insuliinravi jaoks piisab XE arvu arvutamisest ainult süsivesikute komponendi põhjal. Sel juhul ei lähe arvesse mitte kõik süsivesikuid sisaldavad toidud, vaid ainult nn loendatud. Viimaste hulka kuuluvad kartul, teraviljad, puuviljad, vedelad piimatooted ja suhkrurikkad toidud. Seedimatuid süsivesikuid (enamik köögivilju) sisaldavad toidud arvutusse ei võeta. Välja on töötatud spetsiaalsed vahetustabelid, mille abil, väljendades süsivesikute kogust XE-s, saab välja arvutada vajaliku insuliiniannuse. Üks XE vastab 10-12 g süsivesikutele (tabel 10.7).
Pärast 1 XE-d sisaldavat sööki tõuseb glükeemiline tase 1,6-2,2 mmol / l, s.o. umbes sama palju, kui glükoosi tase väheneb 1 U insuliini manustamisel. Teisisõnu, iga plaanitavas toidus sisalduva XE kohta on vaja eelnevalt sisestada (olenevalt kellaajast) umbes 1 U insuliini. Lisaks tuleb arvesse võtta glükeemia taseme enesekontrolli tulemusi, mis tehakse enne iga süsti, ja kellaaega (umbes 2 ühikut insuliini 1 XE kohta hommikul ja lõuna ajal, 1 ühik 1 XE eest õhtusöögiks). Seega, kui tuvastatakse hüperglükeemia, tuleb eelseisva söögikorra (vastavalt XE numbrile) arvutatud insuliini annust suurendada ja vastupidi, hüpoglükeemia tuvastamisel manustatakse insuliini vähem.
Tab. 7.7. 1 XE moodustavate toodete samaväärne asendamine
 Näiteks kui patsiendi glükeemiline tase on 7 mmol/L 30 minutit enne planeeritud õhtusööki, mis sisaldab 5 XE-d, peab ta süstima 1 U insuliini, et glükeemia väheneks. normaalne tase: 7 mmol/l kuni umbes 5 mmol/l. Lisaks tuleb 5 XE kattekihile süstida 5 U insuliini. Seega süstib patsient sel juhul 6 U lühitoimelist või ülilühitoimelist insuliini.
Näiteks kui patsiendi glükeemiline tase on 7 mmol/L 30 minutit enne planeeritud õhtusööki, mis sisaldab 5 XE-d, peab ta süstima 1 U insuliini, et glükeemia väheneks. normaalne tase: 7 mmol/l kuni umbes 5 mmol/l. Lisaks tuleb 5 XE kattekihile süstida 5 U insuliini. Seega süstib patsient sel juhul 6 U lühitoimelist või ülilühitoimelist insuliini.
Pärast CD-1 avaldumist ja insuliinravi alustamist piisavalt pikka aega võib insuliinivajadus olla väike ja alla 0,3-0,4 U / kg. Seda perioodi nimetatakse remissioonifaasiks või "Mesinädalad". Pärast hüperglükeemia ja ketoatsidoosi perioodi, mis pärsivad insuliini sekretsiooni 10–15% ülejäänud β-rakkudest, taastab hormonaalsete metaboolsete häirete kompenseerimine insuliini manustamisega nende rakkude funktsiooni, mis seejärel võtavad üle nende varustamise. insuliiniga minimaalsel tasemel. See periood võib kesta mitu nädalat kuni mitu aastat, kuid lõppkokkuvõttes saab mesinädalad allesjäänud β-rakkude autoimmuunse hävimise tõttu läbi.
Dieet DM-1-ga treenitud patsientidel, kellel on enesekontrolli ja insuliiniannuse valiku oskused, saab seda liberaliseerida, st. läheneb vabaks. Kui patsient ei ole ülekaaluline või alakaaluline, peaks dieet olema
isokaloriline. CD-1-ga toidu põhikomponendiks on süsivesikud, mis peaksid moodustama umbes 65% päevasest kaloraažist. Eelistada tuleks toiduaineid, mis sisaldavad kompleksseid, aeglaselt imenduvaid süsivesikuid, aga ka kiudainerikkaid toite. Vältida tuleks kergesti seeditavaid süsivesikuid sisaldavaid toite (jahu, magus). Valkude osakaalu tuleks vähendada 10-35%-ni, mis aitab vähendada mikroangiopaatia tekkeriski ja rasvade osakaalu - kuni 25-35%-ni, samas kui rasvade piiramine peaks moodustama kuni 7% kaloritest, mis. vähendab ateroskleroosi riski. Lisaks on vaja hoiduda võtmisest alkohoolsed joogid, eriti tugev.
CD-1-ga patsiendiga töötamise lahutamatu osa ja selle tõhusa kompenseerimise võti on patsiendi koolitus. Kogu oma elu jooksul peab patsient iga päev iseseisvalt, sõltuvalt paljudest teguritest, insuliini annust muutma. Ilmselgelt nõuab see teatud oskuste valdamist, mida tuleb patsiendile õpetada. "SD-1 patsiendi kool" korraldatakse endokrinoloogiahaiglates või ambulatoorselt ja koosneb 5-7 struktureeritud sessioonist, mille käigus arst või eriväljaõppega õde õpetab interaktiivselt, kasutades erinevaid visuaalseid abivahendeid, patsiendile ravi põhimõtteid. enesekontroll.
Prognoos
Insuliinravi puudumisel sureb CD-1-ga patsient paratamatult ketoatsidootsesse koomasse. Ebapiisava insuliinravi korral, mille taustal ei saavutata diabeedi kompenseerimise kriteeriume ja patsient on kroonilise hüperglükeemia seisundis (tabel 7.3), hakkavad arenema ja progresseeruma hilised tüsistused (jaotis 7.8). SD-1-ga on suurim kliiniline tähtsus sellega seoses on neil diabeetilise mikroangiopaatia (nefropaatia ja retinopaatia) ja neuropaatia (diabeetilise jala sündroom) ilmingud. Makroangiopaatia DM-1 puhul tuleb esile suhteliselt harva.
7.6. 2. TÜÜP DIABEEDI
II tüüpi suhkurtõbi- krooniline haigus, mis väljendub süsivesikute metabolismi rikkumises koos hüperglükeemia tekkega insuliiniresistentsuse ja β-rakkude sekretoorse düsfunktsiooni tõttu,
samuti lipiidide metabolismi ateroskleroosi tekkega. Kuna patsientide peamine surma- ja puude põhjus on süsteemse ateroskleroosi tüsistused, nimetatakse CD-2 mõnikord ka südame-veresoonkonna haiguseks.
Tab. 7.8. II tüüpi suhkurtõbi
 Etioloogia
Etioloogia
DM-2 on päriliku eelsoodumusega multifaktoriaalne haigus. SD-2 järgi ulatub identsetel kaksikutel 80% või rohkem. Enamik T2DM-ga patsiente viitab T2DM-i esinemisele nende lähedastel; CD-2 olemasolul ühel vanemal on selle arengu tõenäosus järglastel kogu elu jooksul 40%. Ühtegi geeni, mille polümorfism määrab CD-2 eelsoodumuse, pole leitud. Suur tähtsus CD-2 päriliku eelsoodumuse realiseerimisel mängivad keskkonnategurid ennekõike eluviisi iseärasusi. DM-2 tekke riskifaktorid on:
Rasvumine, eriti vistseraalne rasvumine (vt punkt 11.2);
etnilisus (eriti traditsioonilise eluviisi muutmisel läänelikuks);
Istuv eluviis;
Dieedi omadused (suur rafineeritud süsivesikute tarbimine ja madal sisaldus kiudained);
Arteriaalne hüpertensioon.
Patogenees
Patogeneetiliselt on CD-2 heterogeenne metaboolsete häirete rühm ja see määrab selle olulise kliinilise heterogeensuse. Selle patogenees põhineb insuliiniresistentsusel (insuliini vahendatud glükoosi kasutamise vähenemine kudedes), mis realiseerub β-rakkude sekretoorse düsfunktsiooni taustal. Seega on insuliinitundlikkuse ja insuliini sekretsiooni tasakaalustamatus. Sekretsiooni düsfunktsioonβ -rakud on aeglustada insuliini "varajast" sekretoorset vabanemist vastusena vere glükoositaseme tõusule. Sel juhul sekretsiooni 1. (kiire) faas, mis seisneb vesiikulite tühjendamises kogunenud insuliiniga, praktiliselt puudub; Sekretsiooni teine (aeglane) faas viiakse läbi vastusena hüperglükeemia stabiliseerimisele pidevalt, toniseerivas režiimis ja vaatamata liigsele insuliini sekretsioonile ei normaliseeru glükeemia tase insuliiniresistentsuse taustal (joonis 7.8). .
Hüperinsulinemia tagajärjeks on insuliiniretseptorite tundlikkuse ja arvu vähenemine, samuti insuliini retseptorite pärssimine.
postretseptori mehhanismid, mis vahendavad insuliini toimet (insuliiniresistentsus). Peamise glükoosi transporteri sisaldus lihas- ja rasvarakkudes (GLUT-4) väheneb vistseraalse rasvumisega inimestel 40% ja suhkurtõve-2 põdevatel inimestel 80%. Hepatotsüütide insuliiniresistentsuse ja portaalhüperinsulineemia tõttu glükoosi hüperproduktsioon maksas, ja tekib tühja kõhuga hüperglükeemia, mis tuvastatakse enamikul suhkurtõvega patsientidel, sealhulgas haiguse varases staadiumis.
Hüperglükeemia iseenesest mõjutab negatiivselt β-rakkude sekretoorse aktiivsuse olemust ja taset (glükoosi toksilisus). Pikaajaline, paljude aastate ja aastakümnete kestev hüperglükeemia viib lõpuks β-rakkude insuliinitootmise vähenemiseni ja patsiendil võivad tekkida mõned sümptomid. insuliinipuudus- kaalulangus, ketoos koos sellega nakkushaigused... Sellest hoolimata säilib T2DM-is peaaegu alati insuliini jääkproduktsioon, mis on piisav ketoatsidoosi vältimiseks.
Epidemioloogia
SD-2 määrab diabeedi epidemioloogia üldiselt, kuna see moodustab umbes 98% selle haiguse juhtudest. T2DM-i levimus on riigiti ja etniliste rühmade lõikes erinev. Euroopa keeles
 Riis. 7.8.β-rakkude sekretoorne düsfunktsioon II tüüpi suhkurtõve korral (1 kiire faas insuliini sekretsioon)
Riis. 7.8.β-rakkude sekretoorne düsfunktsioon II tüüpi suhkurtõve korral (1 kiire faas insuliini sekretsioon)
riigid, USA ja Venemaa Föderatsioon see moodustab umbes 5-6% elanikkonnast. Vanusega suureneb DM-2 esinemissagedus: täiskasvanute seas on DM-2 levimus 10%, üle 65-aastaste seas ulatub see 20% -ni. CD-2 esinemissagedus on Ameerika ja Hawaii saarte põlisrahvaste seas 2,5 korda kõrgem; Pima hõimu (Arizonas) indiaanlaste seas ulatub see 50% -ni. hulgas maaelanikkond Indias, Hiinas, Tšiilis ja Aafrika riikides, mis juhivad traditsioonilist eluviisi, on CD-2 levimus väga madal (alla 1%). Teisest küljest jõuab see Lääne tööstusriikidesse immigrantide seas märkimisväärsele tasemele. Nii ulatub USA-s ja Suurbritannias elavate Indiast ja Hiinast pärit immigrantide seas CD-2 levimus 12-15%-ni.
WHO prognoosib, et järgmise 20 aasta jooksul kasvab maailmas diabeetikute arv 122% (135 miljonilt 300 miljonile). Selle põhjuseks on nii rahvastiku progresseeruv vananemine kui ka linnastunud elustiili levik ja süvenemine. V viimased aastad toimub CD-2 märkimisväärne "noorendamine" ja selle esinemissageduse tõus laste seas.
Kliinilised ilmingud
Enamikel juhtudel, väljendas kliinilised ilmingud puudub, ja diagnoos tehakse rutiinse veresuhkru analüüsiga. Haigus avaldub tavaliselt üle 40-aastastel, samas kui valdav enamus patsientidest on ülekaalulised ja muud komponendid. metaboolne sündroom(vt p 11.2). Patsiendid ei kurda töövõime langust, kui sellel pole muid põhjusi. Janu ja polüuuria kaebused ulatuvad harva märkimisväärse raskuseni. Üsna sageli tunnevad patsiendid muret naha ja tupe sügeluse pärast ning seetõttu pöördutakse dermatoloogide ja günekoloogide poole. Kuna CD-2 tegelikust manifestatsioonist diagnoosimiseni kulub sageli aastaid (keskmiselt umbes 7 aastat), domineerib paljudel patsientidel haiguse avastamise ajal kliinilises pildis diabeedi hiliste tüsistuste sümptomid ja ilmingud. Veelgi enam, suhkurtõve-2 patsiendi esimene visiit arstiabi saamiseks toimub väga sageli seoses hiliste tüsistustega. Seega saab patsiente haiglasse paigutada kirurgilised haiglad Koos haavandiline kahjustus jalad (diabeetilise jala sündroom), seoses nägemise järkjärgulise halvenemisega pöörduge silmaarstide poole (diabeetiline retinopaatia), hospitaliseerida südameinfarkti, insuldi tõttu
tami, hävitades jalgade veresoonte kahjustusi asutustes, kus neil esineb esmakordselt hüperglükeemia.
Diagnostika
Kõikide diabeeditüüpide jaoks ühised diagnostilised kriteeriumid on toodud punktis 7.3. T2DM diagnoos põhineb valdaval enamusel juhtudest hüperglükeemia tuvastamisel inimestel, kellel on tüüpiline. kliinilised tunnused CD-2 (rasvumine, vanus üle 40-45 aasta, positiivne CD-2 anamnees, teised metaboolse sündroomi komponendid), absoluutse insuliinipuuduse kliiniliste ja laboratoorsete tunnuste puudumisel (raske kaalulangus, ketoos). T2DM kõrge levimuse, iseloomuliku pikaajalise asümptomaatilise kulgemise ja selle ennetamise võimaluse kombinatsioon rasked tüsistused ette nähtud varajane diagnoosimine vajaduse ette kindlaks määrata sõelumine, need. küsitluse läbiviimine, et välistada CD-2 haigussümptomiteta isikute hulgas. Peamine test, nagu märgitud, on kindlaks teha tühja kõhuga veresuhkru tase. Seda näidatakse järgmistes olukordades:
1. Kõigil üle 45-aastastel inimestel, eriti ülekaalulistel inimestel (KMI üle 25 kg / m 2), intervalliga iga 3 aasta järel.
2. Nooremas eas liigse kehakaalu (KMI üle 25 kg/m2) ja täiendavate riskitegurite olemasolul, mille hulka kuuluvad:
Istuv eluviis;
SD-2 lähisugulastele;
Kuulumine rahvustesse, kellel on suur risk haigestuda T2DM-i (afroameeriklased, hispaanlased, põlisameeriklased jne);
Naised, kes on sünnitanud lapse kaaluga üle 4 kg ja/või kellel on anamneesis rasedusdiabeet;
Arteriaalne hüpertensioon (≥ 140/90 mm Hg);
HDL> 0,9 mmol/l ja/või triglütseriidid> 2,8 mmol/l;
Polütsüstiliste munasarjade sündroom;
NTG ja NGNT;
Südame-veresoonkonna haigused.
Diabeedi esinemissageduse märkimisväärne suurenemine laste seas tingib vajaduse sõeluuringu järele, et määrata glükeemia tase. laste ja noorukite seas(alates 10 aastast 2-aastase intervalliga või algusega
puberteet, kui see juhtus rohkem varajane iga) kuuluvad kõrge riskiga rühmadesse, mille hulka kuuluvad lapsed ülekaaluline(KMI ja/või kehakaal > 85. protsentiil vanuse järgi või kaal üle 120% ideaalkaalust) kombinatsioonis mis tahes kahe järgmise täiendava riskiteguriga:
SD-2 esimese või teise sugulusliini sugulaste seas;
Suure riskiga etniline kuuluvus;
Insuliiniresistentsusega seotud kliinilised ilmingud (acanthosis nigricans, arteriaalne hüpertensioon, düslipideemia);
Suhkurtõbi, sealhulgas rasedusdiabeet emal.
Diferentsiaaldiagnoos
Suurima kliinilise tähtsusega on CD-2 ja CD-1 diferentsiaaldiagnostika, mille põhimõtted on kirjeldatud punktis 7.5 (tabel 7.6). Nagu öeldud, on see enamikul juhtudel andmetepõhine. kliiniline pilt... Juhtudel, kui SD tüübi kindlaksmääramine tekitab raskusi või kahtlustatakse mõnda haruldane variant Suhkurtõve, sealhulgas pärilike sündroomide puhul, on kõige olulisem praktiline vastus, kas patsient vajab insuliinravi.
Ravi
DM-2 ravi põhikomponendid on: dieetteraapia, kehalise aktiivsuse suurendamine, hüpoglükeemiline ravi, diabeedi hiliste tüsistuste ennetamine ja ravi. Kuna enamik DM-2-ga patsiente on rasvunud, peaks dieet olema suunatud kehakaalu langetamisele (hüpokaloorne) ja hiliste tüsistuste, eelkõige makroangiopaatia (ateroskleroosi) ennetamisele. Madala kalorsusega dieet vajalik kõigile liigse kehakaaluga (KMI 25-29 kg/m2) või rasvunud (KMI> 30 kg/m2) patsientidele. Enamasti tuleks soovitada vähendada päevast toidu kaloraaži naistele 1000-1200 kcal-ni ja meestel 1200-1600 kcal-ni. Toidu põhikomponentide soovitatav suhe CD-2 puhul on sarnane CD-1 omaga (süsivesikud - 65%, valgud 10-35%, rasvad kuni 25-35%). Kasuta alkohol tuleb piirata, kuna see on oluline lisakalorite allikas, lisaks alkoholi tarbimine
PI koos sulfonüüluurea ravimite ja insuliiniga võib provotseerida hüpoglükeemia teket (vt punkt 7.7.3).
Soovitused jaoks laienemine kehaline aktiivsus peab olema individualiseeritud. Alguses on soovitatav mõõduka intensiivsusega aeroobne treening (kõndimine, ujumine) kestusega 30-45 minutit 3-5 korda päevas (umbes 150 minutit nädalas). Tulevikus on vaja järk-järgult suurendada kehaline aktiivsus, mis aitab oluliselt kaasa kehakaalu vähenemisele ja normaliseerumisele. Lisaks aitab füüsiline aktiivsus vähendada insuliiniresistentsust ja omab hüpoglükeemilist toimet. Dieetteraapia ja suurenenud kehalise aktiivsuse kombinatsioon ilma antihüperglükeemilisi ravimeid välja kirjutamata võimaldab säilitada diabeedi kompensatsiooni vastavalt seatud eesmärkidele (tabel 7.3) ligikaudu 5% -l suhkurtõve-2 patsientidest.
Ettevalmistused selleks antihüperglükeemiline ravi SD-2-ga saab jagada nelja põhirühma.
I. Ravimid, mis aitavad vähendada insuliiniresistentsust (sensibilisaatorid). Sellesse rühma kuuluvad metformiin ja tiasolidiindioonid. Metformiin on ainus praegu kasutatav ravim selles rühmas biguaniidid. Selle toimemehhanismi peamised komponendid on järgmised:
1. Glükoneogeneesi pärssimine maksas (maksa glükoosi tootmise vähenemine), mis viib tühja kõhuga glükoosisisalduse vähenemiseni.
2. Insuliiniresistentsuse vähenemine (perifeersete kudede, peamiselt lihaste glükoosi kasutamise suurenemine).
3. Anaeroobse glükolüüsi aktiveerimine ja glükoosi imendumise vähendamine peensooles.
Metformiin on esimene valik antihüperglükeemilises ravis suhkurtõve, rasvumise ja tühja kõhuga hüperglükeemiaga patsientidel. Algannus on 500 mg enne magamaminekut või õhtusöögi ajal. Edaspidi suurendatakse annust järk-järgult 2-3 grammi 2-3 annuseks. Kõrvaltoimetest on suhteliselt sagedased düspeptilised sümptomid (kõhulahtisus), mis reeglina on mööduvad ja taanduvad iseenesest pärast 1-2-nädalast ravimi võtmist. Kuna metformiinil ei ole insuliini tootmist stimuleerivat toimet, ei esine selle ravimi monoteraapia ajal hüpoglükeemiat.
areneda (selle toimet nimetatakse antihüperglükeemiliseks, mitte hüpoglükeemiliseks). Metformiini määramise vastunäidustused on rasedus, raske südame-, maksa-, neeru- ja muude organite puudulikkus, samuti muu päritoluga hüpoksilised seisundid. Üliharvaesinev tüsistus, mis tekib metformiini väljakirjutamisel ilma ülaltoodud vastunäidustusi arvesse võtmata, on laktatsidoos, mis on anaeroobse glükolüüsi hüperaktivatsiooni tagajärg.
Tiasolidiindioonid(pioglitasoon, rosiglitasoon) on peroksisoomi proliferaator-aktiveeritud retseptori (PPAR-γ) agonistid. Tiasolidiindioonid aktiveerivad glükoosi ja lipiidide metabolismi lihas- ja rasvkoes, mis toob kaasa endogeense insuliini aktiivsuse tõusu, s.o. Insuliiniresistentsuse kõrvaldamiseks (insuliini sensibilisaatorid). Pioglitasooni ööpäevane annus on 15-30 mg päevas, rosiglitasooni 4-8 mg (1-2 annuse jaoks). Tiasolidiindioonide kombinatsioon metformiiniga on väga tõhus. Tiasolidiindioonide määramise vastunäidustuseks on maksa transaminaaside taseme tõus (2,5 korda või rohkem). Lisaks hepatotoksilisusele on tiasolidiindioonide kõrvaltoimeteks vedelikupeetus ja tursed, mida esineb sagedamini ravimite kombineerimisel insuliiniga.
II. Mõjutavad ravimidβ -rakku ja soodustab insuliini sekretsiooni. Sellesse rühma kuuluvad sulfonüüluureate ja gliniidide preparaadid (prandiaalsed glükeemilised regulaatorid), mida kasutatakse peamiselt glükeemilise taseme normaliseerimiseks pärast sööki. Peamine sihtmärk sulfonüüluurea preparaadid(PSM) on pankrease saarekeste β-rakud. PSM-id seonduvad β-rakkude membraanil spetsiifiliste retseptoritega. See viib ATP-st sõltuvate kaaliumikanalite sulgumiseni ja rakumembraani depolariseerumiseni, mis omakorda aitab kaasa rakumembraani avanemisele. kaltsiumikanalid... Kaltsiumi sattumine β-rakkudesse põhjustab nende degranulatsiooni ja insuliini vabanemist verre. Kliinilises praktikas kasutatakse palju PSM-e, mis erinevad antihüperglükeemilise toime kestuse ja raskusastme poolest (tabel 7.9).
Tab. 7.9. Sulfonüüluurea preparaadid
 Põhiline ja üsna sagedane kõrvalmõju SCI on hüpoglükeemia (vt lõik 7.7.3). See võib tekkida ravimi üleannustamise, selle kumulatsiooni (neerupuudulikkuse) korral,
Põhiline ja üsna sagedane kõrvalmõju SCI on hüpoglükeemia (vt lõik 7.7.3). See võib tekkida ravimi üleannustamise, selle kumulatsiooni (neerupuudulikkuse) korral,
dieedi (söögikordade vahelejätmine, alkoholi tarbimine) või režiimi (oluline füüsiline aktiivsus, enne mida ei vähendata PSM-i annust või ei võeta süsivesikuid) mittejärgimine.
Rühma juurde gliniidid(prandiaalsed glükeemilised regulaatorid) hõlmavad repagliniid(bensoehappe derivaat; päevane annus 0,5-16 mg / päevas) ja nategliniid(D-fenüülalaniini derivaat; päevane annus 180-540 mg / päevas). Pärast allaneelamist interakteeruvad ravimid kiiresti ja pöörduvalt β-rakkude sulfonüüluurea retseptoriga, mille tulemuseks on insuliini taseme lühiajaline tõus, mis jäljendab normaalsetes tingimustes selle sekretsiooni esimest faasi. Ravimeid võetakse 10-20 minutit enne põhitoidukordi, tavaliselt 3 korda päevas.
III. Ravimid, mis vähendavad glükoosi imendumist soolestikus.
Sellesse rühma kuuluvad akarboos ja guarkummi. Akarboosi toimemehhanism on α-glükosidaaside pöörduv blokaad peensoolde, mille tulemusena aeglustuvad süsivesikute järjestikuse kääritamise ja imendumise protsessid, väheneb resorptsiooni kiirus ja maksa glükoosiga varustamine ning söögijärgse glükeemia tase. Akarboosi algannus on 50 mg 3 korda päevas, edaspidi võib annust suurendada 100 mg-ni 3 korda päevas; ravimit võetakse vahetult enne sööki või koos toiduga. Akarboosi peamine kõrvalmõju on soole düspepsia (kõhulahtisus, kõhupuhitus), mis on seotud imendumata süsivesikute sattumisega jämesoolde. Akarboosi suhkrusisaldust alandav toime on väga mõõdukas (tabel 7.10).
Kliinilises praktikas kombineeritakse tablettidega antihüperglükeemilisi ravimeid tõhusalt üksteisega ja insuliinipreparaatidega, kuna enamikul patsientidest määratakse samaaegselt nii tühja kõhuga kui ka söögijärgne hüperglükeemia. Neid on arvukalt fikseeritud kombinatsioonid ravimid ühes tabletis. Kõige sagedamini kombineeritakse metformiini ühes tabletis erinevate PSM-idega, samuti metformiini tiasolidiindioonidega.
Tab. 7.10. Diabeedivastaste tablettide toimemehhanism ja potentsiaalne efektiivsus
 IV. Insuliinid ja insuliini analoogid
IV. Insuliinid ja insuliini analoogid
Teatud etapis hakkab insuliinipreparaate saama kuni 30–40% DM-2-ga patsientidest. DM-2 insuliinravi näidustused on toodud punkti 7.4 alguses. Kõige tavalisem võimalus DM-2-ga patsientide insuliinravile üleviimiseks on välja kirjutada toimeainet prolongeeritult vabastav insuliin (NPH-insuliin, glargiin või detemiir) koos manustatavate antihüperglükeemiliste ravimitega. Olukorras, kus tühja kõhu glükeemia taset ei ole võimalik metformiini määramisega kontrollida või viimane on vastunäidustatud, määratakse patsiendile õhtune (öine) insuliinisüst. Kui tabletipreparaatide abil ei ole võimalik nii tühja kõhuga kui ka söögijärgset glükeemiat kontrolli all hoida, viiakse patsient üle monoinsuliinravile. Tavaliselt toimub CD-2-ga insuliinravi nn "Traditsiooniline" skeem, mis tähendab pika- ja lühitoimelise insuliini fikseeritud annuste määramist. Selles plaanis
mugavad standardsed insuliinisegud, mis sisaldavad ühes viaalis lühikese (ülilühikese) ja pikaajalise toimega insuliini. Traditsioonilise insuliinravi valiku määrab asjaolu, et T2DM-iga määratakse seda sageli eakatele patsientidele, kelle iseseisva insuliiniannuse muutmise õppimine on keeruline. Lisaks kaasneb intensiivne insuliinravi, mille eesmärk on säilitada süsivesikute ainevahetuse kompenseerimine normoglükeemilise taseme lähedasel tasemel, suurenenud hüpoglükeemia riski. Kuigi kerge hüpoglükeemia ei kujuta endast tõsist ohtu noortele patsientidele, võib eakatel patsientidel, kellel on vähenenud hüpoglükeemia tuvastamise lävi, olla väga kahjulik mõju südame-veresoonkonna süsteemile. Noortele suhkurtõvega-2 patsientidele, aga ka tõhusa hariduse võimaluse osas paljutõotavatele patsientidele võib määrata insuliinravi intensiivse variandi.
Prognoos
Diabeediga patsientide peamiseks puude ja surma põhjuseks on hilised tüsistused (vt lõik 7.8), kõige sagedamini diabeetiline makroangiopaatia. Teatud hiliste komplikatsioonide tekkeriski määrab tegurite kompleks, mida käsitletakse vastavates peatükkides. Krooniline hüperglükeemia on nende arengu universaalne riskitegur. Seega põhjustab DM-2-ga patsientide HbA1c taseme langus 1% võrra üldise suremuse vähenemist vastavalt umbes 20%, 2% ja 3% - umbes 40%.
7.7. DIABEEDI Ägedad komplikatsioonid
7.7.1. Diabeetiline ketoatsidoos
Diabeetiline ketoatsidoos (DKA)- CD-1 dekompensatsioon absoluutsest insuliinipuudusest, selle puudumisel õigeaegne ravi lõppedes ketoatsidootilise koomaga (CC) ja surmaga.
Etioloogia
DKA on põhjustatud absoluutsest insuliinipuudusest. DKA üks või teine raskusaste määratakse enamikul patsientidest CD-1 avaldumise ajal (10-20% kõigist DKA juhtudest).
Patsiendil, kellel on tuvastatud CD-1 diagnoos, võib DKA areneda insuliini manustamise lõpetamisel, sageli patsiendi enda poolt (13% DKA juhtudest), kaasuvate haiguste, peamiselt nakkushaiguste taustal, ilma ravita. insuliini annuse suurendamine
Tab. 7.11. Diabeetiline ketoatsidoos
 Kuni 20% DKA arengu juhtudest noortel T1DM-ga patsientidel on seotud psühholoogiliste probleemide ja/või häiretega söömiskäitumine(hirm kaalutõusu ees, hirm hüpoglükeemia ees, teismeliste probleemid). Paljudes riikides on DKA üsna levinud põhjus
Kuni 20% DKA arengu juhtudest noortel T1DM-ga patsientidel on seotud psühholoogiliste probleemide ja/või häiretega söömiskäitumine(hirm kaalutõusu ees, hirm hüpoglükeemia ees, teismeliste probleemid). Paljudes riikides on DKA üsna levinud põhjus
insuliini ärajätmine patsiendi enda poolt ravimite kõrge hinna tõttu mõne elanikkonnarühma jaoks (tabel 7.11).
Patogenees
DKA patogenees põhineb absoluutsel insuliinipuudusel koos saarte vastaste hormoonide, näiteks glükagooni, katehhoolamiinide ja kortisooli tootmise suurenemisega. Selle tulemusena suureneb glükoosi tootmine maksas märkimisväärselt ja perifeersetes kudedes on rikutud selle kasutamist, suureneb hüperglükeemia ja rikutakse rakuvälise ruumi osmolaarsust. Insuliini defitsiit kombinatsioonis DKA vastassaarte hormoonide suhtelise liiaga põhjustab vabade rasvhapete vabanemist vereringesse (lipolüüs) ja nende kontrollimatut oksüdeerumist maksas ketoonkehadeks (β-hüdroksübutüraat, atsetoatsetaat, atsetoon) mis tekib hüperketoneemia ja seejärel metaboolne atsidoos. Raske glükosuuria tagajärjel areneb osmootne diurees, dehüdratsioon, naatriumi, kaaliumi ja teiste elektrolüütide kadu (joon. 7.9).
Epidemioloogia
Uute DKA juhtude sagedus on 5-8 juhtu 1000 T1DM-iga patsiendi kohta aastas ja see sõltub otseselt organisatsiooni tasemest. arstiabi diabeediga patsiendid. Ameerika Ühendriikides toimub igal aastal ligikaudu 100 000 haiglaravi DKA tõttu, võttes arvesse iga-aastase haiglaravi maksumust 13 000 dollarit patsiendi kohta. haiglaravi DKA-le kulutatakse üle 1 miljardi dollari aastas. Vene Föderatsioonis registreeriti 2005. aastal DKA 4,31% lastest, 4,75% noorukitest ja 0,33% täiskasvanud suhkurtõve-1 patsientidest.
Kliinilised ilmingud
DKA areng võib olenevalt selle põhjustanud põhjusest kesta mitu nädalat kuni päeva. Enamasti eelnevad DKA-le diabeedi dekompensatsiooni sümptomid, kuid mõnikord ei pruugi need õigel ajal tekkida. DKA kliinilisteks sümptomiteks on polüuuria, polüdipsia, kaalulangus, hajus kõhuvalu ("diabeetiline pseudoperitoniit"), dehüdratsioon, tugev nõrkus, atsetooni lõhn suust (või puuviljalõhn) ja teadvuse järkjärguline hägustumine. Tõeline kooma DKA-s on varajase diagnoosimise tõttu viimasel ajal suhteliselt harva arenenud. Füüsiline läbivaatus näitab dehüdratsiooni tunnuseid:
 Riis. 7.9. Ketoatsidootse kooma patogenees
Riis. 7.9. Ketoatsidootse kooma patogenees
naha turgor ja tihedus silmamunad, tahhükardia, hüpotensioon. Kaugelearenenud juhtudel areneb Kussmauli hingamine. Rohkem kui 25%-l DKA-ga patsientidest tekib oksendamine, mis võib värvilt meenutada kohvipaksu.
Diagnostika
Kliiniliste andmete, CD-1 esinemise näidustuste ja andmete põhjal patsiendil laboriuuringud... DKA-le on iseloomulik hüperglükeemia (mõnel juhul ebaoluline), ketonuuria, metaboolne atsidoos, hüperosmolaarsus (tabel 7.12).
Tab. 7.12. Diabeedi ägedate tüsistuste laboratoorne diagnostika
 Diabeedi ägeda dekompensatsiooniga patsientide uurimisel on vaja määrata glükeemia, kreatiniini ja uurea, elektrolüütide tase, mille põhjal arvutatakse efektiivne osmolaarsus. Lisaks on vaja hinnata happe-aluse olekut. Efektiivne osmolaarsus(EO) arvutatakse järgmise valemi abil: 2 *. Tavaliselt on EO 285–295 mOsm / l.
Diabeedi ägeda dekompensatsiooniga patsientide uurimisel on vaja määrata glükeemia, kreatiniini ja uurea, elektrolüütide tase, mille põhjal arvutatakse efektiivne osmolaarsus. Lisaks on vaja hinnata happe-aluse olekut. Efektiivne osmolaarsus(EO) arvutatakse järgmise valemi abil: 2 *. Tavaliselt on EO 285–295 mOsm / l.
Enamikul DKA-ga patsientidel leukotsütoos, mille raskusaste on võrdeline ketoonkehade tasemega veres. Tase naatrium, reeglina väheneb see vedeliku osmootse väljavoolu tõttu intratsellulaarsetest ruumidest rakuvälistesse ruumidesse vastusena hüperglükeemiale. Harvemini võib naatriumisisaldust vale alandada raske hüper-
triglütserideemia. Tase kaalium seerum võib esialgu suureneda selle liikumise tõttu rakuvälistest ruumidest.
Diferentsiaaldiagnoos
Muud teadvusekaotuse põhjused diabeediga patsientidel. Hüperosmolaarse koomaga diferentsiaaldiagnostika ei tekita reeglina raskusi (see areneb eakatel suhkurtõvega patsientidel) ega oma erilist kliinilist tähtsust, sest mõlema haigusseisundi ravi põhimõtted on sarnased. Kui diabeediga patsiendi teadvuse kaotuse põhjust ei ole võimalik kiiresti välja selgitada, määratakse talle glükoosi manustamine, kuna hüpoglükeemilised seisundid on palju tavalisemad ja kiire positiivne dünaamika glükoosi manustamise taustal võimaldab juba iseenesest välja selgitada teadvusekaotuse põhjuse.
Ravi
DKA ravi hõlmab rehüdratsiooni, hüperglükeemia korrigeerimist, elektrolüütide tasakaaluhäireid ja diabeedi dekompensatsiooni põhjustanud haiguste ravi. Kõige optimaalsem ravi viiakse läbi eriarsti intensiivravi osakonnas raviasutus... Raske kaasuva südamepatoloogiata täiskasvanud patsientidel, isegi haiglaeelses staadiumis, esmatähtsa meetmena rehüdratsioon isotoonilist lahust (0,9% NaCl) soovitatakse lisada ligikaudu liiter tunnis (umbes 15-20 ml kehakaalu kilogrammi kohta tunnis). Vedelikupuuduse täielik hüvitamine, mis DKA-ga on 100-200 ml 1 kg kehakaalu kohta, tuleb saavutada esimese ravipäeva jooksul. Samaaegse südame- või neerupuudulikkus seda ajavahemikku tuleks pikendada. Lastele on rehüdratatsiooniravi isotoonilise lahuse soovitatav kogus 10-20 ml 1 kg kehakaalu kohta tunnis, kusjuures esimese 4 tunni jooksul ei tohiks see ületada 50 ml 1 kg kehakaalu kohta. Täielik rehüdratsioon on soovitatav saavutada umbes 48 tunni pärast. Pärast seda, kui paralleelse insuliinravi taustal väheneb glükeemia tase umbes 14 mmol / l-ni, lülituvad nad üle 10% glükoosilahuse ülekandele, millega jätkub rehüdratsioon.
Nüüd on vastu võetud mõiste "väikesed annused". insuliini DKA ravis. Kasutatakse ainult lühitoimelist insuliini. Kõige optimaalsem kasutus intravenoosne manustamine insu-
lina. Intramuskulaarne süstimine Insuliin, mis on vähem efektiivne, on võimalik ainult mõõduka raskusega DKA, stabiilse hemodünaamika ja intravenoosse ravi võimatuse korral. Viimasel juhul tehakse süstid kõhu sirglihasesse, samas insuliini süstal jaoks nõela panema intramuskulaarne süstimine(usaldusväärseks intramuskulaarseks süstimiseks) ja selle nõela kaudu tõmmatakse insuliin viaalist süstlasse.
Insuliini intravenoosseks manustamiseks on mitu võimalust. Esiteks saab insuliini süstida infusioonisüsteemi "kummipaelasse", samas kui nõutav summa insuliin tõmmatakse insuliinisüstlasse, seejärel tõmmatakse sellesse 1 ml isotoonilist lahust. Kuni glükeemiline tase jõuab 14 mmol / L-ni, süstitakse patsiendile iga tund 6-10 U lühitoimelist insuliini; edasi (paralleelselt rehüdratsioonilahuse muutmisega isotooniliselt 10% glükoosile) sõltuvalt glükeemia tunnis määratud näitajatest vähendatakse insuliini annust 4-8 U-ni tunnis. Soovitatav glükeemilise taseme languse kiirus ei tohi ületada 5 mmol/l tunnis. Teine intravenoosse insuliinravi võimalus hõlmab perfuusori kasutamist. Perfuusori lahuse valmistamiseks lähtutakse vahekorrast: 50 U lühitoimelisele insuliinile lisatakse 2 ml 20% inimalbumiini lahust, misjärel lisatakse 50 mg 0,9% isotoonilist lahust. Kui insuliini manustamiseks on valitud intramuskulaarne manustamisviis, süstitakse esialgu 20 U lühitoimelist insuliini, seejärel 6 U iga tund ja pärast glükeemilise taseme 14 mmol/l saavutamist vähendatakse annust 4 U-ni tunnis. Pärast hemodünaamika täielikku stabiliseerumist ja happe-aluse häirete kompenseerimist viiakse patsient subkutaansetele insuliinisüstidele.
Nagu märgitud, hoolimata märkimisväärsest kaaliumipuudus kehas (kogukaotus 3-6 mmol / kg), DKA korral võib selle tase enne insuliinravi algust veidi tõusta. Siiski on soovitatav alustada kaaliumkloriidi lahuse transfusiooni samaaegselt insuliinravi alustamisega, kui plasma kaaliumisisaldus on alla 5,5 mmol/l. Kaaliumipuuduse edukas korrigeerimine toimub ainult pH normaliseerumise taustal. Madala pH korral väheneb oluliselt kaaliumi omastamine rakku, seetõttu on võimalusel soovitav ülekantud kaaliumkloriidi doos kohandada konkreetse pH väärtusega (tabel 7.13).
Tab. 7.13. Kaaliumipuuduse korrigeerimise skeem
 * Arvutamiseks kasutatakse järgmisi andmeid:
* Arvutamiseks kasutatakse järgmisi andmeid:
1 g KCl = 13,4 mmol; 1 mmol KCl = 0,075 g 4% KC1 lahuses: 100 ml-s - 4 g KC1, 25 ml-s - 1 g KC1, 10 ml-s 0,4 g KC1.
Diabeedi dekompensatsiooni põhjustab sageli nakkushaigused(püelonefriit, diabeetilise jala sündroomiga nakatunud haavand, kopsupõletik, sinusiit jne). Kehtib reegel, mille kohaselt määratakse DKA-ga antibiootikumravi peaaegu kõigile subfebriili seisundi või palavikuga patsientidele isegi nähtava infektsioonikolde puudumisel, kuna kehatemperatuuri tõus ei ole DKA-le tüüpiline.
Prognoos
Suremus DKA-sse on 0,5–5%, kusjuures enamikul juhtudest on põhjuseks hiline ja oskusteta arstiabi. Suremus on kõrgeim (kuni 50%) eakate patsientide seas.
7.7.2. Hüperosmolaarne kooma
Hüperosmolaarne kooma(GOK) - haruldane äge tüsistus CD-2, mis areneb tõsise dehüdratsiooni ja hüperglükeemia tagajärjel absoluutse insuliinipuuduse puudumise taustal, millega kaasneb kõrge suremus (tabel 7.14).
Etioloogia
HOC areneb tavaliselt eakatel II tüüpi diabeediga patsientidel. Sellised patsiendid on enamasti üksildased, elavad ilma hoolitsuseta, eiravad oma seisundit ja enesekontrolli ning ei joo piisavalt vedelikku. Infektsioonid (diabeetilise jala sündroom, kopsupõletik, äge püelonefriit), ajuhäired põhjustavad sageli dekompensatsiooni.
vereringe ja muud seisundid, mille tõttu patsiendid liiguvad halvasti, ei võta antihüperglükeemilisi ravimeid ja vedelikke.
Tab. 7.14. Hüperosmolaarne kooma (HOC)
 Patogenees
Patogenees
Suurenev hüperglükeemia ja osmootne diurees põhjustavad tõsist dehüdratsiooni, mida ülaltoodud põhjustel väljastpoolt ei täiendata. Hüperglükeemia ja dehüdratsioon põhjustavad plasma hüperosmolaarsust. GOK patogeneesi lahutamatuks komponendiks on insuliini suhteline defitsiit ja kontrainsuliini hormoonide liig, sellegipoolest on T2DM-iga püsiv insuliini jääksekretsioon piisav lipolüüsi ja ketogeneesi pärssimiseks, mille tulemusena areneb ketoatsidoos. ei esine.
Mõnel juhul võib kudede hüpoperfusiooni taustal määrata hüperlaktateemia tagajärjel mõõduka atsidoosi. Raske hüperglükeemia korral suureneb tserebrospinaalvedeliku osmootse tasakaalu säilitamiseks rakkude naatriumisisaldus aju kus vahetatakse kaaliumi. Närvirakkude transmembraanne potentsiaal on kahjustatud. Arendab progresseeruvat teadvuse hägustumist koos konvulsiivne sündroom(joon. 7.10).
Epidemioloogia
GOK moodustab 10–30% ägedatest hüperglükeemilistest seisunditest täiskasvanutel ja eakatel suhkurtõvega patsientidel. Ligikaudu 2/3 juhtudest areneb GOK inimestel, kellel on varem diagnoosimata diabeet.
Kliinilised ilmingud
Kliinilise pildi tunnused hüperosmolaarne kooma on:
Dehüdratsiooni ja hüpoperfusiooni nähtude ja tüsistuste kompleks: janu, kuivad limaskestad, tahhükardia, arteriaalne hüpotensioon, iiveldus, nõrkus, šokk;
fokaalsed ja generaliseerunud krambid;
Palavik, iiveldus ja oksendamine (40-65% juhtudest);
Kaasuvatest haigustest ja tüsistustest on levinud süvaveenide tromboos, kopsupõletik, tserebrovaskulaarne õnnetus, gastroparees.
Diagnostika
Kliinilise pildi, patsiendi vanuse ja CD-2 anamneesi andmete põhjal, raske hüperglükeemia ketonuuria puudumisel ja ketoatsidoos. Tüüpiline laboratoorsed märgid Korea valitsus on esitatud tabelis. 7.12.
 Riis. 7 .10.
Hüperosmolaarse kooma patogenees
Riis. 7 .10.
Hüperosmolaarse kooma patogenees
Diferentsiaaldiagnoos
muud ägedad seisundid areneb diabeediga patsientidel, kõige sagedamini koos samaaegne patoloogia mis põhjustab diabeedi väljendunud dekompensatsiooni.
Ravi
Ravi ja jälgimine HOC-s, välja arvatud mõned tunnused, ei erine ketoatsidootilise diabeetilise kooma puhul kirjeldatust (punkt 7.7.1):
Suurem esialgse rehüdratsiooni maht 1,5-2 liitrit 1 tunni kohta; 1 l - 2. ja 3. tunniks, seejärel 500 ml / h isotoonilist naatriumkloriidi lahust;
Kaaliumi sisaldavate lahuste sisseviimise vajadus on reeglina suurem kui ketoatsidootilise kooma korral;
Insuliinravi on sarnane CC-ga, kuid insuliinivajadus on väiksem ja glükeemia taset tuleb vähendada mitte kiiremini kui 5 mmol / L tunnis, et vältida ajuturse teket;
Sissejuhatused hüpotooniline lahus(NaCl 0,45%) on kõige parem vältida (ainult raske hüpernatreemia korral:> 155 mmol/L ja/või efektiivne osmolaarsus> 320 mOsm/L);
Bikarbonaadi sisseviimine ei ole vajalik (ainult spetsialiseeritud intensiivraviosakondades pH-ga atsidoosi korral< 7,1).
Prognoos
Korea valitsuse suremus on kõrge ja ulatub 15–60% -ni. Halvim prognoos eakatel patsientidel, kellel on raske kaasuv patoloogia, mis sageli on diabeedi dekompensatsiooni ja HOC arengu põhjuseks.
7.7.3. Hüpoglükeemia
Hüpoglükeemia- seerumi glükoositaseme langus (<2,2- 2,8 ммоль/л), сопровождающее клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы. Гипогликемия как лабораторный феномен не тождественен понятию «гипогликемическая симптоматика», поскольку лабораторные данные и клиническая картина не всегда совпадают.
Etioloogia
Insuliinipreparaatide ja selle analoogide, samuti sulfonüüluurea preparaatide üleannustamine;
Ebapiisav toidutarbimine muutumatu antihüperglükeemilise ravi taustal;
Alkohoolsete jookide vastuvõtt;
Füüsiline aktiivsus muutumatu antihüperglükeemilise ravi taustal ja / või ilma täiendava süsivesikute tarbimiseta;
Diabeedi hiliste tüsistuste (autonoomne neuropaatia koos gastropareesiga, neerupuudulikkus) ja paljude teiste haiguste (neerupealiste puudulikkus, hüpotüreoidism, maksapuudulikkus, pahaloomulised kasvajad) tekkimine muutumatul hüpoglükeemilisel ravil (jätkuv TSP tarbimine ja kogunemine neerude taustal ebaõnnestumine, insuliini sama annuse säilitamine);
Insuliini süstimise tehnika rikkumine (subkutaanse süsti asemel intramuskulaarne süstimine);
Kunstlik hüpoglükeemia (patsiendi enda poolt hüpoglükeemiliste ravimite tahtlik üleannustamine);
Orgaaniline hüperinsulinism – insulinoom (vt lõik 10.3).
Patogenees
Hüpoglükeemia patogenees on tasakaalustamatus vere glükoosivoolu, selle kasutamise, insuliini taseme ja kontrainsulaarsete hormoonide vahel. Tavaliselt, kui glükeemiline tase on vahemikus 4,2–4,7 mmol / l, pärsitakse insuliini tootmist ja vabanemist β-rakkudest. Glükeemia taseme langusega alla 3,9 mmol / l kaasneb vastusaare hormoonide (glükagoon, kortisool, kasvuhormoon, adrenaliin) tootmise stimuleerimine. Neuroglükopeenilised sümptomid arenevad glükeemia taseme langusega alla 2,5-2,8 mmol / l. Üleannustamise korral insuliini ja/või ravimid sulfonüüluuread hüpoglükeemia areneb eksogeense või endogeense hormooni otsese hüpoglükeemilise toime tulemusena. Sulfonüüluurea ravimite üleannustamise korral võivad hüpoglükeemilised sümptomid pärast krambihoo lõpetamist korduda mitu korda, kuna paljude ravimite toimeaeg võib ulatuda päevani või kauemgi. TSP, millel ei ole insuliini tootmist stimuleerivat toimet (metformiin, tiasolidiindioonid), ei saa iseenesest põhjustada hüpoglükeemiat, kuid lisatuna sulfonüüluureale või insuliinipreparaatidele võib viimaste samas annuses võtmine põhjustada hüpoglükeemiat antihüperglükeemilise aine kumuleerumise tõttu. kombineeritud ravi mõju (tabel 7.15).
Tab. 7.15. Hüpoglükeemia
 Tabeli lõpp. 7.15
Tabeli lõpp. 7.15
 Saamisel alkohol maksas on glükoneogeneesi pärssimine, mis on kõige olulisem hüpoglükeemiat takistav tegur. Füüsiline treening soodustavad insuliinist sõltumatut glükoosi kasutamist, mille tõttu võivad nad muutumatul hüpoglükeemilisel ravil ja / või täiendava süsivesikute tarbimise puudumisel põhjustada hüpoglükeemiat.
Saamisel alkohol maksas on glükoneogeneesi pärssimine, mis on kõige olulisem hüpoglükeemiat takistav tegur. Füüsiline treening soodustavad insuliinist sõltumatut glükoosi kasutamist, mille tõttu võivad nad muutumatul hüpoglükeemilisel ravil ja / või täiendava süsivesikute tarbimise puudumisel põhjustada hüpoglükeemiat.
Epidemioloogia
Intensiivset insuliinravi saavatel T1DM patsientidel võib kerge, kiiresti taanduv hüpoglükeemia tekkida mitu korda nädalas ja on suhteliselt kahjutu. Ühel intensiivset insuliinravi saavatel patsientidel esineb 1 raske hüpoglükeemia juhtum aastas. Enamikul juhtudel tekib hüpoglükeemia öösel. Suhkurtõve korral tekib 20% insuliini saavatest patsientidest ja 6% sulfonüüluurea derivaate saavatest patsientidest 10 aasta jooksul vähemalt üks raske hüpoglükeemia episood.
Kliinilised ilmingud
On kaks peamist sümptomite rühma: adrenergilised, mis on seotud sümpaatilise närvisüsteemi aktiveerumisega ja adrenaliini vabanemisega neerupealiste poolt, ja neuroglükopeensed, mis on seotud kesknärvisüsteemi talitlushäiretega selle põhienergia puudulikkuse taustal. substraat. TO adrenergiline sümptomite hulka kuuluvad: tahhükardia, müdriaas; ärevus, agressiivsus; värisemine, külm higi, paresteesia; iiveldus, tugev nälg, hüpersalivatsioon; kõhulahtisus, rohke urineerimine. TO neuroglükopeenne sümptomite hulka kuuluvad asteenia,
vähenenud keskendumisvõime, peavalu, hirm, segasus, desorientatsioon, hallutsinatsioonid; kõne-, nägemis-, käitumishäired, amneesia, teadvusehäired, krambid, mööduv halvatus, kooma. Hüpoglükeemia süvenemisel ei pruugi ilmneda selget sõltuvust sümptomite raskusastmest ja järjestusest. Esineda võivad ainult adrenergilised või ainult neuroglükopeenilised sümptomid. Mõnel juhul võivad patsiendid vaatamata normoglükeemia taastumisele ja käimasolevale ravile jääda stuporisse või isegi koomasse mitu tundi või isegi päeva. Pikaajaline hüpoglükeemia või selle sagedased episoodid võivad põhjustada kesknärvisüsteemis (eelkõige ajukoores) pöördumatuid muutusi, mille ilmingud varieeruvad märkimisväärselt deliristlikust ja hallutsinatsiooni-paranoilisest episoodist kuni tüüpiliste epilepsiahoogudeni, mille vältimatuks tagajärjeks on püsiv dementsus. .
Patsiendid taluvad subjektiivselt hüperglükeemiat kergemini kui isegi kerge hüpoglükeemia episoode. Seetõttu peavad paljud patsiendid hüpoglükeemia kartuses vajalikuks säilitada glükeemia suhteliselt kõrgel tasemel, mis tegelikult vastab haiguse dekompensatsioonile. Sellest stereotüübist üle saamine nõuab mõnikord arstide ja õppejõudude märkimisväärseid pingutusi.
Diagnostika
Hüpoglükeemia kliiniline pilt diabeediga patsiendil koos madala veresuhkru taseme laboratoorse (tavaliselt glükomeetri abil) tuvastamisega.
Diferentsiaaldiagnoos
Muud põhjused, mis põhjustavad teadvusekaotust. Kui diabeediga patsiendi teadvuse kaotuse põhjus pole teada ja glükeemia taseme kiiret analüüsi pole võimalik teha, näidatakse talle glükoosi sisseviimist. Sageli on vaja välja selgitada diabeediga patsientide sagedase hüpoglükeemia tekke põhjused. Enamasti on need tingitud ebapiisavast antihüperglükeemilisest ravist ja patsientide vähesest teadmistest oma haiguse kohta. Tuleb meeles pidada, et mitmed haigused (neerupealiste puudulikkus, hüpotüreoidism, neeru- ja maksapuudulikkus), sealhulgas pahaloomulised kasvajad, võivad põhjustada hüpoglükeemilise ravi vajaduse vähenemist kuni selle täieliku tühistamiseni ("kadunud diabeet").
Ravi
Kerge hüpoglükeemia raviks, mille puhul patsient on teadvusel ja saab ennast aidata, piisab tavaliselt süsivesikuid sisaldava toidu või vedeliku võtmisest 1-2 leivaühikut (10-20 g glükoosi). See kogus sisaldub näiteks 200 ml magusas puuviljamahlas. Joogid leevendavad hüpoglükeemiat tõhusamalt, kuna vedelal kujul imendub glükoos palju kiiremini. Kui sümptomid süvenevad hoolimata jätkuvast süsivesikute tarbimisest, on vajalik glükoosi või intramuskulaarse glükagooni manustamine. Rasket hüpoglükeemiat koos teadvusekaotusega ravitakse sarnaselt. Sellisel juhul süstitakse patsiendile umbes 50 ml 40% glükoosilahus intravenoosselt. Glükoosi manustamist tuleb jätkata, kuni rünnak lõpeb ja glükeemia normaliseerub, kuigi reeglina ei ole vaja suuremat annust - kuni 100 ml või rohkem. glükagoon süstitakse (tavaliselt tehases valmistatud täidetud süstlaga) intramuskulaarselt või subkutaanselt. Mõne minuti pärast normaliseerub glükeemia tase glükagooni glükogenolüüsi indutseerimise tõttu. Seda aga alati ei juhtu: kõrge insuliinitasemega veres on glükagoon ebaefektiivne. Glükagooni poolväärtusaeg on lühem kui insuliinil. Alkoholismi ja maksahaiguste korral on glükogeeni süntees häiritud ja glükagooni manustamine võib olla ebaefektiivne. Glükagooni manustamise kõrvalmõjuks võib olla oksendamine, mis tekitab aspiratsiooniohu. Patsiendi lähedastel on soovitav valdada glükagooni süstimise tehnikat.
Prognoos
Kerge hüpoglükeemia hea haigushüvitisega koolitatud patsientidel on ohutu. Sage hüpoglükeemia on märk kehvast diabeedikompensatsioonist; enamikul juhtudel on neil patsientidel rohkem või vähem väljendunud hüperglükeemia ja kõrge glükeeritud hemoglobiini tase ülejäänud päeva jooksul. Diabeedi hiliste tüsistustega eakatel patsientidel võib hüpoglükeemia esile kutsuda vaskulaarseid tüsistusi, nagu müokardiinfarkt, insult ja võrkkesta hemorraagia. Kuni 30 minutit kestev hüpoglükeemiline kooma piisava ravi ja kiire teadvuse taastumisega ei too reeglina kaasa mingeid tüsistusi ega tagajärgi.
7.8. DIABEEDI HILLISED TÜSISTUSED
Mõlemat tüüpi diabeedi korral tekivad hilised tüsistused. Kliiniliselt on diabeedil viis peamist hilist tüsistust: makroangiopaatia, nefropaatia, retinopaatia, neuropaatia ja diabeetilise jala sündroom. Teatud tüüpi diabeedi hiliste tüsistuste mittespetsiifilisuse määrab asjaolu, et nende peamine patogeneetiline seos on krooniline hüperglükeemia. Sellega seoses ei esine CD-1 avaldumise ajal patsientidel peaaegu kunagi hilinenud tüsistusi, mis arenevad aastate ja aastakümnete jooksul, sõltuvalt ravi efektiivsusest. DM-1 puhul omandab reeglina suurim kliiniline tähtsus diabeetiline mikroangiopaatia(nefropaatia, retinopaatia) ja neuropaatia (diabeetilise jala sündroom). Seevastu T2DM-i puhul avastatakse hilised tüsistused sageli juba diagnoosimise ajal. Esiteks on see tingitud asjaolust, et CD-2 avaldub juba ammu enne diagnoosi panemist. Teiseks on ateroskleroosil, mis kliiniliselt väljendub makroangiopaatias, palju diabeediga sarnaseid patogeneesi seoseid. DM-2 puhul omandab reeglina suurima kliinilise tähtsuse diabeetik makroangiopaatia, mis diagnoosimise hetkel avastatakse valdaval enamusel patsientidest. Igal juhul varieerub üksikute hiliste tüsistuste hulk ja raskusaste nende paradoksaalsest täielikust puudumisest, hoolimata haiguse märkimisväärsest kestusest, kuni kõigi võimalike võimaluste kombinatsioonini raskes vormis.
Hilised komplikatsioonid on peamine surmapõhjus diabeeti põdevatel patsientidel ja võttes arvesse selle levimust - kõige olulisem meditsiiniline ja sotsiaalne terviseprobleem enamikus riikides. Mis puudutab ravi peamine eesmärk ja diabeediga patsientide jälgimine on selle hiliste tüsistuste ennetamine (esmane, sekundaarne, tertsiaarne).
7.8.1. Diabeetiline makroangiopaatia
Diabeetiline makroangiopaatia- kollektiivne kontseptsioon, mis ühendab suurte arterite aterosklerootilisi kahjustusi diabeedi korral,
kliiniliselt avaldub südame isheemiatõbi (IHD), ajuveresoonte hävitav ateroskleroos, alajäsemed, siseorganid ja arteriaalne hüpertensioon (tabel 7.16).
Tab. 7.16. Diabeetiline makroangiopaatia
 Etioloogia ja patogenees
Etioloogia ja patogenees
Tõenäoliselt sarnane ateroskleroosi etioloogia ja patogeneesiga inimestel, kellel ei ole diabeeti. Aterosklerootilised naastud ei erine mikroskoopilise struktuuri poolest diabeediga ja ilma diabeedita inimestel. Sellegipoolest võivad diabeedi korral esile kerkida täiendavad riskifaktorid või diabeeti süvendavad teadaolevad mittespetsiifilised tegurid. Diabeediga inimesed peaksid sisaldama:
1. Hüperglükeemia. On ateroskleroosi arengu riskitegur. Suhkurtõvega patsientidel suureneb HbA1c tase 1%.
müokardiinfarkti tekkerisk on 15%. Hüperglükeemia aterogeense toime mehhanism ei ole täiesti selge, see võib olla seotud LDL-i metabolismi lõpp-produktide ja kollageeni glükatsiooniga veresoone seinas.
2. Arteriaalne hüpertensioon(AH). Patogeneesis omistatakse suurt tähtsust neerukomponendile (diabeetiline nefropaatia). AH DM-2-s ei ole vähem oluline südameinfarkti ja insuldi riskitegur kui hüperglükeemia.
3. Düslipideemia. Hüperinsulineemia, mis on T2DM-i insuliiniresistentsuse lahutamatu komponent, põhjustab HDL taseme langust, triglütseriidide tõusu ja tiheduse vähenemist, s.o. LDL suurenenud aterogeensus.
4. ülekaalulisus, mis mõjutab enamikku suhkurtõvega patsiente, on iseseisev ateroskleroosi, müokardiinfarkti ja insuldi riskitegur (vt lõik 11.2).
5. Insuliiniresistentsus. Hüperinsulineemia ja kõrge insuliini-proinsuliinitaoliste molekulide tase suurendavad ateroskleroosi riski, mis võib olla seotud endoteeli düsfunktsiooniga.
6. Vere hüübimise rikkumine. Diabeedi korral määratakse fibrinogeeni taseme tõus, trombotsüütide inhibiitori aktivaator ja von Willebrandi faktor, mille tulemusena moodustub vere hüübimissüsteemi protrombeetiline seisund.
7. Endoteeli düsfunktsioon, mida iseloomustab plasminogeeni inhibiitori aktivaatori ja rakuadhesioonimolekulide suurenenud ekspressioon.
8. Oksüdatiivne stress mis põhjustab oksüdeeritud LDL-i ja F2-isoprostaanide kontsentratsiooni tõusu.
9. Süsteemne põletik mille puhul suureneb fibrinogeeni ja C-reaktiivse valgu ekspressioon.
Kõige olulisemad riskitegurid koronaararterite haiguse tekkeks II tüüpi diabeedi korral on kõrgenenud LDL-kolesterool, madal HDL-kolesterool, hüpertensioon, hüperglükeemia ja suitsetamine. Üks erinevusi suhkurtõve aterosklerootilise protsessi vahel on levinum ja oklusiivse kahjustuse distaalne olemus, need. Protsessi on sagedamini kaasatud suhteliselt väiksemad arterid, mis raskendab kirurgilist ravi ja halvendab prognoosi.
Epidemioloogia
Südame isheemiatõve tekkerisk on suhkurtõvega inimestel 6 korda suurem kui diabeedita inimestel, samas kui meestel ja naistel on see sama. Arteriaalne hüpertensioon avastatakse 20% I tüüpi diabeediga patsientidest ja 75% II tüüpi diabeediga patsientidest. Üldiselt esineb diabeeti põdevatel patsientidel 2 korda sagedamini kui inimestel, kellel seda ei esine. Perifeersete veresoonte oblitereeriv ateroskleroos areneb 10% diabeediga patsientidest. Aju trombemboolia areneb 8% diabeediga patsientidest (2-4 korda sagedamini kui diabeedita inimestel).
Kliinilised ilmingud
Põhimõtteliselt ei erine need diabeedita inimeste omadest. CD-2 kliinilises pildis tulevad sageli esile makrovaskulaarsed tüsistused (müokardiinfarkt, insult, jala veresoonte oklusiivne kahjustus) ja just nende väljakujunemise käigus avastatakse patsiendil sageli esmakordselt hüperglükeemia. Võimalik, et kaasuva autonoomse neuropaatia tõttu kulgeb kuni 30% diabeediga inimeste müokardiinfarktidest ilma tüüpilise stenokardiahoota (valutu infarkt).
Diagnostika
Ateroskleroosi tüsistuste (pärgarteritõbi, tserebrovaskulaarne õnnetus, jalaarterite oklusiivne kahjustus) diagnoosimise põhimõtted ei erine diabeedita inimeste omadest. Mõõtmine vererõhk(BP) tuleks läbi viia igal diabeediga patsiendi arstivisiidil ja näitajate määramisel. lipiidide spekter vereanalüüs (üldkolesterool, triglütseriidid, LDL, HDL) diabeediga tuleks läbi viia vähemalt kord aastas.
Diferentsiaaldiagnoos
Muud südame-veresoonkonna haigused, sümptomaatiline arteriaalne hüpertensioon, sekundaarne düslipideemia.
Ravi
♦ Vererõhu kontroll. Süstoolse vererõhu õige tase diabeedi korral on alla 130 mmHg ja diastoolne 80 mmHg (tabel 7.3). Enamik patsiente vajab selle eesmärgi saavutamiseks mitut antihüpertensiivset ravimit. Diabeedi antihüpertensiivse ravi valikravimiteks on AKE inhibiitorid ja angiotensiini retseptori blokaatorid, millele vajadusel lisatakse tiasiiddiureetikume. Müokardiinfarkti põdenud diabeedihaigete valikravimid on β-blokaatorid.
♦ Düslipideemia korrigeerimine. Lipiidide spektri indikaatorite sihttasemed on esitatud tabelis. 7.3. Lipiidide taset langetava ravi valikravimid on 3-hüdroksü-3-metüülglutarüül-CoA reduktaasi inhibiitorid (statiinid).
♦ Trombotsüütidevastane ravi. Aspiriinravi (75-100 mg / päevas) on näidustatud üle 40-aastastele diabeediga patsientidele, kellel on suurenenud risk kardiovaskulaarsete patoloogiate tekkeks (koormatud perekonna ajalugu, arteriaalne hüpertensioon, suitsetamine, düslipideemia, mikroalbuminuuria), samuti kõigile patsientidele. ateroskleroosi kliiniliste ilmingutega sekundaarse ennetusena.
♦ Koronaararterite haiguse skriinimine ja ravi. Koormustestid südame isheemiatõve välistamiseks on näidustatud südame-veresoonkonna haiguste sümptomitega patsientidele, samuti patoloogia avastamisel EKG-ga.
Prognoos
75% T2DM patsientidest ja 35% T1DM patsientidest sureb südame-veresoonkonna haigustesse. Ligikaudu 50% suhkurtõve-2 patsientidest sureb südame isheemiatõve tüsistuste tõttu, 15% aju trombemboolia tõttu. Diabeedihaigete suremus müokardiinfarkti ületab 50%.
7.8.2. Diabeetiline retinopaatia
Diabeetiline retinopaatia(DR) - võrkkesta veresoonte mikroangiopaatia, mida iseloomustab mikroaneurüsmide, hemorraagiate, eksudatiivsete muutuste ja äsja moodustunud veresoonte vohamine, mis põhjustab osalist või täielikku nägemise kaotust (tabel 7.17).
Etioloogia
DR-i arengu peamine etioloogiline tegur on krooniline hüperglükeemia. Muud tegurid (arteriaalne hüpertensioon, düslipideemia, suitsetamine, rasedus jne) on vähem olulised.
Patogenees
DR-i patogeneesi peamised lingid on:
Võrkkesta veresoonte mikroangiopaatia, mis põhjustab vaskulaarse valendiku ahenemist hüpoperfusiooni tekkega;
Veresoonte degeneratsioon koos mikroaneurüsmide moodustumisega;
Progresseeruv hüpoksia, mis stimuleerib veresoonte proliferatsiooni ja põhjustab rasvade degeneratsiooni ja kaltsiumisoolade ladestumist võrkkestas;
Tab. 7.17. Diabeetiline retinopaatia
 eksudatsiooniga mikroinfarktid, mis põhjustavad pehmete "puuvillalaikude" moodustumist;
eksudatsiooniga mikroinfarktid, mis põhjustavad pehmete "puuvillalaikude" moodustumist;
Lipiidide ladestumine koos tihedate eksudaatide moodustumisega;
Võrkkesta vohavate veresoonte kasv koos šuntide ja aneurüsmide moodustumisega, mis põhjustab veenide laienemist ja võrkkesta hüpoperfusiooni süvenemist;
Varastamise nähtus koos isheemia edasise progresseerumisega, mis on infiltraatide ja armide tekke põhjuseks;
Võrkkesta eraldumine selle isheemilise lagunemise ja vitreoretinaalse tõmbe moodustumise tagajärjel;
Klaaskeha hemorraagia hemorraagilise südameinfarkti, ulatusliku veresoonte invasiooni ja aneurüsmide rebendi tagajärjel;
Iirise veresoonte proliferatsioon (diabeetiline rubeoos), mis viib sekundaarse glaukoomi tekkeni;
Makulopaatia võrkkesta tursega.
Epidemioloogia
DR on arenenud riikide tööealise elanikkonna seas kõige levinum pimedaks jäämise põhjus ning diabeedihaigete pimedaksjäämise risk on 10-20 korda suurem kui üldpopulatsioonil. CD-1 diagnoosimise ajal ei leitud DR-i peaaegu ühelgi patsiendil, 5 aasta pärast tuvastatakse haigus 8% patsientidest ja 30-aastase diabeedi korral - 98% patsientidest. CD-2 diagnoosimise ajal avastatakse DR 20-40% patsientidest ja viieteistkümneaastase kogemusega patsientide hulgas CD-2 - 85%. 1. tüüpi diabeedi korral esineb suhteliselt sagedamini proliferatiivset retinopaatiat ja 2. tüüpi diabeedi korral makulopaatiat (75% makulopaatia juhtudest).
Kliinilised ilmingud
Üldtunnustatud klassifikatsiooni järgi on DR-i 3 etappi
(Tabel 7.18).
Diagnostika
Täielik oftalmoloogiline uuring, sealhulgas otsene oftalmoskoopia koos võrkkesta pildistamisega, on näidustatud suhkurtõvega patsientidele 1 3-5 aastat pärast haiguse algust ja suhkurtõvega 2 patsientidele kohe pärast selle avastamist. Edaspidi tuleb selliseid uuringuid korrata igal aastal.
Tab. 7.18. Diabeetilise retinopaatia klassifikatsioon
 Diferentsiaaldiagnoos
Diferentsiaaldiagnoos
Muud silmahaigused diabeediga patsientidel.
Ravi
Diabeetilise retinopaatia, aga ka teiste hiliste tüsistuste ravi põhiprintsiip on suhkurtõve optimaalne kompenseerimine. Kõige tõhusam diabeetilise retinopaatia ravi ja pimeduse ennetamine on laser fotokoagulatsioon. Eesmärk
 Riis. 7.11. Diabeetiline retinopaatia:
Riis. 7.11. Diabeetiline retinopaatia:
a) leviku tõkestamine; b) preproliferatiivne; c) proliferatiivne
laserfotokoagulatsioon on äsja moodustunud veresoonte funktsioneerimise lõpetamine, mis kujutavad endast peamist ohtu selliste tõsiste tüsistuste tekkele nagu hemoftalmus, võrkkesta tõmbe irdumine, iirise rubeoos ja sekundaarne glaukoom.
Prognoos
Pimedus registreeritakse 2% DM-ga patsientidest (3–4% DM-1 patsientidest ja 1,5–2% DM-2 patsientidest). Uute DR-iga seotud pimedaksjäämise juhtude hinnanguline esinemissagedus on 3,3 juhtu 100 000 elaniku kohta aastas. DM-1 korral põhjustab HbA1c langus 7,0% -ni DR-i tekkeriski vähenemise 75% ja DR-i progresseerumise riski vähenemise 60%. T2DM-i korral vähendab HbA1c 1% võrra DR-i väljakujunemise riski 20%.
7.8.3. Diabeetiline nefropaatia
Diabeetiline nefropaatia(DNP) on defineeritud kui albuminuuria (rohkem kui 300 mg albumiini päevas või proteinuuria üle 0,5 g valku päevas) ja/või neerude filtreerimisfunktsiooni langus diabeediga inimestel kuseteede infektsioonide, südamepuudulikkuse puudumisel. või muu neeruhaigus. Mikroalbuminuuria on defineeritud kui albumiini eritumine 30-300 mg / päevas või 20-200 μg / min.
Etioloogia ja patogenees
DNF-i peamised riskitegurid on suhkurtõve kestus, krooniline hüperglükeemia, arteriaalne hüpertensioon, düslipideemia ja neeruhaigus vanematel. DNF mõjutab seda peamiselt glomerulaaraparaat neerud.
1. Üks võimalikest mehhanismidest, mille abil hüperglükeemia soodustab glomerulaarkahjustuste teket, on sorbitooli akumuleerumine glükoosi metabolismi polüooliraja aktiveerimise tõttu, samuti mitmed glükoosi lõpp-produktid.
2. Hemodünaamilised häired, nimelt intraglomerulaarne arteriaalne hüpertensioon(kõrgenenud vererõhk neeru glomerulites) on patogeneesi oluline komponent
Intraglomerulaarse hüpertensiooni põhjuseks on arterioolide toonuse rikkumine: sissevoolu laienemine ja väljavoolu kitsenemine.
Tab. 7.19. Diabeetiline nefropaatia
 See omakorda toimub mitmete humoraalsete tegurite, nagu angiotensiin-2 ja endoteliin, mõjul, samuti glomerulite basaalmembraani elektrolüütide omaduste rikkumise tõttu. Lisaks soodustab intraglomerulaarset hüpertensiooni süsteemne hüpertensioon, mis määratakse enamikul DNF-ga patsientidel. Intraglomerulaarse hüpertensiooni tõttu kahjustuvad basaalmembraanid ja filtratsioonipoorid,
See omakorda toimub mitmete humoraalsete tegurite, nagu angiotensiin-2 ja endoteliin, mõjul, samuti glomerulite basaalmembraani elektrolüütide omaduste rikkumise tõttu. Lisaks soodustab intraglomerulaarset hüpertensiooni süsteemne hüpertensioon, mis määratakse enamikul DNF-ga patsientidel. Intraglomerulaarse hüpertensiooni tõttu kahjustuvad basaalmembraanid ja filtratsioonipoorid,
mille jälje kaudu (mikroalbuminuuria), ja seejärel märkimisväärses koguses albumiini (proteinuuria). Basaalmembraanide paksenemine põhjustab nende elektrolüütide omaduste muutumise, mis iseenesest toob kaasa suurema koguse albumiini sattumise ultrafiltraati ka siis, kui filtratsioonipooride suurus ei muutu.
3. Geneetiline eelsoodumus. Arteriaalne hüpertensioon esineb sagedamini DNF-iga patsientide sugulastel. On tõendeid seose kohta DNP ja ACE geeni polümorfismi vahel. Mikroskoopiliselt näitab DNF glomerulite basaalmembraanide paksenemist, mesangiumi laienemist, samuti fibrootilisi muutusi sisse- ja väljavoolu arterioolides. Lõppstaadiumis, mis kliiniliselt vastab kroonilisele neerupuudulikkusele (CRF), määratakse fokaalne (Kimmelstil-Wilson) ja seejärel difuusne glomeruloskleroos.
Epidemioloogia
Mikroalbuminuuria määratakse 6-60% DM-1-ga patsientidest 5-15 aastat pärast selle avaldumist. DNF määratakse 35%-l CD-1-ga patsientidest, sagedamini meestel ja isikutel, kellel tekkis CD-1 alla 15-aastaselt. SD-2 abil areneb DNF 25% Euroopa rassist ja 50% Aasia rassist. DNP üldine levimus DM-2 puhul on 4-30%.
Kliinilised ilmingud
Suhteliselt varajane kliiniline ilming, mis on kaudselt seotud DNP-ga, on arteriaalne hüpertensioon. Muud kliiniliselt ilmsed ilmingud on hilised. Nende hulka kuuluvad nefrootilise sündroomi ja kroonilise neerupuudulikkuse ilmingud.
Diagnostika
Diabeediga inimeste DNP skriinimine hõlmab iga-aastast testimist mikroalbuminuuria DM-1-ga 5 aastat pärast haiguse algust ja DM-2-ga - kohe pärast selle avastamist. Lisaks on teil vaja arvutamiseks vähemalt kord aastas määrata kreatiniini tase glomerulaarfiltratsiooni kiirus (GFR). GFR-i saab arvutada erinevate valemitega, näiteks Cockcroft-Gault'i valemiga:
Meestel: a = 1,23 (norm GFR 100 - 150 ml / min) Naistel: a = 1,05 (norm GFR 85 - 130 ml / min)
DNF-i algstaadiumis võib tuvastada GFR tõusu, mis kroonilise neerupuudulikkuse progresseerumisel järk-järgult väheneb. Mikroalbuminuuriat hakatakse määrama 5-15 aastat pärast CD-1 tekkimist; DM-2 puhul tuvastatakse see 8-10% juhtudest kohe pärast avastamist, tõenäoliselt haiguse pika asümptomaatilise kulgemise tõttu enne diagnoosi panemist. Ilmse proteinuuria või albuminuuria arenemise haripunkt I tüüpi diabeedi korral saabub 15–20 aastat pärast selle tekkimist. Proteinuuria näitab pöördumatus DNF, mis varem või hiljem viib kroonilise neerupuudulikkuseni. Ureemia tekib keskmiselt 7-10 aastat pärast ilmse proteinuuria tekkimist. Tuleb märkida, et GFR ei korreleeru proteinuuriaga.
Diferentsiaaldiagnoos
Muud proteinuuria ja neerupuudulikkuse põhjused diabeediga inimestel. Enamasti kombineeritakse DNF-i arteriaalse hüpertensiooni, diabeetilise retinopaatia või neuropaatiaga, mille puudumisel peaks diferentsiaaldiagnostika olema eriti ettevaatlik. 10% juhtudest DM-1 ja 30% juhtudest DM-2 puhul ei ole proteinuuria DNP-ga seotud.
Ravi
♦ Primaarse ja sekundaarse põhitingimused ärahoidmine
DNF diabeedi kompenseerimine ja normaalse süsteemse vererõhu säilitamine. Lisaks tähendab DNP esmane ennetamine valgu tarbimise vähenemist - vähem kui 35% päevasest kalorikogusest.
♦ Etappide kaupa mikroalbuminuuria ja proteinuuria patsientidele näidatakse AKE inhibiitorite või angiotensiini retseptori blokaatorite määramist. Samaaegse arteriaalse hüpertensiooniga määratakse need antihüpertensiivsetes annustes, vajadusel kombinatsioonis teiste antihüpertensiivsete ravimitega. Normaalse vererõhu korral määratakse need ravimid annustes, mis ei põhjusta hüpotensiooni teket. Nii AKE inhibiitorid (koos CD-1 ja CD-2) kui ka angiotensiini retseptori blokaatorid (koos CD-2-ga) aitavad vältida mikroalbuminuuria üleminekut proteinuuriaks. Mõnel juhul elimineeritakse selle ravi taustal koos diabeedi kompenseerimisega teiste parameetritega mikroalbuminuuria. Lisaks on alates mikroalbuminuuria staadiumist vajalik
valgu tarbimise vähendamine alla 10% päevasest kalorikogusest (või alla 0,8 grammi kehakaalu kilogrammi kohta) ja soola alla 3 grammi päevas.
♦ Laval Krooniline neerupuudulikkus, reeglina on vajalik antihüperglükeemilise ravi korrigeerimine. Enamik suhkurtõve-2 patsiente tuleb üle viia insuliinravile, kuna TSP kuhjumisega kaasneb raske hüpoglükeemia tekke oht. Enamikul suhkurtõvega patsientidel on insuliinivajadus vähenenud, kuna neerud on selle metabolismi üks peamisi kohti. Kui seerumi kreatiniini tase tõuseb 500 μmol / L või rohkem, on vaja tõstatada küsimus patsiendi ettevalmistamise kohta kehaväliseks (hemodialüüs, peritoneaaldialüüs) või kirurgiliseks (neeru siirdamine) ravimeetodiks. Neeru siirdamine on näidustatud kreatiniinisisalduse korral kuni 600–700 μmol / L ja glomerulaarfiltratsiooni kiiruse vähenemise korral alla 25 ml / min, hemodialüüsi - vastavalt 1000–1200 μmol / L ja alla 10 ml / min.
Prognoos
50%-l T1DM-ga ja 10%-l T2DM-ga patsientidest, kellel avastatakse proteinuuria, areneb järgmise 10 aasta jooksul krooniline neerupuudulikkus. 15% kõigist alla 50-aastaste I tüüpi diabeediga patsientide surmajuhtumitest on seotud kroonilise neerupuudulikkusega DNF-i tõttu.
7.8.4. Diabeetiline neuropaatia
Diabeetiline neuropaatia(DNE) on närvisüsteemi kahjustuse sündroomide kombinatsioon, mida saab klassifitseerida sõltuvalt selle erinevate osakondade (sensorimotoorne, autonoomne) valdav osalus protsessis, samuti kahjustuse levimus ja raskusaste (tabel 7.20). ).
ma Sensomotoorne neuropaatia:
Sümmeetriline;
Fokaalne (mononeuropaatia) või polüfokaalne (kraniaalne, proksimaalne motoorne, jäsemete ja kehatüve mononeuropaatia).
II. Autonoomne (autonoomne) neuropaatia:
Kardiovaskulaarne (ortostaatiline hüpotensioon, südame denervatsiooni sündroom);
Seedetrakt (mao atoonia, sapiteede düskineesia, diabeetiline enteropaatia);
Urogenitaalne (koos põie- ja seksuaalfunktsiooni häiretega);
Patsiendi vähenenud võime ära tunda hüpoglükeemiat;
Pupillide düsfunktsioon;
Higinäärmete talitlushäired (distaalne anhidroos, liighigistamine toiduga).
Tab. 7.20. Diabeetiline neuropaatia
 Etioloogia ja patogenees
Etioloogia ja patogenees
DNE peamine põhjus on hüperglükeemia. Soovitatakse mitmeid selle patogeneesi mehhanisme:
Glükoosi metabolismi polüooliraja aktiveerumine, mille tulemusena toimub närvirakkudes sorbitooli, fruktoosi akumuleerumine ning müoinositooli ja glutatiooni sisalduse vähenemine. See omakorda toob kaasa vabade radikaalide protsesside aktiveerumise ja lämmastikoksiidi taseme languse;
Närvirakkude membraani ja tsütoplasmaatiliste valkude mitteensümaatiline glükosüülimine;
Mikroangiopaatia vasa nervorum, mis põhjustab kapillaaride verevoolu aeglustumist ja närvide hüpoksiat.
Epidemioloogia
DNE levimus mõlemat tüüpi diabeedi korral on umbes 30%. DM-1 korral hakatakse seda 5 aasta pärast haiguse algusest tuvastama 10% patsientidest. Uute DNE juhtude esinemissagedus T2DM-is on ligikaudu 6% patsientidest aastas. Kõige tavalisem variant on distaalne sümmeetriline sensomotoorne DNE.
Kliinilised ilmingud
Sensorimootor DNE avaldub motoorsete ja sensoorsete häirete kompleksina. Distaalse DNE tavaline sümptom on paresteesia, mis väljenduvad "hiilimistundes", tuimuses. Patsiendid kurdavad sageli külmade jalgade üle, kuigi need jäävad katsudes soojaks, mis on märk, mis eristab polüneuropaatiat isheemilistest muutustest, kui jalad on puudutamisel külmad. Sensoorse neuropaatia varajane ilming on vibratsioonitundlikkuse rikkumine. Iseloomulik on rahutute jalgade sündroom, mis on öise paresteesia ja ülitundlikkuse kombinatsioon. Jalavalu sagedamini häiritakse öösel, samas kui mõnikord ei kannata patsient teki puudutust. Tavaliselt võib valu, erinevalt arteriaalse haiguse hävitamisest, leevendada kõndimisega. Aastate jooksul võib valu spontaanselt lakata valutundlikkuse eest vastutavate väikeste närvikiudude surma tõttu. Hüpoesteesia väljendub "sukade" ja "kinnaste" tüüpide tundlikkuse kaotuses. Sügava propriotseptiivse tundlikkuse halvenemine põhjustab koordinatsiooni halvenemist ja liikumisraskusi (sensoorne ataksia). Patsient kaebab "teiste inimeste jalgade" üle, tunne, et "seisab vati peal". Troofilise innervatsiooni rikkumine põhjustab degeneratiivseid muutusi nahas, luudes ja kõõlustes. Valutundlikkuse rikkumine põhjustab jalgade sagedasi, patsiendile märkamatuid mikrotraumasid, mis on kergesti nakatunud. Koordinatsiooni- ja kõndimishäired põhjustavad jala liigeste koormuse mittefüsioloogilist ümberjaotumist. Selle tulemusena katkevad anatoomilised suhted jala luu- ja lihaskonna süsteemis.
Jalavõlvi deformeerub, tekivad tursed, luumurrud, kroonilised mädased protsessid (vt p 7.8.5).
Autonoomsel päeval on mitu vormi. Põhjus kardiovaskulaarne vorm- kardiopulmonaarse kompleksi ja suurte veresoonte innervatsiooni rikkumine. Vagusnärv on pikim närv ja seetõttu mõjutab see varem kui teised. Sümpaatsete mõjude ülekaalu tõttu rahuoleku tahhükardia. Ilmub ebapiisav reaktsioon ortostaasile ortostaatiline hüpotensioon ja minestus. Kopsu-südame kompleksi vegetatiivne denervatsioon viib südame löögisageduse varieeruvuse puudumiseni. Valutu müokardiinfarkti suurenenud esinemissagedus diabeediga patsientide seas on seotud autonoomse neuropaatiaga.
Sümptomid seedetrakti vorm PÄEVAD on gastroparees koos hilinenud või, vastupidi, kiire mao tühjenemisega, mis võib tekitada raskusi insuliinravi valikul, kuna süsivesikute imendumise aeg ja maht varieeruvad määramatult; söögitoru atoonia, refluksösofagiit, düsfaagia; vesine kõhulahtisus. Sest urogenitaalne vorm DAY-d iseloomustab kusejuhade ja põie atoonia, mis põhjustab kalduvust kuseteede infektsioonidele; erektsioonihäired (umbes 50% diabeediga patsientidest); retrograadne ejakulatsioon.
Teised autonoomse DNE võimalikud ilmingud on hüpoglükeemia äratundmisvõime halvenemine, pupillide funktsiooni kahjustus, higinäärmete funktsiooni kahjustus (anhidroos), diabeetiline amüotroofia.
Diagnostika
Diabeediga patsientide neuroloogiline läbivaatus tuleb läbi viia igal aastal. See hõlmab vähemalt distaalse sensomotoorse neuropaatia testimist. Selleks kasutatakse vibratsioonitundlikkuse hindamist gradueeritud häälekahvli abil, puutetundlikkust monofilamendi abil, samuti temperatuuri- ja valutundlikkust. Vastavalt näidustustele uuritakse autonoomse närvisüsteemi seisundit: südame parasümpaatilise innervatsiooni puudulikkuse diagnoosimiseks kasutatakse mitmeid funktsionaalseid teste, näiteks südame löögisageduse mõõtmist sügaval hingamisel koos varieeruvuse hindamisega.
pulsisagedus ja Valsalva test; südame sümpaatilise innervatsiooni puudulikkuse diagnoosimiseks kasutatakse ortostaatilist testi.
Diferentsiaaldiagnoos
Teise päritoluga neuropaatiad (alkohoolne, ureemiline, B 12 -vaegusaneemiaga jne). Autonoomsest neuropaatiast tingitud elundi düsfunktsiooni diagnoos tehakse alles pärast elundipatoloogia välistamist.
Ravi
1. Antihüperglükeemilise ravi optimeerimine.
2. Jalgade hooldus (vt p 7.8.5).
3. Neurotroopsete ravimite (α-lipoehape) efektiivsust ei kinnitata kõigis uuringutes.
4. Sümptomaatiline ravi (valu vaigistamine, sildenafiil erektsioonihäirete korral, fludrokortisoon ortostaatilise hüpotensiooni korral jne).
Prognoos
Algstaadiumis võib DNE olla pöörduv püsiva DM-i kompenseerimise taustal. DNE määratakse 80% haavandiliste kahjustustega patsientidest ja see on jala amputatsiooni peamine riskitegur
7.8.5. Diabeetilise jala sündroom
Diabeetilise jala sündroom(SDS) on jalalaba patoloogiline seisund diabeedi korral, mis tekib perifeersete närvide, naha ja pehmete kudede, luude ja liigeste kahjustuse taustal ning avaldub ägedate ja krooniliste haavandite, osteoartikulaarsete kahjustuste ja mädaste nekrootiliste protsessidena (tabel 7.21). .
Etioloogia ja patogenees
SDS-i patogenees on mitmekomponentne ja seda esindab neuropaatiliste ja perfusioonihäirete kombinatsioon, millel on väljendunud kalduvus infektsioonidele. Lähtudes ühe või teise loetletud teguri ülekaalust patogeneesis, eristatakse 3 peamist vormi
Tab. 7.21. Diabeetilise jala sündroom
 I. Neuropaatiline vorm(60-70 %):
I. Neuropaatiline vorm(60-70 %):
Osteoartropaatia puudub;
Diabeetilise osteoartropaatiaga.
II. Neuroisheemia (segatud) vorm(15-20 %).
III. Isheemiline vorm(3-7 %).
SDS-i neuropaatiline vorm. Diabeetilise neuropaatia korral on kahjustatud peamiselt pikimate närvide distaalsed osad. Troofiliste impulsside pikaajaline defitsiit põhjustab naha, luude, sidemete, kõõluste ja lihaste hüpotroofiat. Sidestruktuuride hüpotroofia tagajärjeks on jalalaba deformatsioon koos tugikoormuse mittefüsioloogilise ümberjaotusega ja selle liigne suurenemine teatud piirkondades. Nendes kohtades, näiteks metatarsaalpeade projektsiooni piirkonnas, täheldatakse naha paksenemist ja hüperkeratoosi teket. Pidev surve nendele piirkondadele viib aluseks olevate pehmete kudede põletikulise autolüüsini, mis loob eeldused haavandi tekkeks. Atroofia ja nõrgenenud higistamise tagajärjel muutub nahk kuivaks ja lõheneb kergesti. Valutundlikkuse vähenemise tõttu ei pööra patsient sageli toimuvatele muutustele tähelepanu. Ta ei suuda õigeaegselt tuvastada jalatsite ebamugavust, mis põhjustab marrastuste ja kalluste moodustumist, ei märka võõrkehade sissetoomist, väikseid haavu pragunemise kohtadesse. Olukorda raskendab sügava tundlikkuse rikkumine, mis väljendub kõnnaku rikkumises, jala vales paigaldamises. Kõige tavalisem haavandiline defekt on nakatunud stafülokokkide, streptokokkide, soolerühma bakteritega; sageli liitub anaeroobne floora. Neuropaatiline osteoartropaatia on jala osteoartikulaarse aparatuuri väljendunud düstroofsete muutuste (osteoporoos, osteolüüs, hüperostoos) tagajärg.
SDS-i isheemiline vorm on alajäsemete arterite ateroskleroosi tagajärg, mis viib peamise verevoolu rikkumiseni, st. on üks diabeetilise makroangiopaatia variante.
Epidemioloogia
SDS-i täheldatakse 10-25% -l ja teatud andmetel ühel või teisel kujul 30-80% diabeediga patsientidest. Ameerika Ühendriikides on diabeedi ja DFS-iga patsientide ravi aastane kulu 1 miljard dollarit.
Kliinilised ilmingud
Kell neuropaatiline vorm SDS eristab kahte kõige levinumat tüüpi kahjustusi: neuropaatilised haavandid ja osteoartropaatia (koos
 Riis. 7.12. Neuropaatiline haavand diabeetilise jala sündroomi korral
Riis. 7.12. Neuropaatiline haavand diabeetilise jala sündroomi korral
 Riis. 7.13. Charcoti liiges diabeetilise jala sündroomi korral
Riis. 7.13. Charcoti liiges diabeetilise jala sündroomi korral
Charcoti ühine). Neuropaatilised haavandid reeglina on need lokaliseeritud talla- ja sõrmedevaheliste ruumide piirkonda, st. jalalaba kõige suurema surve all olevatel aladel (joonis 7.12).
Destruktiivsed muutused jala osteo-ligamentaalses aparaadis võivad areneda mitme kuu jooksul ja põhjustada luu tõsist deformatsiooni - diabeetiline osteoartropaatia ja moodustamine Charcot liigend samas kui jalga võrreldakse piltlikult "kondikotiga"
Kell SDS isheemiline vorm
jalgade nahk on külm, kahvatu või tsüanootiline; harvemini on sellel roosakaspunane toon, mis on tingitud pindmiste kapillaaride laienemisest vastusena isheemiale. Haavandilised defektid tekivad akraalse nekroosina – sõrmeotstel, kandade servapinnal (joon. 7.14).
Pulss jalalaba, popliteaal- ja reiearterite arterites on nõrgenenud või ei ole palpeeritav.
Tavaliselt esineb patsientidel vahelduvat lonkamist. Jäseme isheemiliste kahjustuste raskusastme määravad kolm peamist tegurit: stenoosi raskusaste, kollateraalse verevoolu areng ja vere hüübimissüsteemi seisund.
Diagnostika
Diabeedihaige jalgu tuleks kontrollida iga kord arstivisiidi ajal, vähemalt kord poole aasta jooksul. SDS-i diagnostika hõlmab:
 Riis. 7.14. Akranekroos diabeetilise jala sündroomi isheemilises vormis
Riis. 7.14. Akranekroos diabeetilise jala sündroomi isheemilises vormis
Jalgade uurimine;
Neuroloogilise seisundi hindamine - erinevat tüüpi tundlikkus, kõõluste refleksid, elektromüograafia;
Arteriaalse verevoolu seisundi hindamine - angiograafia, doppleromeetria, dopplerograafia;
Jalgade ja pahkluu liigeste röntgen;
Haavaerituse bakterioloogiline uuring.
Diferentsiaaldiagnoos
Seda viiakse läbi erineva päritoluga jalgade haavaprotsesside, aga ka muude alajäsemete veresoonte oklusiivsete haiguste ja jala liigeste patoloogiaga. Lisaks on vaja eristada DFS-i kliinilisi vorme (tabel 7.22).
Ravi
Ravi neuropaatiliselt nakatunud SDS-i vormid sisaldavad järgmisi meetmeid:
Diabeedi kompenseerimise optimeerimine, reeglina insuliini annuse suurendamine ja suhkurtõve-2 korral - üleviimine sellele;
süsteemne antibiootikumravi;
Jala täielik mahalaadimine (see võib viia aastaid eksisteerinud haavandite paranemiseni);
Kohalik haavaravi koos hüperkeratoosi piirkondade eemaldamisega;
Jalgade hooldus, õige valik ja spetsiaalsete jalatsite kandmine. Õigeaegne konservatiivne ravi võimaldab
vältida operatsiooni 95% juhtudest.
Tab. 7.22. SDS-i kliiniliste vormide diferentsiaaldiagnostika
 Ravi isheemiline VTS-vormid hõlmavad järgmist:
Ravi isheemiline VTS-vormid hõlmavad järgmist:
Diabeedi kompenseerimise optimeerimine, reeglina insuliini annuse suurendamine ja suhkurtõve-2 korral - üleviimine sellele;
Nekrootiliste haavandiliste kahjustuste puudumisel ergoteraapia (1-2-tunnine kõndimine päevas, mis aitab kaasa kollateraalse verevoolu arengule);
kahjustatud veresoonted;
Konservatiivne ravi: antikoagulandid, aspiriin (kuni 100 mg / päevas), vajadusel fibrinolüütikumid, prostaglandiin E1 ja prostatsükliini preparaadid.
Ulatusliku mäda-nekrootilise kahjustuse tekkimisega kõigis SDS-i variantides tõstatatakse amputatsiooni küsimus.
Prognoos
Diabeedihaigete osakaal langeb 50–70% teostatud jala amputatsioonide koguarvust. Diabeedihaigetel tehakse jalgade amputatsiooni 20-40 korda sagedamini kui mittediabeetilistel patsientidel.
7.9. DIABEED JA RASEDUS
Rasedusdiabeet(GDM) on glükoositaluvuse rikkumine, mis tuvastati esmakordselt raseduse ajal (tabel 7.23). See määratlus ei välista võimalust, et süsivesikute ainevahetuse patoloogia võib eelneda rasedusele. GDM-i tuleks eristada olukordadest, kui varem diagnoositud diabeediga naine (vanuse tõttu sagedamini CD-1) rasestub.
Etioloogia ja patogenees
GDM-iga on need sarnased SD-2-ga. Munasarjade ja platsenta steroidide kõrge tase, samuti kortisooli moodustumise suurenemine neerupealiste koores põhjustavad raseduse ajal füsioloogilise insuliiniresistentsuse kujunemist. GDM-i tekkimist seostatakse asjaoluga, et raseduse ajal loomulikult tekkiv insuliiniresistentsus ja seetõttu eelsoodumusega isikute suurenenud insuliinivajadus ületab pankrease β-rakkude funktsionaalse võimekuse. Pärast sünnitust, hormonaalsete ja metaboolsete suhete taastumisega algsele tasemele, see tavaliselt kaob.
Tab. 7.23. Rasedusdiabeet
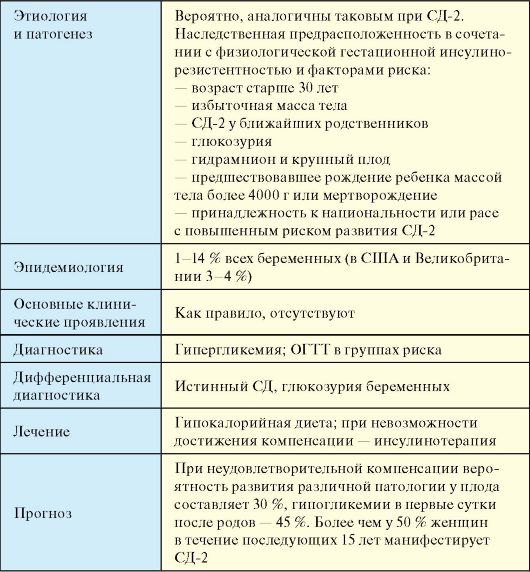 GDM areneb tavaliselt 2. trimestri keskel, raseduse 4. ja 8. kuu vahel. Enamikul patsientidest on liigne kehakaal ja anamneesis SD-2 koormus. GDM-i tekke riskifaktorid, samuti naiste rühmad, kellel on madal risk GDM-i tekkeks, on toodud tabelis. 7.24.
GDM areneb tavaliselt 2. trimestri keskel, raseduse 4. ja 8. kuu vahel. Enamikul patsientidest on liigne kehakaal ja anamneesis SD-2 koormus. GDM-i tekke riskifaktorid, samuti naiste rühmad, kellel on madal risk GDM-i tekkeks, on toodud tabelis. 7.24.
Tab. 7.24. Rasedusdiabeedi tekke riskifaktorid
 Ema hüperglükeemia põhjustab lapse vereringesüsteemi hüperglükeemiat. Glükoos läbib kergesti platsentat ja läheb pidevalt ema verest lootele. Samuti toimub aktiivne aminohapete transport ja ketoonkehade ülekandmine lootele. Seevastu insuliin, glükagoon ja emalt saadavad vabad rasvhapped ei satu loote vereringesse. Esimesel 9-12 rasedusnädalal ei tooda loote kõhunääre veel oma insuliini. See aeg vastab loote organogeneesi sellele faasile, mil pideva hüperglükeemia korral võivad emal tekkida mitmesugused väärarengud (süda, selg, seljaaju, seedetrakt). Alates 12. rasedusnädalast hakkab loote kõhunääre sünteesima insuliini ning vastusena hüperglükeemiale areneb loote kõhunäärme reaktiivne hüpertroofia ja β-rakuline hüperplaasia. Hüperinsulineemia tõttu areneb loote makrosoomia, samuti letsitiini sünteesi pärssimine, mis seletab vastsündinute respiratoorse distressi sündroomi suurt esinemissagedust. β-rakkude hüperplaasia ja hüperinsulinemia tagajärjel on kalduvus raskele ja pikaajalisele hüpoglükeemiale.
Ema hüperglükeemia põhjustab lapse vereringesüsteemi hüperglükeemiat. Glükoos läbib kergesti platsentat ja läheb pidevalt ema verest lootele. Samuti toimub aktiivne aminohapete transport ja ketoonkehade ülekandmine lootele. Seevastu insuliin, glükagoon ja emalt saadavad vabad rasvhapped ei satu loote vereringesse. Esimesel 9-12 rasedusnädalal ei tooda loote kõhunääre veel oma insuliini. See aeg vastab loote organogeneesi sellele faasile, mil pideva hüperglükeemia korral võivad emal tekkida mitmesugused väärarengud (süda, selg, seljaaju, seedetrakt). Alates 12. rasedusnädalast hakkab loote kõhunääre sünteesima insuliini ning vastusena hüperglükeemiale areneb loote kõhunäärme reaktiivne hüpertroofia ja β-rakuline hüperplaasia. Hüperinsulineemia tõttu areneb loote makrosoomia, samuti letsitiini sünteesi pärssimine, mis seletab vastsündinute respiratoorse distressi sündroomi suurt esinemissagedust. β-rakkude hüperplaasia ja hüperinsulinemia tagajärjel on kalduvus raskele ja pikaajalisele hüpoglükeemiale.
Epidemioloogia
Suhkurtõbi mõjutab 0,3% kõigist fertiilses eas naistest, 0,2-0,3% rasedatest on juba alguses haigestunud diabeeti ja 1-14% rasedustest areneb või avaldub GDM tõeline diabeet. GDM-i levimus on erinevates populatsioonides erinev, näiteks USA-s avastatakse seda umbes 4% rasedatel (135 tuhat juhtu aastas).
Kliinilised ilmingud
GDM-i puudumisega. DM dekompensatsioonil võivad esineda mittespetsiifilised sümptomid.
Diagnostika
Tühja kõhu veresuhkru määramine on näidustatud kõikidele rasedatele osana biokeemilisest vereanalüüsist. Riskirühma kuuluvad naised (tabel 7.24) on näidatud, et nad teostavad suukaudne glükoositaluvuse test(OGTT). Kirjeldatud on palju võimalusi selle rakendamiseks rasedatel naistel. Lihtsaim neist eeldab järgmisi reegleid:
3 päeva enne uuringut on naine tavapärasel dieedil ja järgib oma tavapärast füüsilist aktiivsust;
Katse tehakse hommikul tühja kõhuga, pärast vähemalt 8-tunnist üleöö paastu;
Pärast tühja kõhuga vereproovi võtmist joob naine 5 minuti jooksul 75 grammi kuiva glükoosi lahust, mis on lahustatud 250–300 ml vees; glükeemia taseme uuesti määramine toimub 2 tunni pärast.
GDM-i diagnoos tehakse järgmiselt kriteeriumid:
Tühja kõhu täisvere glükoosisisaldus (venoosne, kapillaar)> 6,1 mmol/l või
Venoosse vereplasma glükoosisisaldus ≥ 7 mmol/l või
Kapillaaride täisvere või venoosse vereplasma glükoos 2 tundi pärast 75 g glükoosi ≥ 7,8 mmol/l laadimist.
Kui riskirühma naise testitulemus on normaalne, korratakse testi 24-28 rasedusnädalal.
Diferentsiaaldiagnoos
GDM ja tõeline SD; rasedate naiste glükosuuria.
Ravi
Riskid emale ja lootele, aga ka lähenemisviisid suhkurtõve ravile ja selle tõrje iseärasused GDM-i ja tõelise diabeedi korral on samad. Diabeedi hilised tüsistused raseduse ajal võivad märkimisväärselt edeneda, kuid diabeedi kvaliteetse kompenseerimise korral puuduvad raseduse katkemise näidustused. Diabeeti põdev naine (tavaliselt räägime 1. tüüpi diabeedist) peaks planeerima rasedust noores eas, mil tüsistuste risk on kõige väiksem. Kui rasedus on planeeritud, on soovitatav ravi katkestada.
vastuvõtmine mitu kuud pärast optimaalse hüvitise saavutamist. Raseduse planeerimise vastunäidustused on raskekujuline nefropaatia koos progresseeruva neerupuudulikkusega, raske koronaartõbi, raskekujuline proliferatiivne retinopaatia, mida ei saa korrigeerida, ketoatsidoos raseduse alguses (ketoonkehad on teratogeensed tegurid).
Ravi eesmärk GDM ja tõeline diabeet raseduse ajal on järgmiste laboriparameetrite saavutamine:
Glükeemia tühja kõhuga< 5-5,8 ммоль/л;
Glükeemia 1 tund pärast söömist< 7,8 ммоль/л;
Glükeemia 2 tundi pärast söömist< 6,7 ммоль/л;
Keskmine päevane glükeemiline profiil< 5,5 ммоль/л;
HbA1c tase igakuisel jälgimisel on sama, mis tervetel isikutel (4-6%).
DM-1-ga, nagu ka väljaspool rasedust, peaks naine saama intensiivset insuliinravi, kuid raseduse ajal on soovitatav glükeemia taset hinnata 7-8 korda päevas. Kui tavapäraste süstide taustal ei ole võimalik normoglükeemilist kompensatsiooni saavutada, tuleb kaaluda patsiendi üleviimist insuliinipumba abil insuliinravile.
Esimesel etapil GDM-i ravi on ette nähtud dieetteraapia, mis seisneb päevase kaloraaži piiramises umbes 25 kcal/kg tegelikust kaalust, seda eelkõige kergesti seeditavate süsivesikute ja loomsete rasvade tõttu, samuti kehalise aktiivsuse suurendamise tõttu. Kui dieetravi taustal ei ole võimalik ravi eesmärke saavutada, tuleb patsiendile määrata intensiivne insuliinravi. Kõik tabletid antihüperglükeemilised ravimid (TSP) raseduse ajal vastunäidustatud. Selgub, et insuliinravile on vaja üle viia umbes 15% naistest.
Prognoos
GDM-i ja diabeedi ebarahuldava kompenseerimise korral raseduse ajal on tõenäosus haigestuda mitmesugused patoloogiad lootel on see 30% (risk on 12 korda suurem kui üldpopulatsioonis). Rohkem kui 50% naistest, kellel diagnoositi GDM raseduse ajal, ilmneb järgmise 15 aasta jooksul SD-2.
Suhkurtõbi on keeruline haigus mida on raske ravida. Kehas arenedes rikutakse süsivesikute ainevahetust ja insuliini sünteesi vähenemist kõhunäärmes, mille tagajärjel lakkab glükoos rakkudest imendumast ja settib veres mikrokristalliliste elementide kujul. Täpsed põhjused, miks see arenema hakkab see haigus, pole teadlased veel suutnud kindlaks teha. Kuid nad tuvastasid diabeedi riskifaktorid, mis võivad vallandada selle haiguse alguse nii eakatel kui ka noortel inimestel.
Paar sõna patoloogia kohta
Enne suhkurtõve tekke riskitegurite kaalumist tuleb öelda, et seda haigust on kahte tüüpi ja igaühel neist on oma omadused. I tüüpi diabeeti iseloomustavad süsteemsed muutused organismis, mille puhul mitte ainult süsivesikute ainevahetus vaid ka kõhunäärme funktsionaalsust. Millegipärast lõpetavad tema rakud insuliini tootmise õige summa, mille tulemusena koos toiduga kehasse sattuv suhkur ei läbi lagunemisprotsesse ja seetõttu ei saa seda rakud omastada.
2. tüüpi suhkurtõbi on haigus, mille kujunemisel kõhunäärme funktsionaalsus säilib, kuid ainevahetuse häire tõttu kaotavad keharakud insuliinitundlikkuse. Selle taustal lakkab glükoos lihtsalt rakkudesse transportimisest ja settib verre.
Kuid olenemata sellest, millised protsessid suhkurtõve korral toimuvad, on selle haiguse tulemus sama - kõrge glükoosisisaldus veres, mis põhjustab tõsiseid probleeme tervisega.
Selle haiguse kõige levinumad tüsistused on:
- hüperglükeemia - veresuhkru taseme tõus väljaspool normaalset vahemikku (üle 7 mmol / l);
- hüpoglükeemia - vere glükoosisisalduse langus üle normivahemiku (alla 3,3 mmol / l);
- hüperglükeemiline kooma - veresuhkru taseme tõus üle 30 mmol / l;
- hüpoglükeemiline kooma - vere glükoosisisalduse langus alla 2,1 mmol / l;
- diabeetiline jalg - alajäsemete tundlikkuse vähenemine ja nende deformatsioon;
- - nägemisteravuse langus;
- tromboflebiit - naastude moodustumine veresoonte seintes;
- hüpertensioon - vererõhu tõus;
- gangreen - alajäsemete kudede nekroos koos järgneva abstsessi tekkega;
- insult ja müokardiinfarkt.
Diabeedi tavalised tüsistused
Need ei ole kõik tüsistused, millega suhkurtõve tekkimine on igas vanuses inimese jaoks täis. Ja selle haiguse ennetamiseks peate täpselt teadma, millised tegurid võivad provotseerida diabeedi tekkimist ja millised meetmed hõlmavad selle arengu ennetamist.
I tüüpi suhkurtõbi ja selle riskifaktorid
I tüüpi diabeeti (T1DM) diagnoositakse kõige sagedamini lastel ja noortel vanuses 20–30 aastat. Arvatakse, et selle arengu peamised tegurid on:
- viirushaigused;
- keha mürgistus;
- ebaõige toitumine;
- sagedane stress.
I tüüpi diabeedi alguses peamist rolli mängib pärilikku eelsoodumust. Kui üks pereliikmetest kannatab selle vaevuse all, on järgmise põlvkonna riskid selle tekkeks ligikaudu 10-20%.
Tuleb märkida, et antud juhul me ei räägi tuvastatud fakt, vaid eelsoodumusest. See tähendab, et kui ema või isa põeb I tüüpi diabeeti, ei tähenda see sugugi, et ka nende lastel see haigus diagnoositakse. Eelsoodumus viitab sellele, et kui inimene ei käitu ennetavad tegevused ja juhib valet elustiili, siis on tal suur risk haigestuda mitme aasta jooksul diabeetikut.

Kui mõlemal vanemal diagnoositakse diabeet korraga, suureneb risk haigestuda nende lastel mitu korda.
Kuid sel juhul tuleb meeles pidada, et kui mõlemad vanemad põevad diabeeti korraga, suureneb selle tõenäosus nende lapsel oluliselt. Ja sageli diagnoositakse seda haigust lastel isegi sellistes olukordades koolieas kuigi neil seda veel pole halvad harjumused ja plii aktiivne pilt elu.
Arvatakse, et suhkurtõbe kannab kõige sagedamini edasi meesliin... Kuid kui diabeeti põeb ainult ema, on selle haigusega lapse saamise risk väga madal (mitte rohkem kui 10%).
Viiruslikud haigused
Viirushaigused on veel üks põhjus, miks T1DM võib areneda. Sel juhul on eriti ohtlikud sellised haigused nagu mumps ja punetised. Teadlased on juba ammu tõestanud, et need haigused mõjutavad negatiivselt kõhunäärme talitlust ja kahjustavad selle rakke, alandades seega insuliini taset veres.
Tuleb märkida, et see kehtib mitte ainult juba sündinud laste kohta, vaid ka nende kohta, kes on alles emakas. Mis tahes viirushaigus, mida rase naine kannab, võib põhjustada T1DM-i arengu tema lapsel.
Keha mürgistus
Paljud inimesed töötavad tehastes ja ettevõtetes, kus nad kasutavad keemilised ained, mille toime mõjutab negatiivselt kogu organismi tööd, sealhulgas kõhunäärme funktsionaalsust.
Keemiaravi, mida kasutatakse erinevate onkoloogilised haigused, millel on ka toksiline toime keharakkudele, seetõttu suurendab nende rakendamine ka T1DM-i tekke tõenäosust inimestel mitu korda.
Ebaõige toitumine
Ebaõige toitumine on T1DM üks levinumaid põhjuseid. Igapäevane dieet kaasaegne inimene sisaldab tohutul hulgal rasvu ja süsivesikuid, mis annab suure koormuse seedeelundkond, sealhulgas kõhunääre. Aja jooksul on selle rakud kahjustatud ja insuliini süntees häiritud.

Ebaõige toitumine on ohtlik mitte ainult rasvumise tekkeks, vaid ka kõhunäärme häireks
Samuti tuleb märkida, et ebaõige toitumise tõttu võib T1DM tekkida ka 1–2-aastastel lastel. Ja selle põhjuseks on varajane sissetoomine lapse toitumisse. lehmapiim ja teraviljad.
Sage stress
Stress on provokaatorid mitmesugused haigused, sealhulgas CD1. Kui inimene on stressis, tekib tema kehas palju adrenaliini, mis aitab kaasa veresuhkru kiirele töötlemisele, mille tagajärjeks on hüpoglükeemia. See seisund on ajutine, kuid kui see esineb süstemaatiliselt, suureneb T1DM-i risk mitu korda.
II tüüpi suhkurtõbi ja selle riskifaktorid
Nagu eespool mainitud, areneb II tüüpi suhkurtõbi (T2DM) rakkude insuliinitundlikkuse vähenemise tulemusena. See võib juhtuda ka mitmel põhjusel:
- pärilik eelsoodumus;
- vanuse muutused organismis;
- ülekaalulisus;
- rasedusdiabeet.
Pärilik eelsoodumus
T2DM-i tekkes mängib pärilik eelsoodumus veelgi suuremat rolli kui T1DM-i puhul. Statistika näitab, et selle haiguse risk järglastel on sel juhul 50%, kui T2DM diagnoositi ainult emal, ja 80%, kui see haigus avastati mõlemal vanemal korraga.

Kui vanematel on T2DM, on haige lapse saamise tõenäosus oluliselt suurem kui T1DM korral
Vanusega seotud muutused kehas
Arstid peavad II tüüpi diabeeti eakate haiguseks, kuna just neil avastatakse see kõige sagedamini. Selle põhjuseks on vanusega seotud muutused kehas. Kahjuks vanusega sisemiste ja välised tegurid siseorganid"kuluvad" ja nende funktsionaalsus on häiritud. Lisaks tekib vanusega paljudel inimestel hüpertensioon, mis suurendab veelgi riski haigestuda T2DM-i.
Tähtis! Seda kõike silmas pidades soovitavad arstid tungivalt kõigile üle 50-aastastele inimestele, olenemata sellest üldine heaolu ja sugu, lase end regulaarselt testida, et määrata veresuhkru taset. Ja kui avastatakse kõrvalekaldeid, alustage kohe ravi.
Rasvumine on T2DM-i peamine põhjus nii eakatel kui ka noortel inimestel. Selle põhjuseks on rasva liigne kogunemine keharakkudesse, mille tulemusena hakkavad nad sealt energiat ammutama ning suhkrut nad enam ei vaja. Seetõttu lõpetavad rakud rasvumise korral glükoosi assimileerimise ja see ladestub verre. Ja kui inimene, kui saadaval ülekaal keha juhib ka passiivset elustiili, mis suurendab veelgi T2DM-i tõenäosust igas vanuses.

Rasvumine provotseerib mitte ainult T2DM-i, vaid ka muude terviseprobleemide ilmnemist
Rasedusdiabeet
Rasedusdiabeeti kutsuvad arstid ka "rasedusdiabeediks", kuna see areneb välja raseduse ajal. Selle esinemine on tingitud hormonaalsed häired kehas ja kõhunäärme liigne aktiivsus (ta peab töötama "kahe" jaoks). Sest suurenenud koormused see kulub ja lõpetab õiges koguses insuliini tootmise.
Pärast sünnitust see haigus kaob, kuid jätab lapse tervisele tõsise jälje. Kuna ema kõhunääre lakkab vajalikus koguses insuliini tootma, hakkab lapse kõhunääre töötama kiirendatud kiirusega, mis põhjustab tema rakkude kahjustusi. Lisaks suureneb rasedusdiabeedi tekkega loote rasvumise risk, mis suurendab ka riski haigestuda T2DM-i.
Profülaktika
Suhkurtõbi on haigus, mida on lihtne ennetada. Selleks piisab selle pidevast ennetamisest, mis hõlmab järgmisi meetmeid:
- Õige toitumine... Inimese toit peaks sisaldama palju vitamiine, mineraalaineid ja valke. Dieedis peaksid olema ka rasvad ja süsivesikud, sest ilma nendeta ei saa keha normaalselt, kuid mõõdukalt toimida. Eriti tasub ettevaatlik olla kergesti seeditavate süsivesikute ja transrasvadega, kuna need on ülekaalulisuse ja diabeedi edasise arengu peamiseks põhjuseks. Imikute puhul peaksid vanemad veenduma, et nende poolt pakutav lisatoit oleks nende kehale võimalikult kasulik. Ja mida ja mis kuul saab oma beebile kinkida, saate teada lastearstilt.
- Aktiivne elustiil... Kui jätate spordi hooletusse ja elate passiivse elustiiliga, saate hõlpsalt SD-d "teenida". Inimtegevus aitab kaasa rasvade kiirele põletamisele ja energiakulule, mille tulemusena suureneb rakkude vajadus glükoosi järele. On passiivsed inimesed ainevahetus aeglustub, mille tulemusena suureneb risk haigestuda diabeeti.
- Jälgige regulaarselt oma veresuhkrut... See reegel kehtib eriti neile, kellel on pärilik eelsoodumus sellele haigusele, ja inimesed, kes on "löögid" 50-aastased. Veresuhkru taseme jälgimiseks ei ole üldse vaja pidevalt kliinikus käia ja testida lasta. Piisab lihtsalt glükomeetri ostmisest ja kodus vereanalüüside tegemisest.
Tuleb mõista, et suhkurtõbi on haigus, mis ei allu ravile. Selle arenguga peate pidevalt võtma ravimid ja insuliini süstid. Seega, kui te ei taha oma tervise pärast alati hirmul olla, juhatage tervislik pilt elu ja õigeaegselt ravida sinus esilekerkivaid haigusi. Ainult nii saab ennetada diabeedi teket ja säilitada oma tervist pikki aastaid!
Downi sündroom ei ole haigus, see on patoloogia, mida ei saa ennetada ega ravida. 21. kromosoomipaari Downi sündroomiga lootel on kolmas lisakromosoom, mistõttu nende arv ei ole 46, vaid 47. Downi sündroomi täheldatakse ühel 600-1000 vastsündinul üle 35-aastastel naistel. põhjus, miks see juhtub, pole täielikult mõistetav. Esimesena kirjeldas seda sündroomi 1866. aastal Inglismaalt pärit arst John Langdon Down ja 1959. aastal tõestas prantsuse professor Lejeune, et see on tingitud geneetilistest muutustest.
Teatavasti saavad lapsed pooled kromosoomidest emalt ja pooled isalt. Kuna seda pole tõhus meetod Downi sündroomi ravi, haigus loetakse ravimatuks, saab kasutusele võtta meetmed ja kui on soov sünnitada laps tervena, pöörduda arstigeenide konsultatsioonile, kus vanemate kromosoomianalüüsi põhjal tehakse kindlaks, kas laps sünnib tervena või Downi sündroomiga.
Viimasel ajal sünnivad sellised lapsed sagedamini, nad seostavad seda hilise abieluga, raseduse planeerimisega 40-aastaselt. Samuti arvatakse, et kui vanaema sünnitas tütre pärast 35. eluaastat, siis võivad lapselapsed sündida Downi sündroomiga. Kuigi sünnieelne diagnoos on raske protsess uuringu läbiviimine on väga vajalik, et rasedust oleks võimalik katkestada.
Mis on Downi sündroom. Tavaliselt võib sellega kaasneda motoorse arengu hilinemine. Sellistel lastel on kaasasündinud defektid süda, elundite arengu patoloogia seedetrakti... 8% Downi sündroomiga patsientidest põeb leukeemiat. Narkootikumide ravi võib stimuleerida vaimne tegevus, normaliseerida hormonaalne tasakaalutus... Füsioteraapia protseduuride, massaaži, ravivõimlemine saate aidata oma lapsel omandada enesehoolduseks vajalikud oskused. Downi sündroom on seotud geneetiline häire, kuid see ei too alati kaasa füüsiliste ja vaimne areng laps. Sellised lapsed ja tulevikus täiskasvanud saavad osaleda kõigis eluvaldkondades, mõnest neist saavad näitlejad, sportlased ja nad saavad tegeleda avalike asjadega. See, kuidas selle diagnoosiga inimene areneb, sõltub suuresti keskkonnast, kus ta kasvab. Head tingimused, armastus ja hoolitsus aitavad kaasa täielikule arengule.
Downi sündroomi riskitabel vanuse järgi
Downi sündroomi tõenäosus sõltub ema vanusest, kuid seda saab tuvastada geneetilise testiga varajased staadiumid rasedus ja mõnel juhul ultraheli. Lapsel on sündides väiksem tõenäosus Downi sündroomiks kui raseduse varasematel etappidel. osa Downi sündroomiga looteid ei jää ellu.

Millist riski peetakse madalaks ja millist kõrgeks?
Iisraelis peetakse Downi sündroomi riski kõrgeks, kui see on suurem kui 1:380 (0,26%). Kõik, kes kuuluvad sellesse riskirühma, peavad läbima lootevee analüüsi. See risk on võrdne riskiga naistel, kes rasestuvad 35-aastaselt ja vanemad.
Riske, mis on madalamad kui 1:380, peetakse madalaks.
Kuid tuleb arvestada, et need piirid võivad ujuda! Nii näiteks Inglismaal kõrge tase riski loetakse riskiks üle 1:200 (0,5%). See on tingitud asjaolust, et mõned naised peavad riski 1:1000-st suureks ja teised 1:100-st madalaks, kuna sellise riski korral on neil võimalus haigestuda. terve laps võrdne 99%.
Downi sündroomi riskifaktorid, Edwards, Patau
Peamised riskitegurid on vanus (eriti märkimisväärne Downi sündroomi puhul), samuti kokkupuude kiirgusega, mõned raskemetallid... Tuleb meeles pidada, et ka ilma riskiteguriteta võib lootel olla patoloogia.
Nagu graafikult näha, on riskiväärtuse sõltuvus vanusest kõige olulisem Downi sündroomi puhul ja vähem oluline ülejäänud kahe trisoomia puhul:

Downi sündroomi riski sõeluuring
Tänaseks on kõigil rasedatel lisaks nõutavatele uuringutele soovitatav läbida sõeltest, et selgitada välja Downi sündroomi riskiaste lapse sünnil ja loote kaasasündinud väärarengud. Kõige produktiivsem uuring on 11. nädalal + 1 päev või 13. nädalal + 6. päeval, kui embrüo suurus on 45 mm kuni 84 mm. Rasedat saab uurida ja kasutada selleks spetsiaalset ultraheliuuringut.
Rohkem täpne diagnoos paigutatakse koorioni villus proovivõtu ja lootevee uuringu abil, mis võetakse spetsiaalse nõelaga otse loote põis... Kuid iga naine peaks teadma, et sellised meetodid on seotud raseduse tüsistuste ohuga, nagu raseduse katkemine, loote infektsioon, lapse kuulmislangus ja palju muud.
Raseduse I-II trimestri täielik kombineeritud sõeluuring võimaldab tuvastada loote kaasasündinud väärarenguid. Mida see sisaldab see test? Esiteks on see vajalik ultraheliuuringud 10-13 rasedusnädalal. Risk arvutatakse ninaluu olemasolu määramisel, vastavalt loote emakakaelavoldi laiusele, kuhu raseduse esimesel trimestril koguneb nahaalune vedelik.
Teises tehakse vereanalüüs kooriongonadotropiini kohta 10-13 nädalal ja alfa-fetovalgu kohta 16-18 nädalal. Kombineeritud sõeluuringu andmeid töödeldakse vastavalt spetsiaalsele arvutiprogramm... Teadlased on teinud ettepaneku uus tehnika sõeluuring - I ja II trimestri uurimistöö käigus saadud tulemuste hindamise kombineerimine. See võimaldab ühtselt hinnata Downi sündroomi riski raseduse ajal.
Esimesel trimestril kasutatakse PAPP-A määramise ja krae vahe paksuse mõõtmise tulemusi ning teisel trimestril AFP, konjugeerimata östriooli, hCG ja inhibiin-A kombinatsioone. Rakendus terviklik hindamine sõeluuringuks võimaldab pärast invasiivseid sekkumisi vähendada abordi sagedust normaalse karüotüübiga loodetel vastavalt tsütogeneetilise diagnostika tulemustele.
Integreeritud ja biokeemiline testimine Downi sündroomi skriinimiseks võimaldab täiendavalt tuvastada rohkemate kromosoomianomaaliate juhtumeid. See aitab vältida soovimatuid aborte, mis on tingitud amniotsenteesist või koorioni villusest.
Asjatundlik toimetaja: Mochalov Pavel Aleksandrovitš| d. m. n. arst
Haridus: Moskovski meditsiiniinstituut neid. IM Sechenov, eriala - "Üldmeditsiin" 1991. aastal, 1993. aastal "Kutsehaigused", 1996. aastal "Teraapia".